運用全因子試驗方法優化單抗生物類似藥生產過程中的糖基化分布
張磊 楊沐迪 董順 劉明秋
(1. 復旦大學生命科學學院,上海 200438;2. 上海博威生物醫藥有限公司,上海 201318)
蛋白質糖基化對蛋白質的構象、溶解度、穩定性、免疫原性以及生物學活性有較大影響[1]。根據不同的修飾位點,糖基化可分為N-端糖基化和O-端糖基化。對于單抗藥物而言,N-端糖基化是最重要的翻譯后修飾之一,該修飾起始于內質網,結束于高爾基體,與單抗穩定性、生物學活性、半衰期和免疫原性有關[1]。常見的N-端糖基化修飾包括半乳糖基化、巖藻糖基化和Man5等,不同糖基化修飾的單抗與Fc受體結合能力不同,從而影響藥物的生物學活性。例如,通過半乳糖苷酶切掉單抗的半乳糖殘基后,單抗補體依賴的細胞毒作用(CDC)活性降低了25%,而高半乳糖基化的單抗能夠提高50%的CDC活性[2-3]。此外,具有巖藻糖基化的單抗會降低其抗體依賴細胞介導的細胞毒作用(ADCC)活性[4]。而Man5修飾的單抗不僅血清半衰期短,并且具有較強的免疫原性[5-6],因此,在細胞培養過程中應盡量降低Man5修飾。
在動物細胞培養生產抗體藥物過程中,不同宿主細胞、pH、溫度、DO(溶解氧)、二氧化碳分壓、氨氮濃度等都能影響糖基化修飾過程[7-8]。近年來,越來越多的研究開始關注添加物對單抗糖基化修飾的影響,如在細胞培養中加入天冬酰胺或N-乙酰葡萄糖胺(GlcNAc)均能引起半乳糖基化降低[9-10],而加入半乳糖、錳離子等可提高單抗半乳糖基化[11-13]。另外有研究顯示,添加錳離子或甜菜堿能降低Man5[14-15]。目前,針對單抗巖藻糖基化調控的報道較少,基本停留在基因工程改良細胞株階段。
本研究以表達單抗的CHO細胞為研究對象,在前期開發中其半乳糖基化和Man5均與原研藥存在較大差異。通過全因子設計(FFD),在搖瓶培養中考察半乳糖、尿苷、氯化錳和蛋白水解物對細胞生長、單抗產量和單抗糖基化的影響并建立糖基化調控模型。在此基礎之上,通過不同規模的反應器培養驗證模型最優條件。單抗藥物的糖基化調控是生物類似藥工藝研發的重點和難點,本研究通過FFD設計優化單抗糖基化分布,從而為生物類似單抗藥物的糖基化調控提供重要科學依據。
1 材料與方法
1.1 材料
1.1.1 細胞株 試驗用細胞株為CHO-K1細胞,表達抗核因子κ B受體活化因子配體單抗,由本公司提供。
1.1.2 培養基 基礎培養基Fed-batch、流加培養基Feed 1、半乳糖、尿苷、氯化錳均購于Sigma-Aldrich公司。蛋白水解物購于Kerry公司。地諾單抗(Prolia,Amgen Inc)作為原研藥。
1.2 方法
1.2.1 種子細胞培養 從細胞庫中復蘇細胞,以0.5×106cells/ mL活細胞密度接種于搖瓶,置于36.5℃、130 r/min和5% CO2的搖床(瑞士科耐Kuhner公司)中培養。每3 d進行細胞傳代,作為試驗用種子細胞。
1.2.2 批次培養 取對數生長期細胞,以約0.5×106cells/ mL的活細胞密度接種至250 mL搖瓶中,接種體積為50 mL。通過JMP軟件設計2個中心點24全因子試驗,研究半乳糖(X1)、尿苷(X2)、氯化錳(X3)和蛋白水解物(X4)對單抗糖基化的影響。根據試驗設計進行搖瓶試驗。培養周期為14 d。每隔1 d取樣,進行細胞計數和生化分析。按廠商提供的補料方式進行流加補料。培養結束后收集培養液,于3 000 r/min離心5 min后,取上清,置于-80℃保存待用。
1.2.3 反應器培養驗證 選取最優模型條件進行1 L、3 L和15 L反應器(Applikon)培養驗證,培養體積分別為0.5 L、1.2 L和8.0 L。反應器參數設置:36.5℃,pH(7.0±0.15),DO 40%,轉速 180-250 r/min。通氣方式為Drill Hole Sparger,培養過程中不加堿。
1.2.4 測定和分析方法 通過ViCELL-XR細胞計數儀(Beckman Coulter)進行細胞計數和活率分析;氨氮濃度用Nova 400生化分析儀檢測(Nova Biomedical);單抗產量采用POROS A/20色譜柱(2.1 mm×30 mm)進行高效親和色譜檢測;上清收獲液經rProtein A親和層析柱純化后,用糖譜分析色譜柱AdvanceBio Glycan Map(2.1 mm×150 mm)進行單抗糖基化檢測,具體分離步驟見產品說明書。其中五聚高甘露糖型(YM)通過檢測直接得到,而半乳糖基化(YG)和巖藻糖基化(YF)通過公式計算得出[13]:

G0表示不含半乳糖殘基,G1表示含一個半乳糖殘基,G2表示含二個半乳糖殘基,G0F表示不含半乳糖殘基但包含一個巖藻糖殘基,G1F表示含一個半乳糖殘基和一個巖藻糖殘基,G2F表示含有二個半乳糖殘基和一個巖藻糖殘基。
2 結果
2.1 添加物對單抗產量和糖基化的影響
運用JMP軟件進行全因子試驗設計(Run1-18)并進行搖瓶培養,基于預試驗結果和Gramer[13]報道,試驗設計中X1和X2分別選擇40 mmol/L和8 mmol/L作為最高濃度,X3和X4根據本公司平臺和相關項目經驗分別選擇4 μmol/L和15 g/L為最高濃度。全因子試驗設計和結果見表1,結果顯示不同組合的添加物濃度對單抗產量并無影響。但是糖基化分布受添加物濃度的影響有較大變化,其中YG(%)最低值和最高值分別為5.2和15.2,YF(%)最低值和最高值分別為85.1和91.9,YM(%)最低值和最高值分別為8.8和19.7。

表1 半乳糖、尿苷、氯化錳和蛋白水解物對單抗產量和糖基化的影響
2.2 全因子試驗設計分析
根據全因子試驗設計(Run1-18)結果(表1),采用JMP軟件分別對響應變量YG、YF和YM進行最小二乘法分析建模。發現YG和YM出現失擬,需加入二次平方項;根據JMP軟件支持曲線擬合的特性,試驗增加隨機組Run19、Run20(評估系統誤差)和Run21加入模型。
各因素對YG、YF和YM的影響(P< 0.002)經JMP軟件擬合得到的回歸方程模型分別為:
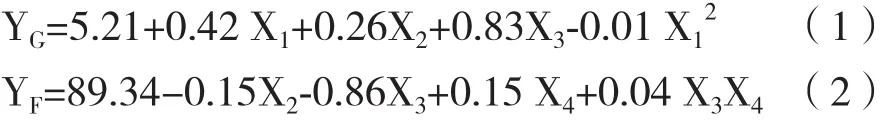
從式(1)可知,X1、X2和X3均對YG有顯著正向影響,但平方項X12系數為負,方程的拋物面開口向下,對于X1存在極大值點。式(2)顯示X4和二階交互X3X4能夠顯著提高YF,但X2和X3對YF有負向影響,需要控制X2和X3的濃度以降低對YF的不利影響。對于YM,X2、X3和X4有顯著負向影響(式3),但平方項X22系數為正,方程的拋物面開口向上,對于X2存在極小值點。
全因子試驗結果采用JMP軟件進行方差分析,結果(表2)顯示YG、YF和YM的回歸方程模型無失擬(Lack Of Fit)(P>0.05),表明模型對實驗的擬合有效。調整R2(R2Adj)與相關系數R2接近且R2>0.9,說明所有模型擬合度良好。

表2 回歸模型擬合度分析
原研藥的平均YG、YF和YM值分別為13.9%、93.0%和8.6%,而空白對照組(表1,Run1)為5.2%、89.4%和17.5%,兩者單抗糖基化分布分別相差8.7%、3.6%和8.9%。為了減少與原研藥糖基化修飾的差異,需要提高YG、YF并降低YM。根據式1,當X1在20-25 mmol/L時YG有極大值,結合中心點實驗結果選擇最優X1濃度為20 mmol/L。根據式2,當X2在2-4 mmol/L時其Man5有極小值,選擇2 mmol/L作為最適X2濃度。結合式2和式3,當X4為15 g/L時能最大化提高YF并降低YM。為了盡量減少X3對YF的不利影響(式2),通過JMP軟件進行求值,得到最優 X3的濃度為 1 μmol/L。該條件下 YG、YF、YM預測值分別為11.4%、90.9%和9.6%,與原研藥差距分別為2.5%、2.1%和1%。
2.3 添加物對細胞密度和YM的影響
在細胞培養生產過程中,活細胞密度是單抗產量的重要決定因素。為了考察不同添加物對最終活細胞密度的影響,將各實驗組(Run1-18)按添加物情況進行分組,并通過雙樣本t檢驗對數據進行統計學分析。結果(圖1)顯示添加X1實驗組(P=0.43)和添加X3實驗組(P=0.74)均不影響最終活細胞數,而添加X2實驗組(18.6±1.4)最終活細胞數低于無X2組(20.9±2.6)(P=0.04)。此外,添加X4實驗組(21.7±2.3)最終活細胞數高于無X4組(18.1±0.8)(P=0.01),該結果表明添加X4有利于細胞生長。

圖1 加入蛋白水解物對最終活細胞數的影響
Pacis等[14]報道過氨氮濃度和YM之間存在正相關性,因此有必要對培養過程中的氨氮濃度和YM之間關系進行系統的分析。根據模型優化的結果(式3),高濃度X2會提高YM,將添加X2實驗組(5.6±0.75)和無X2組(3.9±0.56)的最終氨氮濃度進行雙樣本t檢驗,兩組存在顯著差異(P<0.000 1),表明加入X2能顯著提高培養液中氨氮濃度(表3)。將收獲時氨氮濃度與YM進行作圖,發現有一定正相關性(圖2-A)。由于添加物X4可產生氨氮并降低YM,為了確認X2的影響,將添加X4的實驗組去掉,氨氮濃度(x)與YM(y)接近線性相關(y=0.285 5x+0.414 7,R2=0.815 1)(圖 2-B)。
2.4 反應器培養驗證
選取最優添加物濃度(X1為20 mmol/L,X2為2 mmol/L,X3為 1 μmol/L,X4為 15 g/L)在 1L、3L、15L反應器(BR)中進行模型驗證,結果顯示不同規模反應器之間細胞生長,細胞活率和單抗產量基本一致(圖3)。無X4條件(1L-BR*)其培養第8天之后活細胞數逐漸低于其他實驗組(圖3-A),但最終細胞活率維持較高(圖3-B)。另外,所有實驗組的單抗產量并無明顯差異(表4)。推測添加X4雖能提高活細胞數,但也會導致培養后期營養物質缺失,因此后續試驗有必要對流加補料工藝進行進一步探討。不同規模的反應器(1/3/15L-BR)中糖基化分布基本相同(表4),以15 L反應器為例,其YG、YF、YM實際值分別為11.2%、91.4%和8.2%,其中YG和YF與模型預測值差異小于0.5%,而YM差異為1.4%。同空白對照組(Run 1)相比YG、YF分別提高了6.0%和2.0%,而YM降低了9.3%,說明添加物能夠有效改善單抗糖基化分布。無X4條件(1LBR*)相比于15 L反應器其YF下降了6.9%,而YM提高了6.1%,該試驗結果與模型預測公式一致(表 4)。
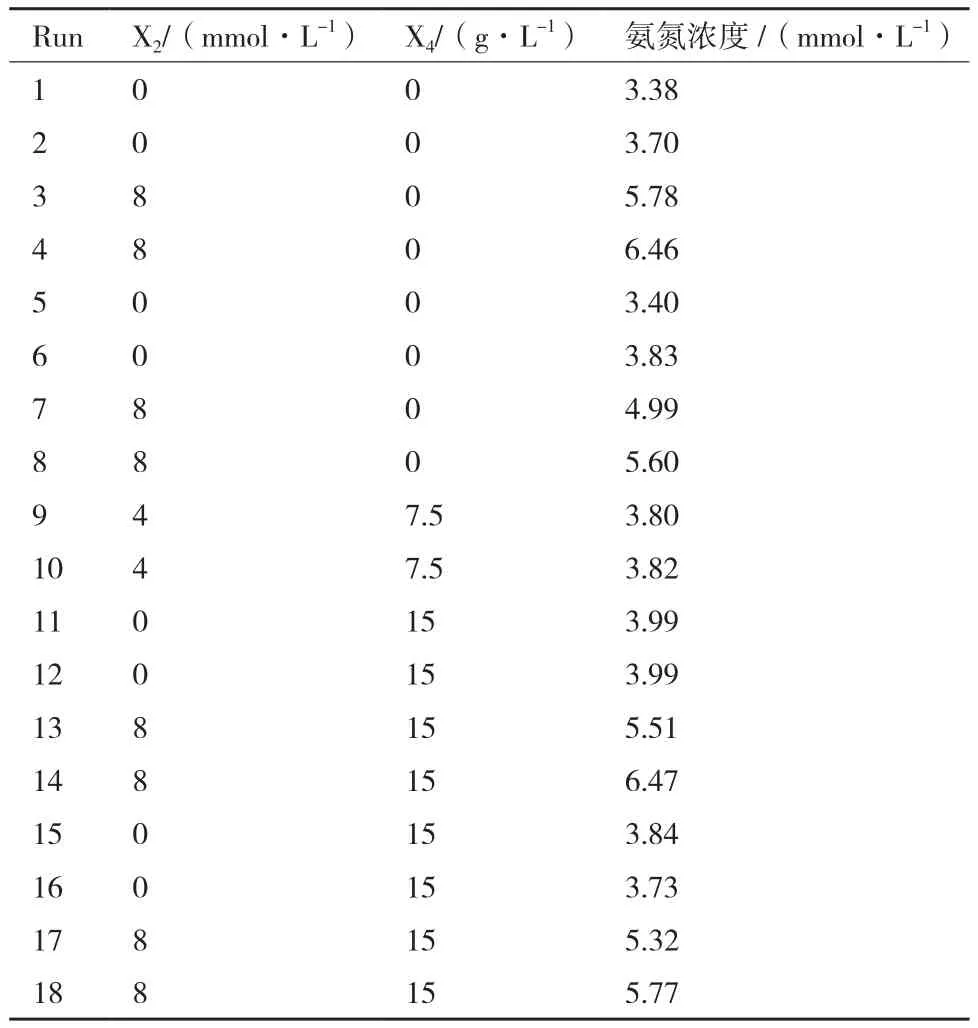
表3 尿苷對氨氮濃度的影響

圖2 細胞收獲液中氨氮濃度和YM水平的關系,所有實驗組(A)與僅考慮X2實驗組(B)
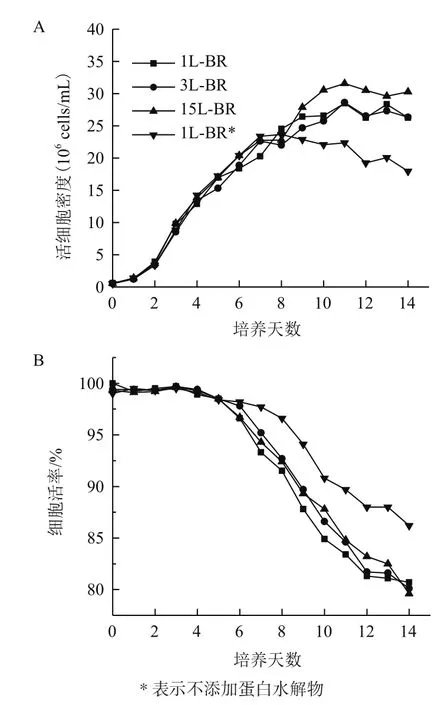
圖3 不同反應器規模中活細胞密度(A)和細胞活率(B)
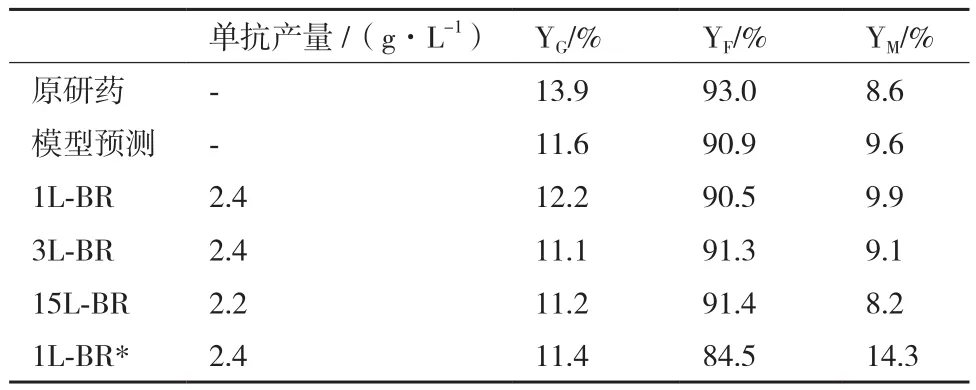
表4 反應器中單抗產量和糖基化分布
3 討論
生物類似藥相比新藥研發投資小,成功率高。歐洲藥品管理局在批準第一個生物類似藥-紅細胞生成素之后,陸續開始批準更多的生物類似藥[16]。面對競爭日益激烈的生物藥市場,如何快速獲得安全、有效的生物類似藥至關重要。而單抗糖基化修飾不僅影響單抗的結構、活性以及藥代動力學,更是單抗藥物重要的質量屬性,因此在細胞培養過程中需要嚴格控制。在本研究中,通過添加半乳糖、氯化錳和尿苷均能有效提高單抗半乳糖基化。但同時發現,較高濃度的半乳糖卻難以進一步提高單抗半乳糖基化,這與之前的報道一致。在Gamer等[13]的研究中,將半乳糖和氯化錳的濃度分別從40 mmol/L和0.016 mmol/L提高到100 mmol/L和0.04 mmol/L后,僅提高了2%半乳糖基化。另外較高濃度半乳糖會導致滲透壓升高,抑制細胞生長。不僅如此,St Amand等[12]發現,較高濃度的半乳糖和氯化錳還能影響蛋白產量,同時引起Man5增加。為了進一步提高單抗半乳糖基化的優化空間,可以選擇半乳糖的替代糖源,Hossler等[17]發現松三糖或乳糖可提高半乳糖基化并降低Man5。
本研究發現較高濃度的尿苷可導致Man5增加。加入尿苷的搖瓶最終氨氮濃度偏高,并且伴隨著Man5的增加,說明氨代謝與Man5存在內在聯系。該結果與Pacis[14]試驗結論一致。氨氮是尿苷最終分解代謝產物,濃度過高會加重氨代謝負擔,引起鳥氨酸積累從而導致Man5增加[15]。另外,氨氮對蛋白糖基化的影響因素還包括:(1)影響UDPGlcNAc轉運蛋白活性[18];(2)提高細胞內pH,影響高爾基體內糖基化酶的活性[19];(3)降低β-(1,4)半乳糖苷轉移酶的表達,在細胞培養中添加15 mmol/L氨氮濃度能降低40%半乳糖基化[20]。因此用尿苷進行糖基化調控,需要摸索最適作用濃度。
蛋白水解物是蛋白經過酶水解之后得到的多肽混合物,是一種常用的細胞培養添加劑[21]。本研究加入的蛋白水解物可促進細胞生長,且對單抗產量基本無影響,與之前Spearman[22]的研究結果一致,但該報道中蛋白水解物不影響蛋白糖基化。根據Ho等[23]的研究,蛋白水解物可提高半乳糖基化。而本研究所使用的蛋白水解物可提高巖藻糖基化并降低Man5。該現象可能與不同水解物的來源和生產工藝有關。通常認為,蛋白水解物能為細胞提供較好的氧化還原環境,使得細胞內各個細胞器能夠正常工作。例如,加入具有抗氧化作用的還原性谷胱甘肽能降低Man5[15]。由于蛋白水解物產品存在批次差異,會導致最終單抗藥物質量不穩定,所以大多數生物制藥企業對蛋白水解物的使用持謹慎態度。但越來越多的水解物生產商推出了成分明確的蛋白水解物產品,如BD Recharge,該類水解物批間差異小,適合商業化生產。后續研究應考察該類蛋白水解物對于糖基化修飾的影響。
4 結論
在重組CHO細胞培養過程中,通過加入半乳糖、尿苷和氯化錳能夠顯著提高半乳糖基化,其中尿苷過量會提高Man5。而添加蛋白水解物能降低單抗Man5并提高巖藻糖基化。本研究成功利用上述添加物將生物類似藥的糖基化水平調控至與原研藥相當。本研究所使用的添加物對單抗產量基本無影響,卻能極大地改善單抗糖基化分布,適用于已有的細胞培養工藝基礎上進行糖基化調整。

