豬瘟病毒熒光定量PCR的建立及對病毒體外復制動態的研究
王瑞寧 , 趙孟孟 , 李存法 , 李青梅 , 張雨杭 , 王 麗 , 李金磊 , 郭軍慶 , 張改平,
(1.河南牧業經濟學院動物醫藥學院 , 河南 鄭州 450046 ; 2.河南省農業科學院動物免疫學實驗室 , 河南 鄭州 450002 ;3.河南農業大學牧醫工程學院 , 河南 鄭州 450002 ; 4.河南省獸藥飼料監察所 , 河南 鄭州 450008)
豬瘟病毒(Classical swine fever virus, CSFV) 是豬瘟的病原,屬于黃病毒科(Flaviviridae)瘟病毒屬(Pestivirus)成員之一[1],該病屬于必須向世界動物衛生組織(OIE)報告的傳染病,中國農業農村部將其列為一類動物疫病[2],主要臨床特征是稽留高熱、出血、母豬流產等,是一種嚴重危害世界養豬業的高致死性、烈性傳染病[3]。
目前對豬瘟防控尚無特效藥物,雖然使用豬瘟弱毒疫苗能夠很好的控制住豬瘟的大流行,但時常會有免疫失敗的報道,其中一個重要原因就是疫苗效價不足問題。通過PK-15、ST細胞等增殖CSFV來生產豬瘟疫苗,CSFV在細胞中增殖效價的高低及最終疫苗生產的質量與對動物免疫效果密切相關[4]。兔體定型熱反應方法作為一種檢測豬瘟疫苗效價的傳統方法,但受家兔個體差異因素的影響,且操作繁瑣、耗時。半數細胞培養物感染量(TCID50)作為一種測定CSFV增殖滴度的方法較費時費力且受個人主觀判斷的影響[5],因此,亟需快速、準確測定CSFV增殖滴度動態的方法。
本研究擬建立一種快速、敏感、特異的檢測CSFV的SYBR GreenⅠ熒光定量PCR方法,分析CSFV在PK-15細胞上清中的增殖動態,同時測定上清中的TCID50,并進行比較,以便為研究快速檢測豬瘟疫苗效價及CSFV體外增殖規律等提供有效的理論依據。同時,通過該方法對CSFV在細胞上清中的增殖動態進行實時監測來達到優化接毒劑量、培養條件及CSFV最佳收獲時間的目的,且省時省力,為生產出優質的CSFV疫苗及CSFV增殖機制的研究提供技術支持。
1 材料與方法
1.1 病毒和細胞系 豬腎細胞(PK-15)、CSFV-Shimen(105.2TCID50/mL),牛病毒性腹瀉病毒(BVDV)和豬圓環病毒2型(PCV2),均由河南省農科院動物免疫學實驗室保存。
1.2 主要儀器與試劑 凝膠成像儀、熒光定量PCR儀、核酸蛋白檢測儀等分別購自Bio-Rad公司和ABI公司;感受態大腸桿菌DH5α、pMD-18T載體、SYBR Green-I Premix ExTaqTM熒光PCR試劑、RNA酶抑制劑、病毒RNA提取試劑盒、反轉錄試劑盒及DNA分子量Marker,均購自TaKaRa公司;DMEM培養基,胎牛血清,購自Hyclone公司;胰蛋白酶,購自Solarbio公司;瓊脂糖,購自Invitrogen公司;引物合成及核酸測序工作由TaKaRa公司完成。
1.3 引物設計 據GenBank公布的CSFV Shimen毒株NS5A基因序列,用Primer 5.0引物設計軟件設計引物,其序列如下:上游引物: P1:5′-GCAGAAGCCCACCTC-GAGAT -3′;下游引物: P2:5′-TACACCGGTTCCTCCACTCC-3′,預期擴增產物片段長度149 bp。
1.4 病毒RNA的提取及cDNA的合成 病毒 RNA提取參照試劑盒說明書進行,反轉錄 cDNA 的合成按照反轉錄酶 M-MLV 說明書進行,反轉錄后的cDNA置于﹣20 ℃保存備用。
1.5 標準品的制備 將CSFVNS5A片段與pMD18-T的連接產物加至DH5α感受態細胞,挑單個菌落純培養后提質粒,經PCR鑒定后進一步測序分析,用NanoDrop 2000測定陽性質粒質量濃度,然后代入此公式Y (拷貝/μL)= [DNA 濃度X (g/μL) /DNA 長度(bp)×660]×6.02×1023,計算濃度后即為標品。
1.6 熒光定量PCR反應的建立和優化 用TaKaRa PremixExTaq試劑結合構建的陽性重組質粒,初步優化引物濃度及退火溫度等反應條件。
1.7 標準曲線的建立 將標準品用滅菌三蒸水10倍倍比稀釋后作為模板,采用建立的熒光定量PCR方法進行標準曲線和熔解曲線的繪制。
1.8 熒光定量PCR檢測方法的評價
1.8.1 敏感性試驗 按照1.6確定的反應體系,將10倍梯度稀釋的標準品為模板,進行熒光定量PCR反應,該反應檢出的最低模板濃度即為該方法的靈敏度。
1.8.2 特異性試驗 在相同的條件下,對PCV2、BVDV提取核酸,同時設陰性對照為正常PK-15細胞混懸液,陽性對照為CSFV質粒標準品。上述樣品按照1.6確定的反應體系進行熒光定量PCR 檢測,確定該方法的特異性。
1.8.3 重復性試驗 批間重復性試驗:用所建立的方法對60 h、48 h、36 h三個不同時間點收集的CSFV細胞上清進行3次重復測定,采用同樣的熒光定量PCR反應條件進行3次獨立的試驗,每次試驗間隔3 d;批內重復性試驗:對60 h、48 h、36 h三個不同時間點收集的CSFV細胞上清,在同一試驗中的同一反應板上,采用同一反應條件對每個樣品進行3次熒光定量PCR檢測。
1.9 熒光定量PCR和TCID50體外增殖滴度測定比較
1.9.1 PK-15細胞培養及增殖CSFV 將PK-15細胞按照常規細胞培養方法培養成單層后,棄細胞生長液,按培養液體積的10% 接種CSFV Shimen(105.2TCID50/mL),置37 ℃ CO2培養箱吸附90 min 后,補加5 mL 2%維持液后繼續培養增殖病毒。
1.9.2 病毒液收集 按1.9.1陳述的方法用CSFV感染PK-15細胞,分別在感染后12 h、24 h、36 h、48 h、60 h、72 h、84 h、96 h收集病毒上清,12 000 r /min 離心5 min后用于病毒核酸提取。
1.9.3 病毒滴度的測定 對1.9.2不同時間收集的病毒上清液同時進行TCID50測定,根據3次重復的結果,計算平均值,并根據平均值繪制病毒的體外增殖曲線。
2 結果
2.1 標準品的制備 采用紫外分光光度計測定鑒定正確的陽性質粒(圖1)核酸濃度,將DNA 拷貝數經公式換算為1×1010拷貝/μL,并進行10倍倍比稀釋,將1×108拷貝/μL~1×101拷貝/μL的陽性質粒作為標準品。
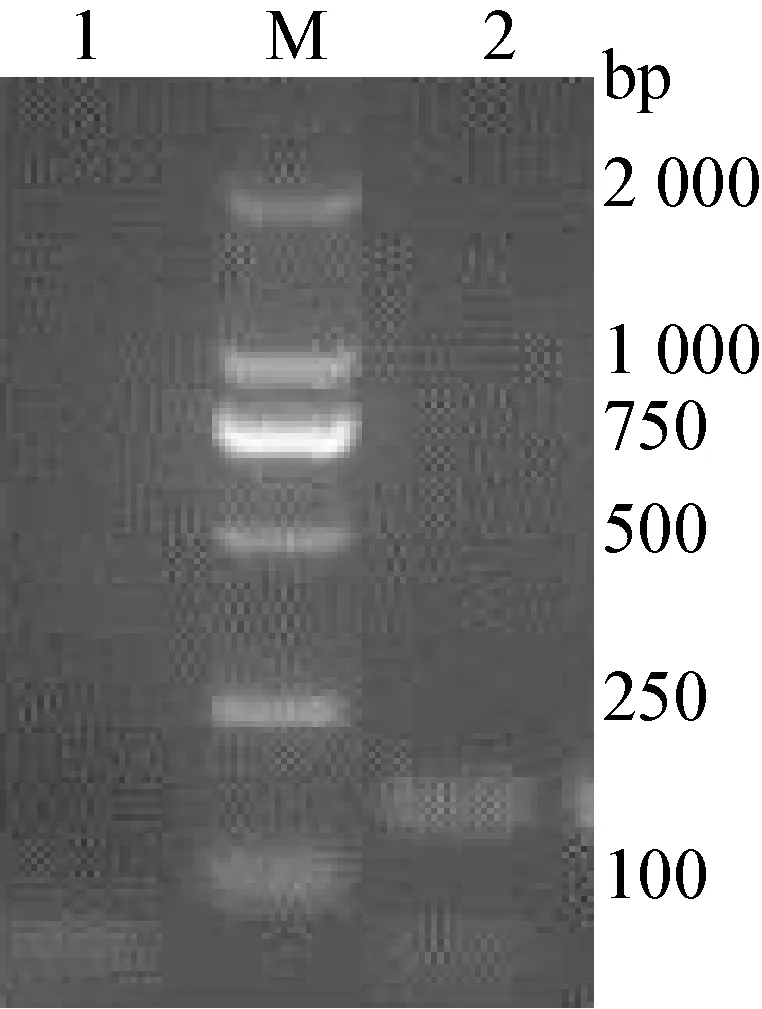
圖1 陽性質粒鑒定結果
M:DL-2 000 DNA Marker ; 1:NS5A陽性質粒 ; 2:陰性對照
2.2 熒光定量PCR反應條件的建立及優化 經相關試驗優化后,確定最佳反應體系為20 μL: 模板1.0 μL,上下游引物(10 μM)各0.5 μL,SYBR Premix ExTaq10 μL,補充滅菌三蒸水至20 μL。反應程序為:94 ℃,4 min;94 ℃,30 s;60 ℃,30 s;72 ℃,30 s,40個循環,最后制作熔解曲線。
2.3 標準曲線的建立 熒光定量PCR反應結束后,生成標準曲線如圖2所示,熔解曲線如圖3所示,其中標準曲線的斜率是3.173,截距是34.377,縱坐標y軸為獲得的Ct值,橫坐標x軸為對應的標準品拷貝數的對數。由圖2可以看出,在較廣的范圍內(1.0×101~1.0×108拷貝/μL)有很好的線性關系,相關系數R2=0.999 9。熔解曲線分析結果表明,在80.0 ℃有一個擬合度非常好的單一峰,表明此引物是特異的,沒有引物二聚體或非特異性擴增的出現(見封二彩版圖3)。
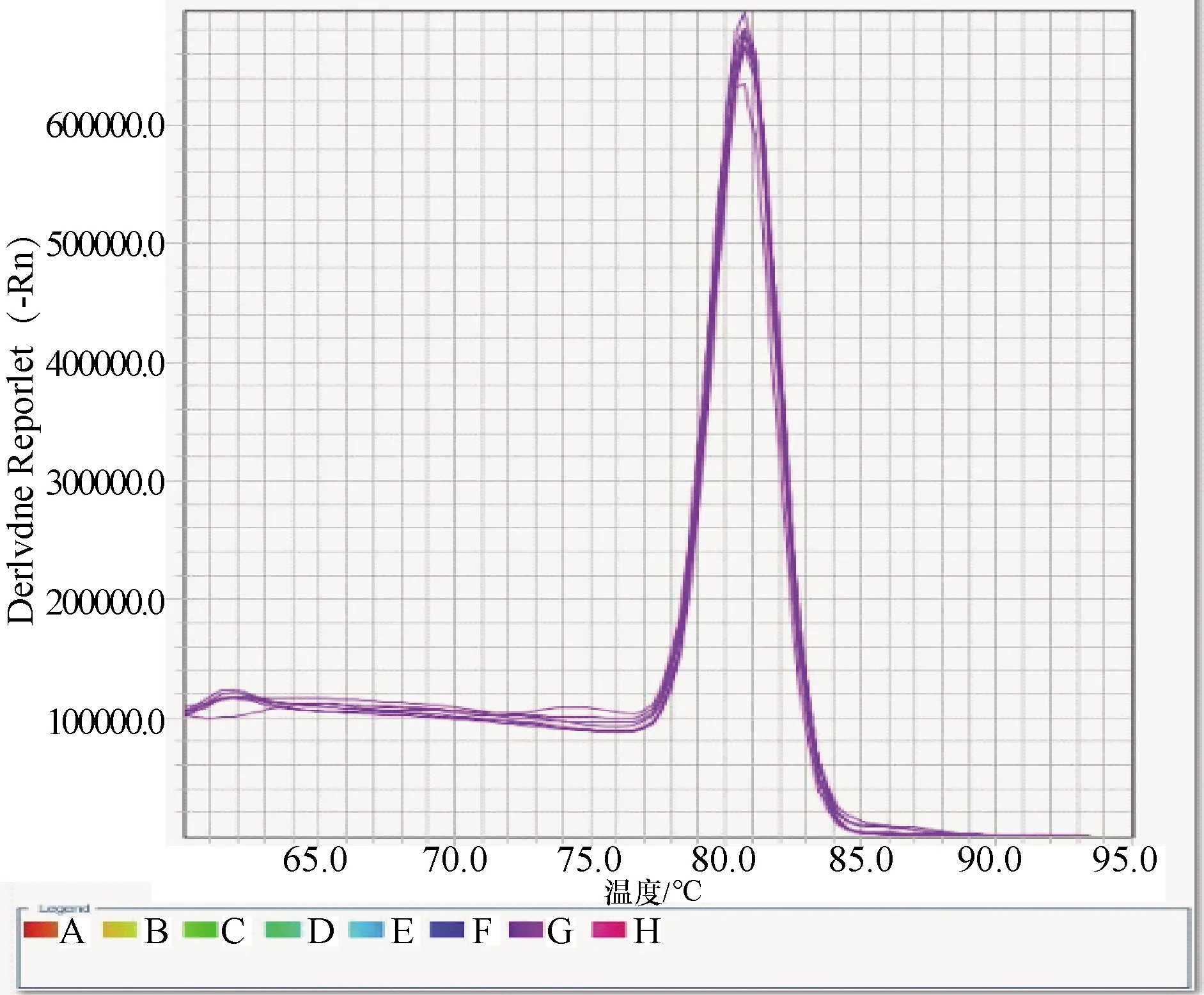
圖3 熒光定量Real-time PCR熔解曲線
2.4 敏感性試驗 以10倍系列稀釋的標準品
圖2 熒光定量Real-time PCR標準曲線
(1×101~107拷貝/μL)為模板,進行熒光定量PCR擴增,結果表明,101拷貝/μL的cDNA仍能得到特異性擴增,在101~107拷貝/μL線性范圍內有良好的擴增曲線(圖4)(101拷貝/μL檢測到的信號Ct值為30.91)。
圖4 熒光定量Real-time PCR的敏感性
2.5 特異性試驗 從封二彩版圖5可以看出,只有CSFV陽性標準品有明顯的特異性擴增曲線,BVDV和PCV2和陰性對照檢測結果均為陰性,結果表明,本文建立的方法具有較好的特異性。
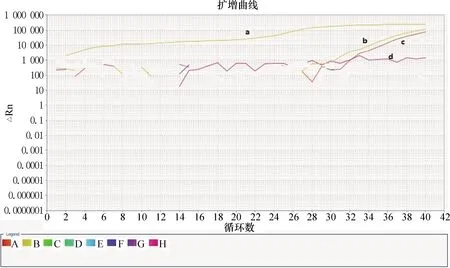
圖5 熒光定量Real-time PCR的特異性
2.6 重復性試驗 對3個樣品批內和批間重復性試驗的結果進行統計學分析,見表1和2。從表1可以看出,3個樣品的批內重復的變異系數分別為0.90%,0.54%,0.70%,均小于1%;由表2可見,批間重復的變異系數分別為1.81%,1.1%,1.20%,均小于 2%;批內、批間重復性試驗變異系數均小于2%。
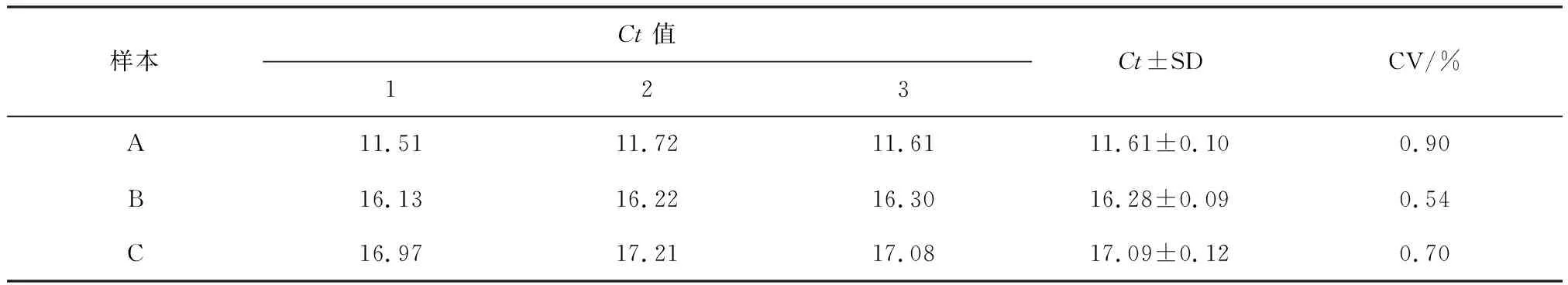
表1 熒光定量 PCR 批內重復性

表2 熒光定量 PCR 批間重復性
2.7 熒光定量PCR和TCID50對CSFV細胞上清增殖滴度測定結果的相關性分析 取不同時間接毒后樣品,對其分別進行熒光定量PCR和TCID50測定,并根據測定結果繪制曲線,見圖6和7。由圖6可以看出,8個不同時間點收集的CSFV細胞上清液中的病毒含量從接毒后12 h到60 h隨著培養時間的延長病毒拷貝數幾乎呈指數增長,并在60 h(103.7TCID50/mL)時病毒拷貝數達到高峰,隨后呈下降趨勢;病毒滴度的變化從接毒后12 h(101.5TCID50/mL)開始到48 h隨著培養時間的延長而增加,并在48 h(104.2TCID50/mL)時達到高峰,隨后逐漸開始下降,綜合圖6和7可以看出,雖然病毒滴度的測定結果與熒光定量RT-PCR結果在峰值上出現差異,但總體趨勢是一致的,都是先上升后下降。
圖6 CSFV石門毒株在PK-15細胞上清中的增殖曲線
圖7 CSFV石門毒株在PK-15細胞上清中TCID50的變化
3 討論
目前,弱毒疫苗免疫仍是控制豬瘟、減少經濟損失的有效措施。CSFV細胞弱毒苗的病毒效價與疫苗的質量密切相關,因此,在疫苗生產過程中,最佳的病毒收獲時間的確定是至關重要的,因此,掌握CSFV的增殖規律和收獲時間是生產優質疫苗的前提。實時熒光定量PCR技術具有高敏感性、高特異性及操作簡單等優點,廣泛應用于病原體檢測、基因表達研究和轉基因產品檢測等諸多領域[6-8]。本研究建立檢測豬瘟病毒的SYBR GreenⅠ熒光定量PCR方法,在1×108~1×101拷貝/μL范圍內具有良好的線性關系,其敏感性達到101拷貝/μL,與王淑娟等[9]建立的方法(最低檢出量為10拷貝/μL)結果一致。重復性較好,批間、批內變異系數均小于2%,且不與其他病毒發生交叉反應。此外該方法比常規方法相比,因其不需要電泳等對產物進行后期處理,節省了一半的時間,其敏感性比常規的RT-PCR高約100倍[10]。
熒光定量PCR技術應用于CSFV 檢測,國內外已有報道。范斌等[11]從5′非編碼區設計引物對豬瘟兔化弱毒疫苗病毒含量進行了檢測,陳鍇等[12]從基因組3′非編碼區設計引物建立了熒光定量PCR對豬瘟兔化弱毒疫苗效價進行檢驗,結果表明,熒光定量PCR與家兔熱反應測定結果存在良好的相關性,可以用于豬瘟疫苗半成品中HCLV定量檢測。牛金鵬等[13]從5′非編碼區設計引物建立了SYBR熒光定量PCR方法分析豬瘟石門強毒在急性感染期死亡豬體內的分布情況。本研究對CSFV石門毒株體外復制動態的研究首次采用SYBR GreenⅠ熒光定量PCR方法,對不同接毒時間的PK-15細胞上清進行檢測,根據測得的拷貝數,繪制CSFV在PK-15細胞上的生長曲線,并與采用TCID50方法測得的數據繪制的動態曲線進行比較。為了保證數據的準確性,每個時間點取3個重復樣本,同時又進行了3次獨立的重復試驗,取最終的平均值繪制細胞上清中CSFV增殖動態曲線。熒光定量PCR方法與TCID50檢測結果基本一致,熒光定量PCR方法測定的峰值與TCID50方法的峰值相比,推后了12 h,可能是由于TCID50方法測定的是活病毒粒子效價,而熒光定量PCR方法不同于TCID50方法,其檢測的是病毒核酸的含量,其中即含有感染性的活病毒核酸、有抗原性和免疫原性但無感染性的失活病毒核酸以及尚未完成病毒粒子裝配的核酸。本研究建立的熒光定量PCR檢測方法具有很實用的應用價值,雖然失去了感染能力,但其具有抗原性和免疫原性,可作為有效抗原成分存在于疫苗中。應用兩種方法測得的CSFV的增殖曲線有一定的平行關系,但由于熒光定量PCR方法比TCID50方法更快速、敏感,更適用于生產過程中對CSFV增殖滴度的實時快速測定。徐興然等[14]采用間接免疫熒光染色檢測病毒抗原、Real-time PCR檢測病毒基因組RNA的增殖水平及病毒感染TCID50測定技術研究了CSFV在細胞上的增殖特點,本研究的結果與其結果一致,均呈現先上升后下降的趨勢。王遵寶等[15]用間接免疫熒光染色檢測病毒抗原、Real-time PCR及兔體定型熱法對豬瘟兔化弱毒(ST細胞毒)進行了檢測,結果表明,可用Real-time PCR法替代傳統的兔體反應熱法進行豬瘟活疫苗檢測。
依據熒光定量PCR方法測定的CSFV增殖動態,精確分析CSFV在細胞上清中的增殖動力學規律,可以確定在PK-15細胞上最佳收毒時間,也為CSFV在PK-15細胞中的增殖動態提供了基礎數據,同時為保質保量的豬瘟疫苗的生產提供了一定的科學依據。該檢測方法靈敏、特異、快速的檢測優點,為生產過程中的大規模增殖CSFV時實時監控病毒滴度等提供了一種有效手段,同時也為CSFV感染機制的研究、抗CSFV藥物的研制等提供了一定的幫助。

