板栗過氧化氫酶基因CmCAT的克隆與原核表達
劉裕峰,朱天輝,劉應高,譙天敏,李姝江,龍旭梅,韓 珊
(四川農業大學林學院,成都 611130)
首次發現動植物組織能夠分解過氧化氫產生氧氣可追溯到1811年,后被發現可能是某種酶起作用,直到1901年,該酶被命名為過氧化氫酶(hudrogen peroxidase),又名觸酶(catalase,CAT)[1]。現已發現在動物、植物及微生物體內均含有大量的CAT。病原菌的入侵會打破超氧陰離子(O2-)、過氧化氫(H2O2)和羥自由基(·OH)等活性氧類(reactive oxygen species,ROS)物質的動態平衡,導致活性氧物質在植物體內大量積累,長時間的積累而得不到有效的清除,會損傷植物細胞膜系統,破壞蛋白質功能,嚴重時導致植株死亡[2]。CAT 作為植物體內主要的抗氧化酶之一,它能夠催化植物光呼吸、線粒體電子傳遞及脂肪酸氧化等過程中產生的H2O2生成O2和H2O[3]。有報道稱[4],一分子CAT 每分鐘能將大約6×106個H2O2分子轉化成H2O 和O2。因此,CAT 對H2O2的清除具有較高的特異性,并且在去除H2O2過量中起關鍵作用[5],使得植物不受傷害。
大量研究表明,CAT 與植物的抗病性存在著緊密的聯系。Pei Z.M.等[6]研究發現,缺失CAT 基因的煙草體內H2O2含量增加,導致細胞死亡;Jiang M.等[7]發現,植物的CAT 活性能夠被水楊酸抗病因子抑制,導致過多的ROS 產生,進而引起植物系統性的防御反應;病原菌浸染植物的初期階段,CAT 催化H2O2生成O2,觸發苯甲酸生成水楊酸,導致系統性防衛反應的發生[8];轉玉米CAT2 基因的煙草遭受病原菌侵染后,誘發嚴重的超敏反應,進而有效地控制細菌的進一步感染[9];轉基因煙草植株體內酵母CAT1 基因的過量表達,能夠提高轉基因植株的抗病毒侵染能力[10]。
植物CAT 基因家族由多個基因編碼,其表達受病原、溫度、光照、干旱等多種因子的調控[11]。目前,已從火龍果[12]、人參[13]、甘薯[14]、南瓜[15]、水稻[16]、壇紫菜[17]等多種植物中克隆獲得CAT 基因并進行相關分析。但目前關于板栗CAT 基因的相關研究較少,異源表達方面的研究尚屬空白。本研究在板栗轉錄組學研究[18]的基礎上,利用RT-PCR 技術克隆獲得板栗CAT 基因全長cDNA 序列,并進行了相關生物信息學分析,同時構建pET28a-CmCAT 原核表達載體,在大腸桿菌中進行了融合表達,旨在了解其基因結構和功能,為進一步研究板栗抗病的分子機理奠定基礎。
1 材料和方法
1.1 試驗材料
供試板栗品種為“石豐”,種植于四川農業大學林學院崇州基地;植物RNA 提取試劑盒購自北京華越洋生物科技有限公司;PCR 反轉錄試劑盒、pMD19-T 載體購自大連TaKaRa 公司;DNA 純化回收試劑盒、質粒提取試劑盒購自天根生化科技(北京)有限公司;表達載體pET-28a 由四川農業大學林學院林木病理學實驗室提供;大腸桿菌DH5α、BL21(DE3)購自北京全式金生物技術有限公司;限制性內切酶EcoRI、XhoI、T4DNA 連接酶購自NEB(北京)有限公司;其他試劑為進口或國產分析純。
1.2 總RNA 的提取與cDNA 的合成
以板栗幼葉作為RNA 提取材料,使用植物多糖多酚RNA 提取試劑盒(北京華越洋生物)提取總RNA。提取的總RNA 經BioMate 3S(BioMate 3S,Thermo Scientific)及1%的瓊脂糖凝膠電泳檢測其濃度和完整性。cDNA 第一鏈的合成使用PrimeScriptTMⅡ1st Strand cDNA Synthesis Kit 試劑盒(TaKaRa,大連),具體操作步驟參照說明書進行。合成的cDNA保存于-80 ℃,用于后續試驗。
1.3 CmCAT 基因的克隆
根據NCBI 數據庫中已公布的其他植物CAT基因核苷酸序列,將其與板栗基因組數據庫(http://www.hardwoodgenomics.org/)進行同源比對,尋找并分析板栗CAT 基因EST 序列,使用Primer Premier 5.0 軟件設計一對特異性引物CmCAT-F:5'-ATG GATCCCTACAAGTACCG-3',CmCAT-R:5'- TCA CATTGTTGGCCTCAC-3'。以反轉錄的板栗cDNA為模板,進行PCR 擴增,反應條件為:94 ℃預變性3 min;94 ℃變性30 s,55 ℃復性30 s,72 ℃延伸2 min,35 個循環;72 ℃終延伸7 min。PCR 產物經1%瓊脂糖凝膠電泳檢測后進行純化回收,回收片段連接pMD19-T 載體并轉化E.coli DH5α,于氨芐青霉素(ampicillin,Amp)培養基上進行藍白斑篩選,挑取白色單克隆菌落進行PCR 鑒定,將菌落PCR 檢測的陽性克隆送上海英駿生物技術有限公司測序鑒定。
1.4 CmCAT 基因序列的生物信息學分析
通過軟件DNAMAN6.0 查找序列的ORF,并將其翻譯為氨基酸序列;通過在線NCBI(http://blast.ncbi.nlm.nih.gov/)的Blast 進行核苷酸序列和氨基酸序列相似性分析;應用ClustalX1.81 和ESPript3.0軟件對其編碼蛋白進行多重對比分析;運用在線蛋白分析工具ProtParam(http://web.expasy.org/protparam/)和ProtScale(http://web.expasy.org/protscale/)對其編碼蛋白的理化性質進行預測分析;利用工具ScanProsite(http://prosite.expasy.org/scanprosite)對其編碼蛋白的功能位點及功能域進行預測分析;利用軟件MEGA6.05 進行系統進化樹分析。
1.5 原核表達載體的構建及鑒定
根據前期克隆獲得的CmCAT 基因CDS 序列,設計一對含酶切位點的引物CmCAT-EcoRI-F:5'-CGGAATTCATGGATCCCTACAAGTACCG-3'(下劃線為EcoRI 酶切位點),CmCAT-XhoI-R:5'-CCGC TCGAGTCACATTGTTGGCCTCAC-3'(下劃線為XhoI酶切位點)。以pMD19-T-CmCAT 質粒為模板,進行PCR 擴增,擴增條件同1.3。PCR 產物經1%瓊脂糖凝膠電泳檢測后,進行純化回收。回收產物與pET-28a 載體質粒均進行EcoRI 和XhoI 雙酶切,酶切產物純化回收后,使用T4 DNA 連接酶16 ℃連接12 h。連接產物轉入大腸桿菌BL21(DE3),于卡那霉素(kanamycin,Kan)培養基上進行抗性篩選,挑取單個菌落于LB 液體培養基擴增培養后進行PCR鑒定,提取鑒定正確的菌液質粒,對質粒進行EcoRI和XhoI 雙酶切鑒定后送上海英駿生物技術有限公司測序鑒定。
1.6 重組質粒的誘導表達及SDS-PAGE 檢測
將測序正確的重組質粒轉化表達宿主菌BL21(DE3)。挑取含有pET28a-CmCAT 重組質粒的BL21(DE3)單菌落,接種于含有Kan(50 μg/mL)LB液體培養基中,37 ℃(200 r/min)過夜振蕩培養。次日按1∶100 的接種量進行擴增培養,當菌液OD600值約為0.6~0.8 時,分別進行不同條件的誘導。首先利用不同濃度IPTG(終濃度為0.2、0.4、0.6、0.8、1.0 mmol/L)誘導3 h,收取1 mL 菌液進行SDS-PAGE檢測;以上述最優IPTG 濃度進行誘導時間(1、2、3、4、5、6 h)的優化。
最后以最優IPTG 濃度和最優誘導時間進行不同溫度(25 ℃、30 ℃、37 ℃)的誘導優化并進行誘導蛋白的可溶性分析。收集1 mL 菌液于1.5 mL 離心管中,12 000 r/min 離心10 min,取沉淀,加入100 μL PBS(pH7.4)懸浮菌體,12 000 r/min 離心1 min,收集菌體,再次加入60 μL PBS(pH 值7.4)懸浮菌體后,4 ℃超生破碎,12 000 r/min 離心10 min。收集超聲破碎后的上清液和沉淀(加入60 μL 8 mol/L尿素重懸,4 ℃螯合30 min)。分別加入4×蛋白上樣緩沖液20 μL 混勻,煮沸10 min,冰上冷卻后,12 000 r/min 離心10 min,取10 μL 上清進行SDSPAGE(5%濃縮膠,12%分離膠)電泳檢測。所有的SDS-PAGE 電泳檢測均以pET28a-BL21(DE3)以及未誘導的pET28a-CmCAT-BL21(DE3)作為對照。
2 結果與分析
2.1 板栗CmCAT 基因全長cDNA 的擴增與克隆
使用CmCAT-F 和CmCAT-R 特異性引物,對CmCAT 基因完整閱讀框(ORF)進行RT-PCR 擴增,擴增產物經1%瓊脂糖凝膠電泳檢測,發現一條約為1 500 bp 的單一條帶,通過pMD19-T 克隆測序,發現獲得了長度為1 479 bp 的CmCAT 基因片段(見圖1)。

圖1 CmCAT 基因PCR 擴增電泳圖Figure 1 The electrophoresis of PCR product of CmCAT gene
2.2 板栗CmCAT 基因的核苷酸序列分析
板栗CmCAT 基因全長cDNA 序列為1 479 bp,通過ORF Finder 在線軟件進行分析,發現該序列為一個完整的閱讀框,無5'非編碼區和3'非編碼區,編碼492 個氨基酸(見圖2),將該基因cDNA 序列提交NCBI 數據庫,注冊登錄號:KY312851。CmCAT基因核苷酸序列在GenBank 中進行序列相似性對比,結果顯示該序列與核桃(Juglans regia,XM_01 8980866.1)CAT 基因序列一致性最高,為85%,與毛果楊(Populus trichocarpa,XM_002301884.1)、茶(Camellia sinensis、KR819178.1)、蘿卜(Raphanus sativus,AF031318.2)等多種植物CAT 基因序列一致性均在77%以上。表明克隆獲得的CmCAT 基因屬于板栗過氧化氫酶基因家族成員之一。
2.3 板栗CmCAT 蛋白的氨基酸序列分析

圖2 CmCAT 基因cDNA 序列及其所推導的氨基酸序列Figure 2 cDNA sequence of CmCAT gene and its deduced amino acid sequence
利用ExPASy ProtParam tool 對CmCAT 蛋白質序列進行相關信息分析,預測CmCAT 蛋白分子質量為56.883 kDa;理論pI 為5.83;在組成CmCAT 蛋白的所有氨基酸中,精氨酸(Arg)為使用頻率最高的氨基酸,占總氨基酸量的8.1%,半胱氨酸(Cys)為使用頻率最低的氨基酸,占總氨基酸量的1.0%;其含有61個負電性氨基酸殘基(Asp + Glu),59 個正電性氨基酸殘基(Arg + Lys),分子式為C2550H3865N719O736S16;預測不穩定指數為36.20,屬于穩定性蛋白;脂肪族氨基酸指數69.15;總平均疏水指數-0.586,屬于親水性蛋白。使用ClustalX1.81 與ESPript3.0 軟件并結合BlastP 對CmCAT 蛋白序列進行多序列相似性分析,結果顯示(見圖3),CmCAT 蛋白序列與蔓花生(Arachis duranensis,XP_015934030.1)等多種植物CAT 蛋白序列同源性達到82%以上。通過Blastp 和ScanProsite 工具對CmCAT 蛋白功能域進行分析,均發現其含有catalase 保守結構域,位于序列第14-492 位氨基酸之間。可見,CmCAT 屬于CAT 蛋白家族成員之一。通過在線工具Motif 發現,CmCAT 蛋白還具有2 個重要的功能位點,分別是過氧化氫酶近端活性位點(catalase proximal active site signature),位于第54-70 位氨基酸之間,序列為FERERIPERVVHARGAS;過氧化物酶近血紅素位點(catalase proximal heme-ligand signature),位于第344-352 位氨基酸之間,序列為RIFAYGDTQ(見圖2)。進一步說明CAT 蛋白在進化過程中是較為保守的,CmCAT 蛋白與其他植物的CAT 蛋白結構和功能是較為相似的。
2.4 板栗CmCAT 蛋白的進化分析
為了解不同植物CAT 間的進化關系,從NCBI數據庫下載了23 個物種CAT 氨基酸序列,利用MEGA6.05 軟件,采用鄰接法,重復檢測1 000 次,構建其與CmCAT 氨基酸序列之間的進化關系(見圖4)。系統進化樹分析結果表明,24 個物種CAT 聚集為兩大類群,草本植物CAT 聚為一簇,木本植物CAT 聚為一簇,符合植物的生物進化規律。板栗CmCAT 與核桃JrCAT 同為一個分支,親緣關系最近,推測它們可能由同一個祖先進化而來。其次,與薔薇科(Rosaceae)植物親緣關系較近,而板栗CmCAT 與葫蘆科(Cucurbitaceae)甜瓜、黃瓜、絲瓜等植物親緣關系較遠。

圖3 CmCAT 與其他植物CAT 蛋白質序列多重對比Figure 3 Sequence multialignment of the deduced CmCAT protein with other plant CAT proteins

圖4 Neighbor-joining(NJ)方法構建CmCAT 蛋白與其他植物CAT 蛋白的系統進化樹Figure 4 Neighbor-joining (NJ) method to build CmCAT protein and other plant CAT protein phylogenetic tree
2.5 重組表達載體的構建
以pMD19-T-CmCAT 質粒為模板,使用CmCAT-EcoRI-F/CmCAT-XhoI-R 引物擴增獲得帶酶切位點的CmCAT 基因片段,將PCR 產物純化回收后與pET-28a 載體分別進行EcoRI/XhoI 雙酶切,分別回收目的片段與載體酶切產物并進行連接轉化,挑取單菌落進行PCR 鑒定(見圖5),條帶與預期大小一致;提取PCR 鑒定正確的陽性菌液質粒,進行雙酶切驗證(見圖6),獲得預期大小的酶切片段。將驗證正確的陽性重組質粒送上海英駿生物技術有限公司測序鑒定,測序結果比對發現,CmCAT 基因片段與pET-28a 載體成功連接,表明pET28a-CmCAT 重組表達載體構建成功。
2.6 板栗CmCAT 蛋白的原核表達
挑取pET28a-CmCAT-BL21(DE3)單菌落過夜培養作為母液。在37 ℃下進行不同IPTG 濃度誘導表達6 h,以未誘導的pET28a-CmCAT-BL21(DE3)、pET28a-BL21(DE3)以及誘導的pET28a-BL21(DE3)(IPTG 終濃度為0.6 mmol/L,誘導3 h)空載體作為對照。結果表明,對照組無目的蛋白表達,實驗組在各IPTG 濃度下均能誘導大量表達,組間表達量并無多大差異,分子量約為60 kDa,與預期大小一致(見圖7)。因此,以終濃度0.2 mmol/L 作為IPTG 最優誘導濃度。

圖5 pET28a-CmCAT-DH5α PCR 檢測Figure 5 PCR detection of pET28a-CmCAT-DH5α

圖6 pET28a-CmCAT 雙酶切鑒定Figure 6 Double enzyme identification of pET28a-CmCAT
使用上述最優表達條件(37 ℃、0.2 mmol/L IPTG),對pET28a-CmCAT-BL21(DE3)最優表達時間進行進一步優化。將OD600 值為0.6~0.8 區間的pET28a-CmCAT-BL21(DE3)菌液在37 ℃、0.2 mmol/L IPTG 下進行不同時間的誘導(分別為誘導1、2、3、4、5、6 h)。從圖8中可以看出,隨著誘導時間的增加,目的蛋白的量也在逐漸增加,誘導6 h 獲得的目的蛋白量最大。而對照中載體與pET28a-CmCATBL21(DE3)未誘導均未有目的蛋白出現。因此,以誘導6 h 作為pET28a-CmCAT-BL21(DE3)在37 ℃、0.2 mmol/L IPTG 下最優誘導時間長度。
最后對pET28a-CmCAT-BL21(DE3)進行不同溫度(25 ℃、30 ℃、37 ℃)誘導,同時檢測表達的目的蛋白的可溶性。SDS-PAGE 蛋白電泳分析顯示,3個溫度下均有大量目的蛋白出現,且對照無此條帶(見圖9),在30 ℃下誘導獲得的目的蛋白最為豐富。在上清中無明顯目的蛋白出現,其主要以包涵體的形式存在。

圖7 pET28a-CmCAT-BL21(DE3)誘導濃度優化Figure 7 Concentration optimization of pET28a-CmCATBL21(DE3) IPTG induction

圖8 pET28a-CmCAT-BL21(DE3)誘導時間優化Figure 8 Induction time optimization of pET28a-CmCATBL21(DE3)
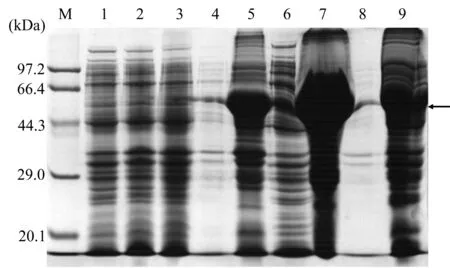
圖9 pET28a-CmCAT-BL21(DE3)誘導溫度優化及可溶性檢測Figure 9 Optimization of the induction temperature of pET28a-CmCAT-BL21(DE3)and its solubility detection
3 討論與結論
植物中復合抗氧化防御體系主要由抗氧化酶組成。其中,CAT 是第一個被發現和描述的[12]。植物遭受病原微生物侵染后會產生大量的H2O2[19],而H2O2的積累會對植物組織、細胞產生巨大的傷害。CAT 對H2O2具有較高的親和性[20],能有效清除過多的H2O2,在防御逆境脅迫和維持植物細胞氧化還原平衡方面具有重要的意義[21]。通過RT-PCR 方法,成功克隆出板栗CmCAT 基因,該基因全長1 479 bp,為一個完整的ORF,編碼492 個氨基酸。Blast 分析表明,CmCAT 基因核苷酸序列及氨基酸序列與其他植物的CAT 基因核苷酸序列及氨基酸序列同源性分別在77%和82%以上,顯示其較高的保守性。Motif Scan 分析顯示,CmCAT 蛋白序列具有CAT 蛋白家族的catalase 結構域,同時還具有該蛋白家族2個保守的功能位點:過氧化氫酶近端活性位點和過氧化物酶近血紅素位點。分析板栗CmCAT 蛋白序列與其他23 個物種CAT 蛋白序列之間的進化關系,發現草本植物和木本植物分為兩個大的分支,其中板栗與核桃的親緣關系最近,與葫蘆科草本植物親緣關系最遠。
利用基因工程技術成功獲得pET28a-CmCAT重組載體,并轉入大腸桿菌BL21(DE3)中,IPTG 誘導后獲得分子量約為60 kDa 的目的條帶,比預測的CmCAT 蛋白分子量(56.883 kDa)略大,pET28a 載體自帶的His-tag 標簽序列是造成這種偏差的主要原因之一[22],同時,誘導獲得的目的蛋白與大豆GmCAT 基因在大腸桿菌中表達的融合蛋白分子量大小(60 kDa)一致[23]。隨后從IPTG 濃度、誘導時間及誘導溫度方面進行最優誘導條件的篩選,以期獲得更大量的目的蛋白。通過SDS-PAGE 電泳分析發現,30 ℃,0.2 mmol/L IPTG 誘導表達菌株6 h 獲得的目的蛋白量最大,但主要以包涵體的形式存在,且在誘導溫度降低的條件下(25℃)仍為包涵體。大腸桿菌已經成功地用于表達來自細菌和低等真核生物的活性重組CAT[24]。然而,利用大腸桿菌系統尚未得到可溶性植物CAT 重組蛋白[25]。陳金峰等[23]將大豆3 個CAT 基因連接pET28a 載體后,轉入大腸桿菌進行融合表達,獲得的融合蛋白也均為包涵體。彭丹等[26]發現,鹽穗木CAT 基因在BL21(DE3)中,通過低溫誘導能獲得可溶性的目的蛋白,但表達量較低。其所用的表達載體為pET32a,可能對植物CAT 基因在大腸桿菌中的可溶性表達具有一定的促進作用。N.Engel 等[25]發現,昆蟲細胞系能夠作為獲得植物來源的活性重組CAT 的替代方法。作為真核生物,昆蟲細胞系在遺傳上更相容,可以提供足夠的蛋白質折疊機器(分子伴侶)的支持,以及足夠的血紅素代謝池,并入新合成的重組血紅素蛋白。
本研究成功從板栗中克隆了一個CAT 基因,通過多種生物信息學軟件分析了CmCAT 基因的同源性、蛋白結構以及分子進化等相關信息,初步分析了CmCAT 基因在不同條件下的原核表達情況,為深入研究CmCAT 基因的功能和揭示板栗抗病過程中的分子機制奠定了基礎。

