左室擴大對中-重度缺血性二尖瓣關閉不全患者同期行CABG+MVP術的影響
舒悅,何書武,王天光,陳澤倫,郭義龍
(海南醫學院第二附屬醫院,海口570102)
缺血性二尖瓣關閉不全(IMR)是冠心病心肌梗死后常見的并發癥之一,其發生率為10~20%[1,2]。既往研究表明,對于輕度IMR患者,僅需行單純的冠狀動脈旁路移植術(CABG),隨著術后心肌缺血的改善及心功能的逐漸恢復,二尖瓣功能可得到一定程度的改善;對于重度IMR患者,大多建議同期進行CABG術+二尖瓣成形術(MVP)或瓣膜置換術(MVR)[3];而針對中-重度IMR尤其是合并有左室擴大的患者,是否在行CBAG術時對二尖瓣進行相應的外科處理仍存在爭議[4,5]。本文回顧性分析2009年6月~2017年6月在我院接受CABG+MVP治療的54例伴左室擴大的中-重度IMR患者的臨床資料,分析左室擴大對患者同期行CABG+MVP術的影響,為該類患者的外科治療提供借鑒。
1 資料與方法
1.1 臨床資料 回顧性分析同期在我院接受CABG+MVP治療的54例伴左室擴大的中-重度IMR患者的臨床資料,其中男31例、女23例,年齡(57.85±6.45)歲,體質量(58.76±4.13)kg,合并糖尿病22例、高血壓27例、高脂血癥25例。納入標準:①同期接受CABG+MVP術治療;②術中二尖瓣病變確診為中-重度IMR;③術前心臟彩超證實合并左室擴大。排除標準:①伴有其它嚴重的心臟疾病需要同期接受外科手術干預;②術前合并有急性心肌梗死或急性左心衰竭;③術中二尖瓣病變確診為輕度IMR。根據術前左室擴大程度,將54例患者分為三組,A組為左室輕度擴大者16例,左室舒張末徑(LVEDD)為50~60 mm;B組為左室中度擴大者30例,LVEDD為60~70 mm;C組為左室重度擴大者8例,LVEDD>70 mm。三組性別、年齡、體質量、合并癥等差異均無統計學意義(P均>0.05)。本研究獲得醫院倫理委員會審核,患者知情同意。
1.2 手術方法 患者均在全身麻醉、氣管插管、中-低溫體外循環輔助下行CABG+MVP治療。氣管插管后常規放置食道超聲探頭,手術開始前采用食道超聲對二尖瓣的結構及功能進行評估。胸部正中切口開胸,游離雙下肢大隱靜脈備用。如冠狀動脈病變涉及左主干或前降支,則游離左乳內動脈備用。經主動脈、上下腔靜脈插管建立體外循環,由右上肺靜脈置入左心引流管。阻斷升主動脈及上下腔靜脈,由主動脈根部灌注含血冷晶體停跳液,心表放冰削。將橋血管與靶血管遠端吻合(除前降支外,其余靶血管均采用大隱靜脈作為橋血管)。取右房-房間隔切口暴露二尖瓣并行MVP,所有患者均置入Metronic硬質二尖瓣成形環(全環)。隨后逐步閉合心臟切口,行左乳內動脈與前降支吻合及橋血管近端吻合,左心排氣,開放升主動脈,心臟復跳后再次行食道超聲評估二尖瓣功能,逐步撤離體外循環,徹底止血、關胸。
1.3 資料收集與分析
1.3.1 術前基礎病變情況 收集并比較三組術前心功能(NYHA分級)、冠狀動脈病變情況。
1.3.2 術中體外循環操作時間情況 記錄并比較三組術中主動脈阻斷時間、體外循環時間、復蘇時間。
1.3.3 術后心功能指標情況 術前、術后24 h及術后6個月時行心臟彩超檢查,記錄并比較手術前后心功能指標包括LVEDD、左室射血分數(LVEF)及二尖瓣返流面積(MRA)。
1.3.4 術后早期并發癥情況 記錄并比較三組術后6個月內常見并發癥的發生情況,如死亡、二次開胸、低心排綜合征、多器官功能障礙、肺部感染及急性腎功能衰竭。
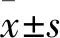
2 結果
2.1 三組術前基礎病變情況比較 三組心功能NYHA分級差異無統計學意義(P>0.05)。C組左主干+三支血管病變的比例高于A、B組(P<0.05);A、B組冠狀動脈病變差異無統計學意義(P>0.05)。見表1。
注:與C組比較,*P<0.05。
2.2 三組術中體外循環操作時間比較 與A、B組比較,C組主動脈阻斷時間、體外循環時間及復蘇時間均延長(P均<0.05)。A、B組主動脈阻斷時間、體外循環時間及復蘇時間差異均無統計學意義(P均>0.05)。見表2。

表2 三組術中體外循環操作時間情況比較
注:與C組比較,*P<0.05。
2.3 三組手術前后心功能指標比較
2.3.1 LVEDD比較 術前及術后24 h時,C組均高于B組,B組均高于A組(P均<0.01);術后6個月時,C組高于B組(P<0.01)。A、C組術后24 h均低于術前(P<0.01);B組術后6個月低于術前及術后24 h,且術后24 h低于術后6個月(P<0.01)。見表3。
2.3.2 LVEF比較 術后24 h時,C組低于A、B組(P<0.01);術后6個月時,B組高于A組,A組高于C組(P<0.05)。B組術前及術后24 h均低于術后6月,C組術后24 h低于術前(P均<0.01)。見表3。
2.3.3 MRA比較 術前及術后6個月時,C組均高于A、B組(P均< 0.01)。三組術后24 h及術后6個月均低于術前(P均<0.05),且B組術后6個月低于術后24 h時(P均<0.05)。見表3。
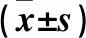
表3 三組手術前后MRA、LVEDD、LVEF比較
注:與C組比較,*P<0.05;與同組術前比較,﹟P<0.05;與同組術后24 h時比較,△P<0.05。
2.4 三組術后早期并發癥比較 A組發生肺部感染3例。B組發生二次開胸1例、術后低心排2例、多器官功能障礙1例、肺部感染7例。C組死亡1例,為62歲老年男性患者,術后早期并發急性左心衰竭、多器官功能障礙綜合征(MODS),經積極治療無效死亡;另發生二次開胸1例、術后低心排5例、多器官功能障礙2例、肺部感染3例、急性腎功能衰竭1例。C組術后低心排的發生率高于A、B組(P均<0.05)。
3 討論
IMR是指由冠狀動脈病變,導致局部心肌供血不足,進而引起的二尖瓣病變。其病理改變主要有以下3點:①乳頭肌斷裂、延長或功能失調;②腱索斷裂;③心肌梗死后心室重構,心腔、瓣環擴大[6]。其中,心室重構被認為是IMR發病的主要機制,心肌缺血導致心室重構,引起左室擴大、乳頭肌拉長、異位、扭曲,甚至斷裂,導致二尖瓣關閉時瓣葉對合不良[7]。而IMR又可增加心室舒張期的容量負荷,導致心腔及二尖瓣瓣環的擴大,進一步加重二尖瓣關閉不全。因此,越來越多的學者建議針對重度IMR患者,應在行CABG改善心肌供血的同時行二尖瓣手術治療,這樣不僅可以減少術后心臟風險事件的發生率,還可以顯著提高該類患者的術后生存率及生活質量[8]。
目前針對中-重度IMR患者的主要治療方式是同期行CABG+MVP術,但是術后IMR的復發率高達25%[9,10],如果術前合并有左心室擴大或左心室功能不全,則術后IMR的復發率高達50%[11,12]。其可能的原因是:擴大的左心室后壁會導致與二尖瓣后瓣相連的腱索及乳頭肌移位,進而引起對二尖瓣后瓣的牽拉力增加,限制了二尖瓣后瓣活動,導致二尖瓣閉合不全[13]。因此,針對中-重度IMR尤其是合并左室擴大的患者,是否應同時接受CABG+MVP治療尚無統一定論[14]。本研究回顧性分析了54例伴左室擴大的中-重度IMR患者接受CABG+MVP術治療的相關資料,探討左室擴大對該類患者接受CABG+MVP術早期療效的影響。
在術前基礎病變及術中體外循環操作時間方面,本研究結果表明,C組左主干+三支血管病變的比例高于A、B組,提示左室重度擴大的冠狀動脈病變較重;C組主動脈阻斷時間、體外循環時間及復蘇時間均長于A、B兩組,提示左室擴大嚴重者因冠狀動脈病變較重,術中靶血管的暴露及吻合困難,導致手術時間長、術后心臟復蘇時間也明顯延長。
在手術前后心功能指標方面,本研究結果表明,C組術后6個月時MRA明顯增加,提示對左室重度擴張者行MVP治療的早期效果不佳;A、B組術后6個月內LVEDD逐漸縮小,甚至部分患者可恢復至正常水平;但C組僅術后24 h內出現的LVEDD的縮小,術后6個月時LVEDD無明顯變化,這可能是由于C組患者術前冠狀動脈病變重、心室擴大明顯、局部心肌活性及可塑性差所致[15];A、B組患者術后6個月內LVEF逐漸恢復至正常水平,由于術前合并中-重度IMD,故術后實際有效LVEF是提升的;C組患者術后24 h的LVEF較術前下降、術后低心排的發生率較高,其可能原因有兩個:①雖然LVEF有所下降,但由于術前合并有中-重度IMR,故而實際有效的LVEF是上升的;②術后24 h內心功能恢復緩慢,而術后24 h與術后6個月的LVEF無統計學差異,表明C組患者術后6個月時左室收縮功能無明顯改善,且由于C組患者術后6個月時IMR加重,故有效LVEF是下降的。
通過對上述病例資料的總結分析,我們對合并有左室擴大的中-重度IMR患者的外科治療經驗如下:①針對術前合并輕中度左室擴大的IMR患者,推薦同期行CABG+MVP治療,其術后早期效果滿意;②針對術前合并有左室重度擴大的中-重度IMR患者,由于MVP術后6個月合并有二尖瓣返流加重,故同期接受CABG+MVP治療效果不佳;③術前左室擴大越明顯、手術難度越大、手術時間越長、術后合并心力衰竭的可能性越大,故圍術期應注意維護心功能治療,必要時可采用主動脈內球囊反搏(IABP)治療。
本研究為回顧性研究,未能做到完全隨機化,存在一定的選擇偏移;本研究入選病歷較少、觀察時間較短,故進一步的前瞻性、大樣本、長時間研究有待開展。

