液相色譜串聯(lián)質(zhì)譜檢測(cè)牙鲆魚(yú)中的小清蛋白過(guò)敏原
葛敏敏,王建華,林洪
1(中國(guó)海洋大學(xué) 食品科學(xué)與工程學(xué)院,山東 青島, 266003)2(青島海關(guān)檢驗(yàn)檢疫技術(shù)中心,山東 青島,266002)
小清蛋白(parvalbumin,PV)是水產(chǎn)品中的主要過(guò)敏原,在真骨魚(yú)類中廣泛存在,其對(duì)溫度、pH和變性劑都較為穩(wěn)定,因此很多加工過(guò)的魚(yú)類產(chǎn)品仍具有致敏性。魚(yú)類肌肉中小清蛋白的含量范圍為 0~1.5 mmol /L[1],牙鲆的PV有3個(gè)亞基,本文只研究其中1個(gè)亞基G9I585(uniprot中PV編號(hào)),對(duì)其進(jìn)行定性定量分析。
“bottom up”[2]的蛋白質(zhì)組學(xué)分析方法,其一般過(guò)程為:首先利用酶將目標(biāo)蛋白質(zhì)切成小分子質(zhì)量的肽段,然后通過(guò)液相色譜串聯(lián)質(zhì)譜(high performance liquid chromatography tandem mass spectrometry,HPLC-MS/MS)對(duì)肽段進(jìn)行檢測(cè)。HPLC-MS/MS分析方法的建立最好每個(gè)蛋白質(zhì)選 2~3 個(gè)特征肽段,以獲得更好的特異性[3],一般選用胰蛋白酶對(duì)蛋白質(zhì)進(jìn)行酶解,產(chǎn)生的肽羧基末端通常為精氨酸或賴氨酸,經(jīng)ESI源離子化后主要產(chǎn)生帶有2個(gè)正電荷的離子,二級(jí)質(zhì)譜碎裂時(shí)產(chǎn)生的子離子一般為Y型離子帶有1個(gè)正電荷[4]。目前“bottom up”方法逐漸應(yīng)用于牛奶[5]、雞蛋、魚(yú)類[6]、甲殼貝類動(dòng)物[7]、堅(jiān)果[8]、小麥、花生[9]等主要致敏原的檢測(cè),相比于傳統(tǒng)方法酶聯(lián)免疫吸附測(cè)定(ELISA)[10]、聚合酶鏈?zhǔn)椒磻?yīng)(PCR)[11],LC-MS / MS方法具有準(zhǔn)確、靈敏、快速的特點(diǎn),因此LC-MS/MS將作為一種重要的過(guò)敏原檢測(cè)方法。
在真骨魚(yú)類PV的檢測(cè)方面,蔡秋鳳等[12-13]分別采用ELISA和Western-blotting 方法對(duì)不同加工方式的鰱魚(yú)的PV的含量變化進(jìn)行分析,CARRERA等[6]利用LC-MS/MS方法對(duì)真骨魚(yú)的PV進(jìn)行定性分析,但沒(méi)有進(jìn)行定量檢測(cè)。
本實(shí)驗(yàn)利用高分辨質(zhì)譜進(jìn)行特征肽段的篩選,選擇ALTDAETK、LFLQNFAFSASAR和SDFIEEDELK作為牙鲆PV的特征肽段,并對(duì)蛋白質(zhì)提取液體和酶解過(guò)程的吲哚-3-乙酸(indole-3-acetic, IAA)濃度、酶用量、酶解時(shí)間進(jìn)行了優(yōu)化,建立了以ALTDAETK作為定量肽段,LFLQNFAFSASAR和SDFIEEDELK作為定性肽段的牙鲆PV檢測(cè)的LC-MS / MS方法,可以實(shí)現(xiàn)對(duì)牙鲆中PV的精確定量。采用LC-MS/MS方法對(duì)牙鲆中PV的定量分析及對(duì)牙鲆PV的前處理優(yōu)化過(guò)程未見(jiàn)文獻(xiàn)報(bào)道。
1 材料與方法
1.1 材料與試劑
牙鲆、大菱鲆購(gòu)自山東青島。
LTDAETK(摩爾質(zhì)量:847.9 g/mol,簡(jiǎn)稱ALT)、SDFIEEDELK(摩爾質(zhì)量:1 224.3 g/mol,簡(jiǎn)稱SDF)、LFLQNFAFSASAR(摩爾質(zhì)量:1 253.4 g/mol,簡(jiǎn)稱LFL)、SDFIEEDELK(摩爾質(zhì)量:605.8 g/mol,簡(jiǎn)稱sdf)、重組PV(摩爾質(zhì)量:11 645.0 g/mol),委托上海Sangon Biotech公司合成(純度>95%);測(cè)序級(jí)胰蛋白酶,瑞士Roche公司;二硫蘇糖醇,北京Solarbio公司;吲哚-3-乙酸,北京Solarbio公司;Rapigest SF,美國(guó)Waters公司;Tris(分析純),北京Scientan公司;甘氨酸(分析純),北京Solarbio公司;EDTANa4(分析純),天津Kermel公司;乙腈(色譜純),德國(guó)Merck公司;甲酸(色譜純),德國(guó)Fluka公司。
1.2 儀器與設(shè)備
1200/6430液相色譜-三重四級(jí)桿串聯(lián)質(zhì)譜儀,美國(guó)Agilent公司;UPLC-Q-Exactive Focus MS超高效液相色譜四級(jí)桿靜電場(chǎng)軌道阱質(zhì)譜聯(lián)用儀,美國(guó)Thermo Scientific公司;BEH-C18色譜柱,美國(guó)Waters公司;HS501水平振蕩器,德國(guó)IKA公司;CR21G高速冷凍離心機(jī),日本HITACHI公司;調(diào)速形迷你離心機(jī),上海Sangon Biotech公司;Mill-Q超純水裝置,美國(guó)Millipore公司;HH-1水浴鍋,國(guó)華電器有限公司。
1.3 方法
1.3.1 重組PV的酶解
前處理:取10 μL重組PV水溶液(8 μg/mL),加入90 μL Rapigest SF(0.1%,體積分?jǐn)?shù)),加入30 μL IAA(濃度5 mol/L) 溶液,40 ℃避光水浴30 min; 加入20 μL胰蛋白酶溶液(質(zhì)量濃度0.1 mg/mL),加入水使酶解液體積達(dá)到198 μL,酶解14 h,加入2 μL甲酸終止酶解,12 000 r/min離心30 min后,取上清;進(jìn)UPLC-Q-Exactive Focus MS檢測(cè)。
1.3.2 樣品前處理?xiàng)l件優(yōu)化
提取:新鮮牙鲆取肌肉打碎,取1 g(精確至0.01 g)樣品,加入 10 mL蛋白質(zhì)提取液3 (0.1 mol/L Tris,0.5 mmol/L 甘氨酸),水平振蕩30 min,12 000 r/min離心30 min后,取上清;上清液于100 ℃水浴鍋中加熱5 min,12 000 r/min離心30 min取上清。
酶解:取10 μL上清液,加入90 μL Rapigest SF(質(zhì)量濃度1 mg/mL),按酶/蛋白質(zhì)質(zhì)量比為2∶5加入胰蛋白酶溶液(0.1 mg/mL),加入水使酶解液體積達(dá)到198 μL,酶解12 h,加入2 μL甲酸終止酶解,12 000 r/min離心30 min后, 取上清;待LC-MS/MS上樣分析。
1.3.3 UPLC-Q-Exactive Focus MS條件
色譜條件色譜柱:EC-C18色譜柱(100 mm×3 mm, 1.7 μm);柱溫:35 ℃;進(jìn)樣量:5 μL;流動(dòng)相A:含1%(體積分?jǐn)?shù))甲酸的水溶液;流動(dòng)相B:含1%(體積分?jǐn)?shù))甲酸的乙腈溶液;梯度洗脫程序:0~15 min,97%~70%A;15~18 min,70%~100%A;18~22 min, 0%A;22~22.1 min,0%~97%A;22.1~25 min,97%A;流速0.3 mL/min。
質(zhì)譜條件:帶有加熱器的電子噴霧電離源(HESI),輔助氣體加熱器溫度:300 ℃;毛細(xì)管電壓:3 500 V; 毛細(xì)管溫度為320 ℃;正模式的電噴霧電壓設(shè)置為3 500 V;掃描模式:Full MS+ddMS2正離子模式數(shù)據(jù)非依賴型掃描,其中Full MS的分辨率為70 000, 掃描范圍為400~1 400m/z,DD-MS2確認(rèn)模式分辨率17 500,四極桿的碰撞能量介于10~30 eV。
使用MaxQuent軟件[14]進(jìn)行數(shù)據(jù)處理,牙鲆PV的氨基酸序列用作Fasta文件。
1.3.4 LC-MS/MS方法的建立
色譜條件色譜柱:BEH-C18色譜柱(100 mm×2.1 mm, 2.7 μm);柱溫:35 ℃;進(jìn)樣量:10 μL;流動(dòng)相A:含1%(體積分?jǐn)?shù))甲酸的水溶液;流動(dòng)相B:含1%(體積分?jǐn)?shù))甲酸的乙腈溶液;梯度洗脫程序:0~13 min,97%~70%A;13~18 min,70%~40% A;18~19 min, 40%~0% A;19~21 min, 0% A;21~22 min, 0%~97% A;22~24 min, 97% A。流速0.2 mL/min。
質(zhì)譜條件離子源:電子噴霧電離源(ESI);毛細(xì)管電壓:3 500 V;霧化氣壓力:275.9 kPa;干燥氣溫度:300 ℃;干燥氣流速:12.0 L/min(氮?dú)?;采集模式:多反應(yīng)監(jiān)測(cè)(MRM)模式。
2 結(jié)果與分析
2.1 特征肽段的選擇
重組PV酶解液經(jīng)高分辨質(zhì)譜檢測(cè),其數(shù)據(jù)經(jīng)MaxQuent軟件處理,從而得到酶解肽段的響應(yīng)及得分(表1)。

表1 重組PV的酶解肽段的響應(yīng)及得分Table 1 Intension and scorre of enzymolysis peptides of recombination PV
根據(jù)肽段穩(wěn)定性和質(zhì)譜檢測(cè)的要求,特征肽不應(yīng)含有易氧化氨基酸半胱氨酸(C)和蛋氨酸(M)且長(zhǎng)度在8到18個(gè)氨基酸[15], LFLQNFSASAR、ALTDAETK、 SDFIEEDELK滿足要求,因此選擇這3個(gè)肽段作為特征肽段。CARRER等[6]將LFLQNFSASAR等19種作為鑒定真骨魚(yú)的肽段,沒(méi)有將ALTDAETK、 SDFIEEDELK作為鑒定真骨魚(yú)的肽段。為了確定肽段的獨(dú)特性,3個(gè)特征肽段在UniProtKB 數(shù)據(jù)庫(kù)中進(jìn)行序列對(duì)比,結(jié)果顯示SDFIEEDELK為牙鲆特有肽段,而LFLQNFSASAR和ALTDAETK兩個(gè)肽段在三文魚(yú)、鯉魚(yú)、鱈魚(yú)、鱸魚(yú)等多種真骨魚(yú)中含有。用LC-MS/MS方法對(duì)三文魚(yú)和鯉魚(yú)肌肉樣品進(jìn)行檢測(cè),沒(méi)有SDFIEEDELK檢出,LFLQNFSASAR和ALTDAETK均有檢出,與數(shù)據(jù)庫(kù)檢索結(jié)果一致。
2.2 前處理方法優(yōu)化
首先對(duì)提取液方法進(jìn)行優(yōu)化,以提取液所提取的總蛋白質(zhì)濃度進(jìn)行比較分析;其次在重組PV的酶解方法(見(jiàn)1.3.1)基礎(chǔ)上對(duì)IAA濃度、酶用量、酶解時(shí)間4個(gè)酶解條件依次進(jìn)行單因素水平的優(yōu)化,以肽段在儀器上的相對(duì)響應(yīng)進(jìn)行比較分析。
2.2.1 蛋白質(zhì)提取液的優(yōu)化
在WU等[16]的牙鲆PV提取液1的基礎(chǔ)上進(jìn)行提取液的優(yōu)化,優(yōu)化的3種蛋白質(zhì)提取液分別為:蛋白質(zhì)提取液1:Tris(0.1 mol/L),甘氨酸(0.5 mmol/L),DTT(1 mmol/L);蛋白質(zhì)提取液2:Tris(0.1 mol/L),甘氨酸(0.5 mmol/L),DTT(1 mmol/L),EDTA(5 mmol/L);蛋白質(zhì)提取液3:Tris(0.1 mol/L),甘氨酸(0.5 mmol/L)。
提取液1、2、3所提取的總蛋白質(zhì)質(zhì)量濃度分別為1.49 mg/mL、1.18 mg/mL、0.94 mg/mL(蛋白質(zhì)質(zhì)量濃度由BCA方法測(cè)得)。由圖1可以看出,ALT、LFL兩個(gè)肽段的相對(duì)響應(yīng)為提取液3>提取液2>提取液1,對(duì)于SDF肽段來(lái)說(shuō)提取液3>提取液1>提取液2。

圖1 提取液優(yōu)化Fig.1 Optimization of extraction liquid
提取液中的DTT作為一種還原劑,可以避免蛋白質(zhì)中半胱氨酸之間形成分子內(nèi)或分子間的二硫鍵,阻止蛋白高分子聚合物的形成提高提取效率[3],但是在酶解過(guò)程中DTT也會(huì)對(duì)酶作用,抑制酶的活性導(dǎo)致酶解效率降低,從而質(zhì)譜響應(yīng)降低,因此經(jīng)不含DTT的提取液3提取的樣品響應(yīng)最高;從提取液1和提取液2比較來(lái)看,EDTA對(duì)蛋白提取效率沒(méi)有提高作用。綜合考慮選擇提取液3。
2.2.2 IAA濃度的優(yōu)化
進(jìn)行IAA(5 mmol/mL)用量的優(yōu)化,IAA優(yōu)化的3個(gè)水平分別為添加0、15、30 μL,其結(jié)果如圖2所示,對(duì)于ALT、SDF肽段來(lái)說(shuō)0 μL>15 μL>30 μL,對(duì)于LFL來(lái)說(shuō)30 μL>0 μL>15 μL。肽段與IAA烷基化過(guò)程中發(fā)生的非特異性化學(xué)修飾有關(guān)[18],這將改變標(biāo)肽的質(zhì)量,而肽的質(zhì)量發(fā)生變化將導(dǎo)致該肽不能被MRM方法檢出,因此測(cè)得的肽產(chǎn)率將低于實(shí)際產(chǎn)率;再者作為烷基化試劑的IAA可能對(duì)酶存在一定的抑制作用從而導(dǎo)致酶解程度下降,綜合考慮,選擇酶解過(guò)程不添加IAA。
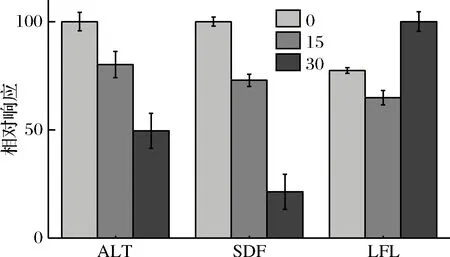
圖2 IAA優(yōu)化提取液優(yōu)化Fig.2 Optimization of IAA
2.2.3 酶用量?jī)?yōu)化
PV是一種鈣結(jié)合蛋白,具有由約30 個(gè)氨基酸殘基組成的螺旋-環(huán)-螺旋蛋白模體的EF手圖像,每個(gè)EF手圖像(模體)結(jié)合1個(gè)Ca2+,為小清蛋白提供了更加穩(wěn)定的結(jié)構(gòu)[1],PV具有較高的酶解穩(wěn)定性,因此本實(shí)驗(yàn)設(shè)計(jì)的5個(gè)水平的酶/蛋白質(zhì)(質(zhì)量比)高于一般的酶/蛋白質(zhì)(1∶100~1∶10)[17],酶/蛋白質(zhì)(質(zhì)量比)分別為1∶10、1∶5、2∶5、3∶5、4∶5(提取液蛋白質(zhì)濃度通過(guò)BCA方法側(cè)得)。酶用量?jī)?yōu)化結(jié)果如圖3所示,ALT與SDF肽段相對(duì)響應(yīng)隨酶/蛋白質(zhì)的增加而增強(qiáng),但ALT肽段相對(duì)響應(yīng)變化較為緩慢,SDF變化較大,而LFL肽段相對(duì)響應(yīng)隨酶/蛋白質(zhì)(質(zhì)量比)增加大致呈降低趨勢(shì)。

圖3 酶/蛋白質(zhì)質(zhì)量比的優(yōu)化Fig.3 Optimization of the ratio of enzyme and protein
不同的肽段由于其所在二級(jí)結(jié)構(gòu)、自身性質(zhì)及酶濃度不同,其酶解效率有所差異,酶/蛋白質(zhì)(質(zhì)量比)為1∶10~4∶5,ALT肽段的酶解得量比較穩(wěn)定,改變酶的濃度對(duì)酶解效果影響不大,可能已經(jīng)達(dá)到較高程度的酶解;SDF肽段的酶解得量隨酶/蛋白質(zhì)的增大而增大,說(shuō)明此肽段還未達(dá)到完全或較高程度的酶解;LFL肽段可能由于酶解產(chǎn)物抑制或酶錯(cuò)切造成其響應(yīng)隨酶濃度增加而逐漸降低,綜合考慮以酶解得量比較穩(wěn)定的ALT肽段作為定量肽段,以SDF、LFL肽段為定性肽段,酶/蛋白質(zhì)為2∶5。
2.2.4 酶解時(shí)間優(yōu)化
分別選擇4、6、8、10、12、14 h六個(gè)酶解時(shí)間進(jìn)行酶解時(shí)間的優(yōu)化,如圖4所示,ALT、SDF、LFL三個(gè)肽段酶解12 h后達(dá)到平臺(tái)期,因此酶解時(shí)間12 h為最優(yōu),酶解時(shí)間優(yōu)化圖如圖4所示。

圖4 酶解時(shí)間優(yōu)化Fig.4 Optimization ofenzymolysis time
2.2.5 酶解效率
蛋白質(zhì)的定量依賴于該蛋白質(zhì)消化成的用作定量的目標(biāo)肽段,而對(duì)于蛋白質(zhì)的絕對(duì)定量方法的準(zhǔn)確性取決于用作定量的目標(biāo)肽段的酶解程度,若該目標(biāo)肽段沒(méi)有達(dá)到完全酶解則會(huì)損害方法的準(zhǔn)確性[18],以優(yōu)化的牙鲆樣品的最優(yōu)酶解條件(酶/蛋白質(zhì)為2∶5,酶解時(shí)間12 h),對(duì)1 000 mg/mL、500 mg/L、200 mg/L 三個(gè)質(zhì)量濃度水平的重組PV進(jìn)行酶解,以ALT肽段作為定量肽段,以SDF與LFL肽段為定性肽段, ALT肽段酶解效率在104%~106%,滿足檢測(cè)要求。
2.3 LC-MS/MS方法質(zhì)譜參數(shù)優(yōu)化
LFL定性離子對(duì)與CARRERA等[6]一致,其他肽段質(zhì)譜參數(shù)沒(méi)有文獻(xiàn)報(bào)道,為了獲得最佳的質(zhì)譜采集參數(shù),對(duì)ALT、SDF、LFL、sdf四個(gè)合成肽段的前體離子、產(chǎn)物離子、碎裂電壓、碰撞能量等進(jìn)行優(yōu)化,優(yōu)化結(jié)果見(jiàn)表2。
2.4 線性關(guān)系與定量限
以ALT肽段為定量肽段,SDF、LFL肽段為定性肽段,建立PV的檢測(cè)方法,在0.005~100 000 mg/L 9個(gè)點(diǎn)質(zhì)量濃度,ALT質(zhì)譜響應(yīng)與內(nèi)標(biāo)sdf響應(yīng)之比(y)與ALT濃度與內(nèi)標(biāo)sdf濃度之比(x) 的線性關(guān)系為y= 1.221 1x+0.013 3(R2>0.999)。小清蛋白定量限為2.74 mg/kg。

表2 小清蛋白的酶解3個(gè)肽段的保留時(shí)間和質(zhì)譜參數(shù)Table 2 Retention time and mass spectrometric parameters of three peptides
2.3.3 添加回收
大菱鲆與牙鲆是同屬于鲆科的真骨魚(yú)類,經(jīng)已經(jīng)建立的LC-MS/MS方法檢測(cè),大菱鲆中不含SDFIEEDELK、LFLQNFSASAR和ALTDAETK肽段。為了驗(yàn)證牙鲆中PV含量檢測(cè)方法的準(zhǔn)確性,選擇與牙鲆相近的物種大菱鲆為空白基質(zhì),以重組PV為標(biāo)準(zhǔn)品進(jìn)行添加回收實(shí)驗(yàn),3個(gè)添加水平的平均回收率在95%~102%,滿足檢測(cè)要求,相對(duì)標(biāo)準(zhǔn)偏差3%~6%。
2.4 實(shí)際樣品檢測(cè)
采用大菱鲆為空白基質(zhì)配制標(biāo)準(zhǔn)曲線對(duì)牙鲆進(jìn)行檢測(cè),檢測(cè)結(jié)果為ALT肽段含量為0.85 mg/g,小清蛋白含量為11.72 mg/g。
3 結(jié)論
本實(shí)驗(yàn)建立了以Tris(濃度0.1 mol/L)、甘氨酸(濃度0.5 mmol/L) 為提取液,酶解過(guò)程中酶/蛋白質(zhì)(質(zhì)量比)為2∶5,酶解時(shí)間為12 h的牙鲆中PV的前處理方法;以ALTDAETK為定量肽段,SDFIEEDELK、SDFIEEDELK為定性肽段的牙鲆PV的HPLC-MS/MS檢測(cè)方法,首次實(shí)現(xiàn)了用LC-MS/MS方法對(duì)牙鲆中主要過(guò)敏原PV的精確定量檢測(cè)。

