超聲波輔助提取壇紫菜蛋白條件優(yōu)化及其基礎特性研究
于嬌,陳勝軍,胡曉,楊少玲,楊賢慶,李來好,吳燕燕
1(中國水產(chǎn)科學研究院南海水產(chǎn)研究所,國家水產(chǎn)品加工技術研發(fā)中心,農(nóng)業(yè)農(nóng)村部水產(chǎn)品加工重點實驗室,廣東 廣州,510300)2(上海海洋大學 食品學院,上海,201306)
壇紫菜(Porphyrahaitanensis),系暖溫帶性種類[1],主要分布在福建、浙江和廣東沿岸,是我國特有的原始大型經(jīng)濟海藻[2-3]。紫菜蛋白營養(yǎng)價值高,其總氨基酸含量高于滸苔、石莼、裙帶菜、龍須菜、海帶、馬尾藻和麒麟藻[4],含8種必需氨基酸,富含天冬氨酸、谷氨酸、丙氨酸、亮氨酸、纈氨酸、精氨酸和賴氨酸,可彌補谷物蛋白中賴氨酸含量較低的缺陷。中國是世界紫菜的主要生產(chǎn)國和出口國,2016年養(yǎng)殖面積達73千公頃,年產(chǎn)量高達13.5萬t[5],其中壇紫菜占我國紫菜總產(chǎn)量的50%以上[2],具有巨大的碳匯潛力[6]和經(jīng)濟開發(fā)價值。同時,隨著陸地蛋白質(zhì)資源的日益匱乏,海洋藻類作為新型蛋白質(zhì)資源的來源已逐漸受到重視,充分利用壇紫菜的營養(yǎng)價值,滿足人們對于高品質(zhì)蛋白質(zhì)的需求,為提高海洋資源開發(fā)能力和發(fā)展海洋經(jīng)濟提供一條可行之路。
隨著生物技術的迅猛發(fā)展,新型提取方法如超聲波輔助提取法、微波輔助提取法和液氮研磨法被應用到蛋白質(zhì)的提取過程中,具有設備簡單,安全環(huán)保,無化學殘留,耗時短,效率高等優(yōu)勢[7-8]。超聲波輔助提取法(ultrasonic-assisted extraction,UAE)通過在生物基質(zhì)中產(chǎn)生熱效應、機械效應和空化效應破碎植物組織細胞壁[9],已被廣泛應用到蛋白質(zhì)[10]、多糖[11]、多酚[12]、油脂[13]和黃酮類化合物[14]的提取制備。但目前對于紫菜水溶性蛋白質(zhì)的提取、基礎特性研究較少,多數(shù)研究中原料局限于條斑紫菜且提取率普遍低于50%[15-16],而且不同種類的紫菜蛋白在含量、組成等特性上存在一定差異,因此研究壇紫菜蛋白的提取、基礎特性十分必要。2012年,姚興存等[16]采用超聲波提取條斑紫菜蛋白,在超聲時間10 min、溫度50 ℃、料液比10∶1(mg∶mL)條件下提取率為37.6%。 紫菜的采收期一般可分為4次,即頭水、二水、三水和四水,一般越往后營養(yǎng)品質(zhì)越低,三水和四水等相對低值的壇紫菜資源是總產(chǎn)量的主要組成部分,一般較少用于食用[17]。本研究以廣東南澳產(chǎn)三水壇紫菜為原料,優(yōu)化超聲波結合水提酸沉法提取壇紫菜蛋白工藝條件,并對其基礎特性進行測定,旨在為低值壇紫菜的精深加工提供一定科學依據(jù)與理論基礎。
1 材料與方法
1.1 材料與試劑
第三次采收期壇紫菜,收獲于廣東省南澳汕頭市澄海區(qū)培隆紫菜養(yǎng)殖區(qū),在50 ℃烘干至質(zhì)量恒定,過100目篩,干燥保存。凱氏定氮法測得其蛋白質(zhì)含量為34%。
0.1 mol/L NaOH標準溶液、濃H2SO4、0.1 mol/L HCl標準溶液、K2SO4、H3BO3、CuSO4,上海碧云天生物技術有限公司。
1.2 儀器與設備
Kjeltec TM 2300型蛋白自動分析儀,丹麥Foss公司;BioTek全自動酶標儀,美國Bio-Tek公司;JY 99LLDN超聲波細胞粉碎儀,寧波新芝生物科技股份有限公司;日立835-50型高速氨基酸自動分析儀,日本日立公司;TDZ4-WS臺式低速離心機,上海盧湘儀離心機儀器公司;Delta320精密pH計,梅特勒-托利多儀器(上海)公司。
1.3 方法
1.3.1 工藝流程
準確稱取1 g紫菜粉,加入100 mL蒸餾水混合均勻,設置一定的超聲功率,設置頻率參數(shù)為20 kHz,變幅桿25 mm,超聲一定時間,4 500 r/min離心10 min, 將上清液pH調(diào)至等電點4.2,靜置1 h,4 500 r/min離心10 min,收集粗蛋白并真空冷凍干燥24 h。壇紫菜蛋白含量的測定采用凱氏定氮法[18],提取率計算見公式(1)。
(1)
式中:m1,粗蛋白中蛋白質(zhì)質(zhì)量,mg;m0,樣品原料中蛋白質(zhì)質(zhì)量,mg。
1.3.2 單因素試驗設計
依據(jù)SPSS 20.0軟件,采用單因素方差分析法(ANOVE,Tukey檢驗)進行顯著性檢驗,并通過Dunbcan’s法進行單因素多重比較分析,以獲得影響蛋白提取率的顯著性因素。本實驗分別考察了料液比(5∶1、7.5∶1、10∶1、12.5∶1、15∶1(mg∶mL))、功率(720、900、1 080、1 260、1 440 W)、超聲發(fā)出時間(2、4、6、8、10 s)和超聲全程時間(15、30、45、60、75 min)對壇紫菜蛋白提取率的影響。由于超聲發(fā)生時間高于超聲間歇時間時,提取液局部易形成高溫、高壓,易導致蛋白變性,因此本實驗采用相同的超聲發(fā)生時間和超聲間歇時間。
1.3.3 響應面試驗工藝優(yōu)化
依據(jù)Design Expert 8.0.5 Trial軟件,采用Box-Behnken中心組合實驗設計及響應面(response surface methodology,RSM)試驗優(yōu)化關鍵因素,以獲得紫菜蛋白的最佳提取工藝條件。根據(jù)單因素試驗結果,以功率(A)、超聲發(fā)出時間(B)、超聲全程時間(C)3個關鍵因素為自變量,以1、0、-1分別代表自變量的高、中、低水平,共設立17個處理組。試驗因素水平見表1。

表1 響應面試驗因素水平表Table 1 Response surface test factor levelTable
1.3.4 等電點的測定
準確稱取2 g壇紫菜蛋白,溶于200 mL去離子水中,取上清液20 mL并分別調(diào)至pH值為3.4、3.6、3.8、4.0、4.2、4.4、4.6、4.8、5.0,靜置1 h,4 500 r/min離心10 min,取1 mL上清液加入3 mL考馬斯亮藍(G-250)試劑,混勻并-靜置10 min,于595 nm波長處測定吸光度,壇紫菜蛋白的等電點(isoelectric point,pI) 為吸光度值最低點[19]。
1.3.5 紫外-可見分光光度計測定
配制5 mg/mL的蛋白溶液,用紫外-可見分光光度計在200~700 nm進行掃描測定。
1.3.6 氨基酸分析
色氨酸參考GB/T 18246—2000[20]法,其他氨基酸則參考GB/T 5009.124—2016[21]法。
根據(jù)1973年FAO/WHO提出的每克氮氨基酸評分模式和中國預防醫(yī)學科學院營養(yǎng)與食品衛(wèi)生研究所提出的雞蛋蛋白氨基酸評分模式對比分析[22-23]。氨基酸評分(amino acid score,AAS)和化學評分(chemical score,CS)的計算見公式(3)和(4)。

(3)

(4)
(5)
2 結果與分析
2.1 單因素實驗結果的分析
2.1.1 料液比對蛋白質(zhì)提取率的影響
由圖1可知,蛋白質(zhì)的提取率隨著料液比的增加先上升后下降,在 10∶1 (mg∶mL)時提取率達到最大,且各處理組無顯著差異(P>0.05);這是因為溶液的黏度較低,分子擴散速率較高,傳質(zhì)推動力越大,提取率上升;隨著料液比的增加,細胞內(nèi)容物的大量溶出使得溶液的黏度較高,體系分散不均勻,影響了蛋白質(zhì)的溶出量,因而提取率下降。綜合考慮,料液比選擇10∶1 (mg∶mL)較為合適。
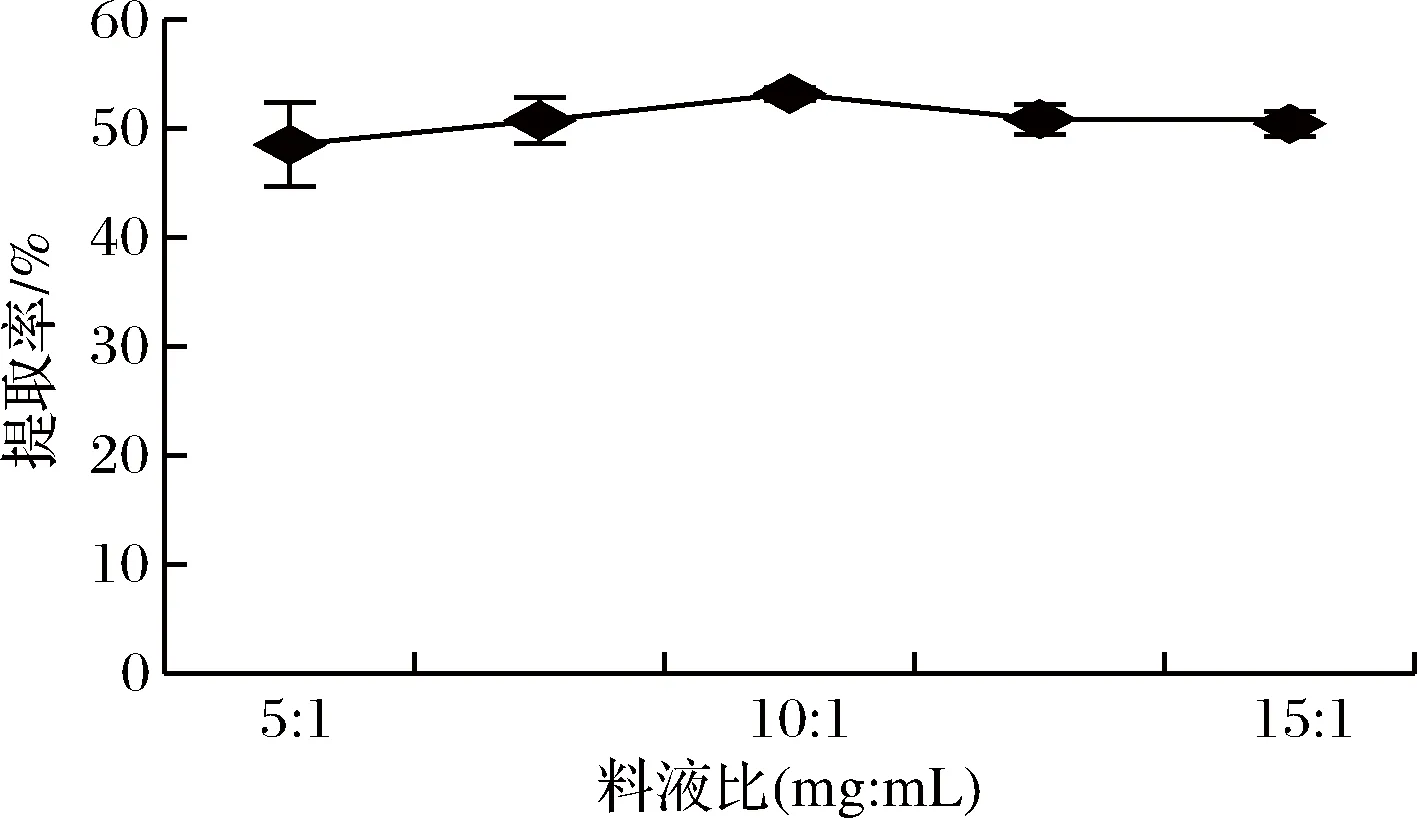
圖1 料液比蛋白質(zhì)提取率的影響Fig.1 Effect of solid-to-solvent ratio on the extraction yield of protein
2.1.2 功率對蛋白質(zhì)提取率的影響
由圖2可知,蛋白質(zhì)的提取率隨著功率的增加先迅速上升后緩慢上升,在超聲功率1 440 W時達到最大,各處理組存在顯著差異(P<0.05);這是因為空化效應和機械效應的增強了蛋白質(zhì)分子與水分子之間相互作用,促進蛋白質(zhì)的溶解[24],因此提取率迅速上升;隨著功率的增加,由于超聲產(chǎn)生的大量微氣泡無法達到完全潰陷造成空化效應和機械效應的減弱,因此提取率上升緩慢。考慮到生產(chǎn)成本和儀器使用壽命,超聲波功率選擇1 080~1 440 W較為合適。

圖2 功率對蛋白質(zhì)提取率的影響Fig.2 Effect of power on the extraction yield of protein
2.1.3 超聲發(fā)出時間對蛋白質(zhì)提取率的影響
由圖3可知,蛋白質(zhì)的提取率隨著超聲發(fā)出時間的增加先緩慢上升后迅速下降,在超聲發(fā)出時間6s時達到最大,且處理組存在顯著差異(P<0.05);這是因為持續(xù)的超聲促進了蛋白質(zhì)分子與水分子之間的相互作用,有利于蛋白質(zhì)的溶出,因此提取率增加;隨著超聲發(fā)出時間的增加,超聲局部產(chǎn)生的熱效應使得蛋白質(zhì)空間構象的次級鍵被破壞,促進了蛋白質(zhì)分子間相互結合而形成沉淀[25],不利于蛋白質(zhì)的溶出,且超聲探頭工作時間過長影響其使用壽命。綜合考慮,超聲發(fā)出時間選擇4~8 s較為合適。

圖3 超聲發(fā)出時間對蛋白質(zhì)提取率的影響Fig.3 Effect of ultrasound emit time on the extraction yield of protein
2.1.4 超聲全程時間對蛋白質(zhì)提取率的影響
由圖4可知,蛋白質(zhì)的提取率隨著超聲全程時間的增加先迅速上升后迅速下降,在超聲全程時間達到45 min時達到最大,且處理組存在顯著差異(P<0.05); 這是因為超聲波增強了水分子配位能力,促進了蛋白質(zhì)分子和水分子的交互作用,因此提取率上升;隨著超聲全程時間的增加,蛋白質(zhì)疏水集團暴露而巰基被掩埋在分子內(nèi)部,通過非共價鍵形成了蛋白質(zhì)聚集體,因此蛋白質(zhì)提取率下降[26]。綜合考慮,超聲全程時間選擇30~60 min較為合適。

圖4 超聲全程時間對蛋白質(zhì)提取率的影響Fig.4 Effect of ultrasound full time on the extraction yield of protein
2.2 響應面分析
2.2.1 數(shù)學模型的建立與顯著性分析
經(jīng)Design-Expert 8.0.5軟件對表2結果進行分析,得到紫菜蛋白提取率的二次回歸模型:Y/%= 61.17+0.91A+0.58B+3.53C-0.01AB-0.06AC+1.02BC-4.63A2-2.89B2-3.86C2

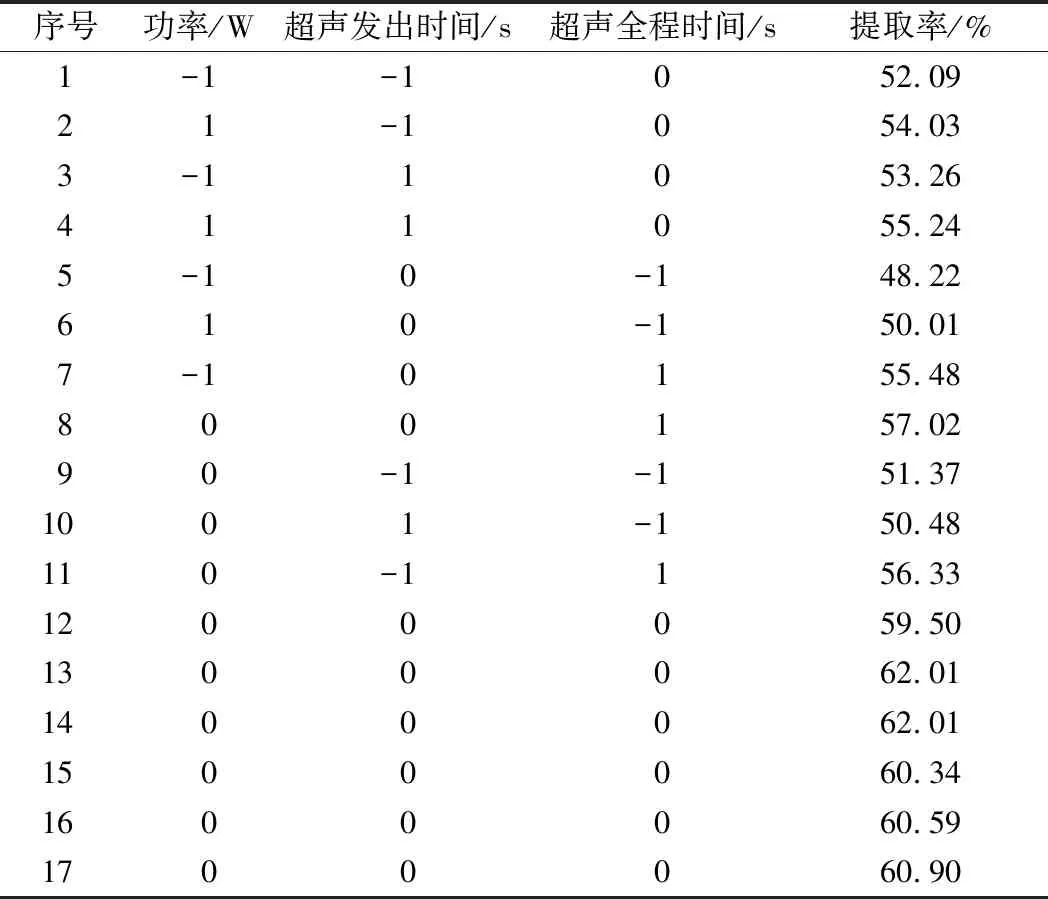
表2 響應面實驗設計及結果Table 2 Experimenal design and correspongding results for respond surface analysis
由A、B、C的F值大小可以推斷出,3個因素對壇紫菜蛋白提取率影響主次順序為C>A>B。由表2可知,平行試驗中數(shù)據(jù)存在一定的波動性,這可能是由于變幅桿的超聲探頭作為一種耗材,長時間的工作模式會使其變幅桿探頭逐漸磨損,超聲效果變差,因此認為不同磨損程度上的超聲探頭發(fā)出超聲的強度略有差異。
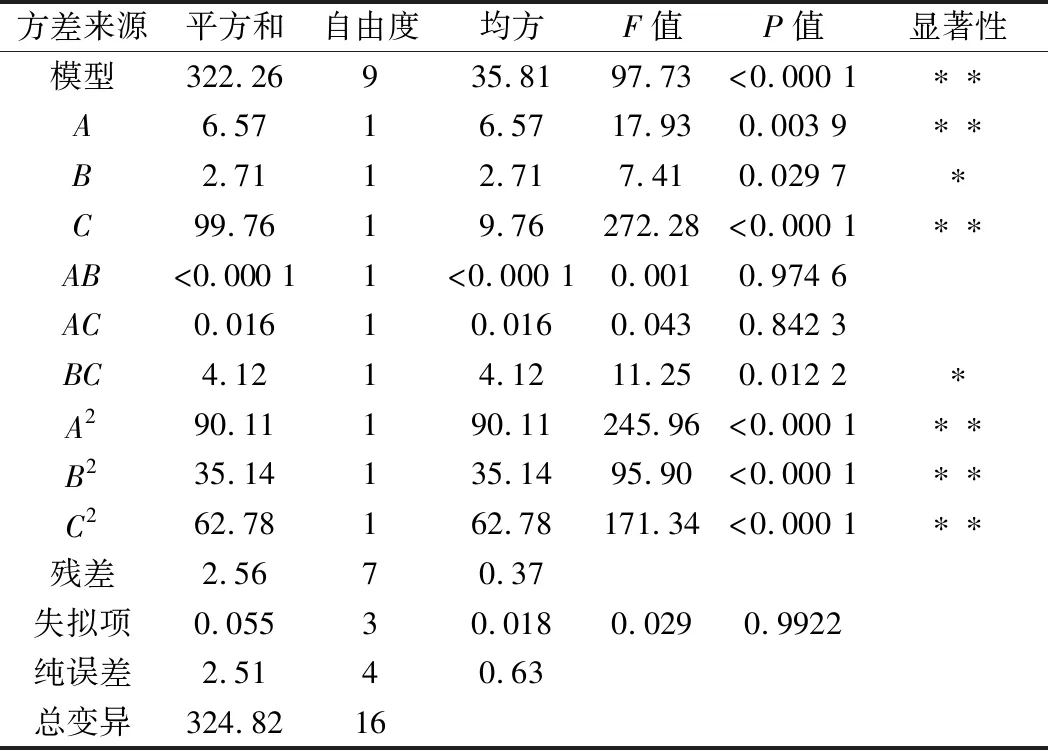
表3 回歸方程的方差分析Table 3 Analysis of variance for the fitted regression model
注:**,P<0.01,差異極顯著;*,P<0.05,差異顯著。
2.2.2 因素間交互作用影響結果
經(jīng)過Design-Expert 8.0.5軟件處理,得到功率(A)、超聲發(fā)生時間(B)、超聲全程時間(C)交互作用的響應面和等高線圖。如圖5~圖7所示,超聲全程時間和超聲發(fā)生時間(BC)對壇紫菜蛋白提取率的影響顯著,功率和超聲發(fā)出時間(AB)、功率和超聲全程時間(AC)交互作用不顯著,與顯著性分析結果相符。
根據(jù)所得到的響應面模型,經(jīng)Design-Expert 8.0.5軟件處理得到最優(yōu)工藝為功率1 276.73 W、超聲發(fā)生時間6.37 s、超聲全程時間52.22 min,在此條件下壇紫菜蛋白提取率為62.12%。考慮到實際可操作性,調(diào)整工藝參數(shù)為功率1 278 W、超聲發(fā)生時間6 s、超聲全程時間52 min,在此條件下進行3組驗證實驗,壇紫菜蛋白提取率為61.13%、60.96%、61.50%,取平均值為61.20%,與理論值較為接近,表明響應面模型對優(yōu)化壇紫菜蛋白的提取工藝可行。

圖5 功率和超聲發(fā)出時間交互作用的響應面和等高線圖Fig.5 Response surface and contour plots of interactions between power andultrasonic emission time

圖6 功率和超聲全程時間交互作用的響應面和等高線圖Fig.6 Response surface and contour plots of interactions between power and ultrasound full tme

圖7 超聲發(fā)出時間和超聲全程時間交互作用的響應面和等高線圖Fig.7 Response surface and contour plots of interactions between ultrasonic emission time and ultrasonic full time
2.3 壇紫菜蛋白基礎特性分析
2.3.1 等電點分析
由圖8可知,pH值在3.4~5.0變化時,樣品上清液吸光度呈現(xiàn)先下降后上升的趨勢,在pH 4.2時吸光度最低,上清液中蛋白溶解度最小,即壇紫菜蛋白的等電點pI為4.2;這是因為pH靠近等電點時,蛋白質(zhì)之間的疏水相互作用增強,蛋白質(zhì)無序聚集,溶解度部分喪失或全部喪失[27]。

圖8 蛋白等電點測定結果Fig.8 Isoelectric point of the protein
2.3.2 紫外光譜分析
大部分氨基酸在紫外區(qū)僅有一個吸收峰,吸收峰多集中在200~220 nm,而Phe的吸收峰在222 nm 與259 nm,Tyr的吸收峰在231 nm及272 nm,Trp的吸收峰在227 nm與279 nm[28]。由圖9可知,在200~700 nm對蛋白溶液進行紫外-可見光譜掃描時,220~280 nm曲線吸收較高,在260 nm 出現(xiàn)最大吸收峰,且未見明顯雜峰;這是因為壇紫菜蛋白質(zhì)氨基酸組成種類較多,Phe含量高于Tyr和Trp,因此最大吸收峰靠近Phe的最大吸收峰波長為259 nm。

圖9 蛋白溶液紫外-可見光譜掃描Fig.9 UV-visible spectrum of the protein solution
2.3.3 氨基酸組成分析
由表4可知,檢測到壇紫菜蛋白中共17種氨基酸(半胱氨酸未檢測),種類齊全,Glu、Asp和Ala含量最高,必需氨基酸質(zhì)量分數(shù)為40.29%,非必需氨基酸質(zhì)量分數(shù)為59.71%,必需氨基酸和非必需氨基酸的比例為0.675,高于世界衛(wèi)生組織規(guī)定值0.666,表明壇紫菜蛋白氨基酸組成合理[29]。僅根據(jù)必需氨基酸與非必需氨基酸的比例無法完全評估壇紫菜蛋白質(zhì)的營養(yǎng)價值[30],因此采用FAO/WHO聯(lián)合推薦的必需氨基酸模式和雞蛋蛋白模式評估蛋白質(zhì)營養(yǎng)價值。由表5可知,壇紫菜蛋白中Val、Lys、Leu、Thr和Phe+Tyr高于FAO/WHO氨基酸標準模式;Val、Leu、Thr和Phe+Tyr高于雞蛋蛋白氨基酸模式,表明壇紫菜蛋白氨基酸組成與人體需求模式基本平衡,是一種理想蛋白源。Met的必需氨基酸評分(AAS)和化學評分(CS)評分最低,是第一限制性氨基酸。壇紫菜蛋白質(zhì)的氨基酸組成比例與EUN-SUN等[31]測定結果相比,氨基酸組成較為相似,但氨基酸占總氨基酸含量比例卻不同,這可能與紫菜的品種、生長環(huán)境、生長季節(jié)有關。

表4 壇紫菜蛋白氨基酸組成Table 4 Amino acid of composition of Algal protein
注:E為必需氨基酸總和;N為非必需氨基酸總和。

表5 蛋白模式及必需氨基酸分析Table 5 Protein mode and essential amino acid analysis
3 結論
本實驗選用三水紫菜作為原料,采用UAE進行壇紫菜蛋白的制備,運用單因素試驗、響應面模型進行壇紫菜蛋白工藝的優(yōu)化,同時對壇紫菜蛋白基礎特性進行研究,旨在為低值壇紫菜的精深加工提供一定理論依據(jù)。通過3因素3水平的響應面實驗設計,壇紫菜蛋白最佳提取工藝為超聲功率為1 278 W、超聲發(fā)出時間為6 s、超聲全程時間為52 min,得率最高為61.20%,同時測定了壇紫菜蛋白的等電點、紫外最大吸收波長和氨基酸種類與含量,本研究為低值壇紫菜的研究開發(fā)提供了一定的科學依據(jù)和理論支持。

