重組Bacillus subtilis產麥芽四糖淀粉酶的發酵優化及麥芽四糖制備
楊亞楠,宿玲恰,吳敬*
1(食品科學與技術國家重點實驗室(江南大學),江蘇 無錫,214122) 2(工業生物技術教育部重點實驗室(江南大學),江蘇 無錫,214122)
麥芽四糖淀粉酶具有外切酶活性,屬于GH13家族的淀粉水解酶類,從淀粉的非還原末端,特異的依次切割第4個α-1,4糖苷鍵,生成以麥芽四糖為主的麥芽低聚糖。麥芽四糖是由4個α-D型葡萄糖基以α-1,4糖苷鍵連接成的直鏈麥芽低聚糖,是一種功能性食品,其甜度低、黏度高、保濕性好,具有易消化吸收、低滲透壓等特點和抑制腸內腐敗菌、保持腸道健康、促進人體對Ca2+吸收等功能,主要應用于食品與醫療領域。
1971年,ROBYT和ACKERMAN首次報道了PseudomonasstutzeriNRRL B-3389來源的麥芽四糖淀粉酶[1],此后相繼在PseudomonassaccharophilaIAM1504[7]、PseudomonasstutzeriMO-19[2]、Pseudomonassp.IMD 353[5]、PseudomonasstutzeriAS22[6]等菌株中發現麥芽四糖淀粉酶。1989年,FUJITA等在大腸桿菌中克隆表達PseudomonasstutzeriMO-19來源的麥芽四糖淀粉酶[4]。MAALEJ等用PseudomonasstutzeriAS22發酵產酶可達6.9 U/mL[6]。FOGARTY等用Pseudomonassp.IMD 353發酵產酶可達13 U/mL,是目前報道的最高水平[5]。2014年,韋云萍等在枯草芽孢桿菌1A747中克隆表達了PseudomonassaccharophilaIAM1504來源的麥芽四糖淀粉酶,并證明其水解淀粉生成的產物以麥芽四糖為主[22]。
2011年,LEE等使用Bacilluslicheniformis來源的麥芽四糖淀粉酶能夠從液化淀粉中產生>45%的麥芽四糖[13]。2013年,杰能科公司錢瑩等對Pseudomonassaccharophila來源的改造后的新型麥芽四糖淀粉酶的反應pH、溫度、底物濃度及與普魯蘭酶的協同作用進行探究,最終生成麥芽四糖的轉化率最高可達54%,是目前報道的最高水平[24]。
Pseudomonassaccharophila來源的麥芽四糖淀粉酶水解淀粉生成的產物以麥芽四糖為主。本研究采用前期構建的Pseudomonassaccharophila來源的麥芽四糖淀粉酶重組枯草芽孢桿菌,通過對培養基中氮源和碳源優化,降低發酵成本。并利用重組麥芽四糖淀粉酶制備麥芽四糖,對制備條件進行加酶量、溫度、pH、底物濃度和反應時間的優化,提高麥芽四糖轉化率。
1 材料與方法
1.1 菌株與儀器
BacillussubtilisWS11(含有本實驗室改造的高效表達載體pHY300PLK-g4)。
SHA-1102C空氣恒溫搖床,上海精密儀器儀表有限公司;Agilent 1200高效液相色譜,美國Agilent公司;FE28-Standard pH計,瑞士Mettler-Toledo公司;UV-1700紫外可見分光光度計,日本Shimadzu公司;HZ-9212SB恒溫水浴搖床,太倉市華利達實驗設備有限公司。
LB培養基(g/L):酵母粉5,蛋白胨10,NaCl 10。
TB培養基(g/L):酵母粉24,蛋白胨12,甘油5,K2HPO412.54,KH2PO42.31。
1.2 實驗方法
1.2.1 搖瓶發酵生產麥芽四糖淀粉酶
種子培養:從-80 ℃保藏的甘油管中接25 μL的菌液至10 mL的LB培養基,37 ℃、200 r/min,培養8~10 h。
搖瓶發酵:將種子液以5%的接種量接入TB培養基(無甘氨酸),37 ℃、200 r/min,培養至OD600約為1.5(約2 h),降溫至33 ℃進行重組蛋白的誘導表達,培養48 h。轉速為8 000 r/min,離心15 min收集上清,即為麥芽四糖淀粉酶粗酶液。
1.2.2 重組麥芽四糖淀粉酶酶活的測定
測定體系為15 mL,以1 mL的10 g/L的可溶性淀粉為底物,加入0.9 mL的緩沖液(50 mmol/L 的Na2HPO4-檸檬酸,pH 7.0),空白對照加入1.0 mL的緩沖液,在55 ℃水浴保溫10 min,加入0.1 mL的酶液,反應10 min,加入3 mL DNS溶液,沸水浴7 min,冰水冷卻,定容至15 mL,在OD540下測吸光度值。酶活定義:每分鐘生成1 μmol麥芽四糖所需要的酶量定義為1個酶活單位(U)。
1.2.3 麥芽四糖淀粉酶的搖瓶優化
氮源種類及濃度優化:按照上述搖瓶發酵的方法用豆粕粉、玉米漿、工業蛋白胨、大豆蛋白胨、牛蛋白胨、魚蛋白胨替換TB培養基中的氮源酵母粉和蛋白胨,終質量濃度均為35 g/L,探究單一氮源對發酵的影響,并在此基礎上考察組合氮源及不同濃度配比對重組菌的生長及發酵產酶的影響。
碳源種類及濃度優化:在上述基礎上用甘油、葡萄糖、麥芽糖、蔗糖、玉米糊精和可溶性淀粉替換TB培養基中的碳源甘油,終質量濃度均為5 g/L,探究最優碳源并在此基礎上考察不同濃度的碳源對重組菌的生長及發酵產酶的影響,設置碳源質量濃度為1~25 g/L。
1.2.4 制備麥芽四糖的反應條件優化
pH值對酶反應的影響:以150 g/L麥芽糊精(DE 5~7)為底物,分別用pH 6.0、7.0、8.0、 9.0的50 mmol/L的Na2HPO4-檸檬酸緩沖液溶解底物,加酶量30 U/g底物,置于轉速為150 r/min、溫度為50 ℃的水浴搖床中,轉化12 h,用高效液相色譜(high performance liquid chromatography,HPLC)檢測麥芽四糖生成量。
溫度對酶反應的影響:以150 g/L麥芽糊精(DE 5~7)為底物,用50 mmol/L的Na2HPO4-檸檬酸緩沖液(pH為7.0)溶解底物,加酶量30 U/g底物,置于轉速為150 r/min、溫度分別為40、45、50、55、60 ℃的水浴搖床中,轉化12 h,用HPLC檢測麥芽四糖生成量。
加酶量對酶反應的影響:以150 g/L麥芽糊精(DE 5~7)為底物,用50 mmol/L的Na2HPO4-檸檬酸緩沖液(pH為7.0)溶解底物,加酶量分別為10、20、30、40、50 U/g,置于轉速為150 r/min、溫度為50 ℃的水浴搖床中,轉化12 h,用HPLC檢測麥芽四糖生成量。
底物濃度對酶反應的影響:分別以質量濃度為150、 200、 250、 300 g/L麥芽糊精(DE 5~7)為底物,用50 mmol/L的Na2HPO4-檸檬酸緩沖液(pH 7.0)溶解底物,加酶量30 U/g底物,置于轉速為150 r/min、溫度為50 ℃的水浴搖床中,轉化12 h,用HPLC檢測麥芽四糖生成量。
反應時間對酶反應的影響:以250 g/L麥芽糊精(DE 5~7)為底物,用50 mmol/L的Na2HPO4-檸檬酸緩沖液(pH 7.0)溶解底物,加酶量30 U/g底物,置于轉速為150 r/min、溫度為50 ℃的水浴搖床中,轉化2、4、8、12、18 h,用HPLC檢測麥芽四糖生成量。
1.2.5 HPLC檢測含量
酶反應后的樣品經過加熱20 min滅酶后,12 000 r/min 離心10 min,取上清用去離子水適當稀釋,再用乙腈共沉淀,放置2 h后,12 000 r/min離心10 min,取上清過膜備用。HPLC檢測條件是:Agilent 1 200 HPLC色譜儀,Agilent自動進樣器,色譜柱4.6 mm×250 mm×5 μm Syncronis Amino Column;Aginent示差檢測器;流動相為V(乙腈):V(水)=70∶ 30,超聲脫氣20 min,流速為0.8 mL/min;柱溫35 ℃。
2 結果與分析
2.1 搖瓶優化
枯草芽孢桿菌的發酵常用TB培養基,但在工業化大規模生產中要求培養基成分廉價且利于菌株生長和產酶。使用TB培養基發酵產麥芽四糖淀粉酶的成本較高,對此分別優化氮源種類及濃度、碳源種類及濃度。
2.1.1 重組菌TB培養基發酵
將重組菌株進行搖瓶發酵,測定粗酶液的酶活,麥芽四糖淀粉酶胞外酶的酶活為147 U/mL,破壁上清的酶活為0.6 U/mL,這表明99%的酶都分泌到了胞外,即重組菌成功表達麥芽四糖淀粉酶。
2.1.2 氮源種類及濃度優化
菌體生長及產酶需要消耗氮源來合成自身所需的營養物質,不同種類氮源的含氮量不同,選擇合適的氮源對發酵過程十分重要。酵母類氮源,例如:酵母粉、酵母浸膏等價格普遍昂貴,不適合應用于工業化的生產當中,為了降低成本,本研究不選取此類氮源。選取價格較廉價的豆粕粉、玉米漿、工業蛋白胨、大豆蛋白胨、牛蛋白胨、魚蛋白胨,探究最優的單一氮源。
由圖1可以看出只有工業蛋白胨的產酶效果略好于TB培養基,酶活力可達174 U/mL。玉米漿和豆粕粉對菌體的生長有利,兩者對應的OD600值分別為8.8和8.3。綜合考慮,選取工業蛋白胨、玉米漿、豆粕粉作為單一氮源,進一步探究氮源濃度對發酵的影響。

圖1 氮源種類對重組菌生長和發酵產酶的影響Fig.1 Effects of the different nitrogen sources on cell growth and recombinant G4-amylase activity
分別在培養基中添加15、25、35 g/L的上述氮源替代TB中的氮源,從表1中可以看出工業蛋白胨濃度為25和35 g/L時,酶活力基本一致,從降低成本的角度出發可選取25 g/L。

表1 氮源濃度對重組菌生長和發酵產酶的影響Table 1 Effects of the concentration of nitrogen sources on cell growth and recombinant G4-amylaseactivity
隨著玉米漿和豆粕粉質量濃度的增加,酶活逐漸升高,當玉米漿質量濃度為35 g/L時,酶活力可達123 U/mL,當豆粕粉質量濃度為35 g/L時,酶活力可達91 U/mL。工業蛋白胨的價格高于玉米漿,豆粕粉價格最低,可以用工業蛋白胨分別與玉米漿和豆粕粉復配,進一步探究組合氮源對發酵的影響。
以上述結果為基礎,初步考察復合氮源的不同比例,設定工業蛋白胨的質量濃度5 g/L為固定值,分別與5、15、25、35和45 g/L的玉米漿和豆粕粉復配。從圖2中可以看出,當玉米漿質量濃度為45 g/L時,酶活力為131 U/mL,低于豆粕粉質量濃度為15 g/L時的酶活力(143 U/mL),并且玉米漿價格高于豆粕粉。綜合考慮,選取豆粕粉與工業蛋白胨組合進一步考察不同配比的影響。利用正交表做2因素3水平實驗,從表2中可以看出,當工業蛋白胨質量濃度為25 g/L和豆粕粉質量濃度為25 g/L時,酶活力可高達225 U/mL。

a-豆粕粉;b-玉米漿圖2 氮源組合對重組菌生長和發酵產酶的影響Fig.2 Effects of complex nitrogen sources on cell growth and recombinant G4-amylase activity
表2 氮源組合對重組菌生長和發酵產酶的影響Table 2 Effects of complex nitrogen sources on cell growth and recombinant G4-amylase activity

氮源及質量濃度/(g·L-1)OD600酶活力/(U·mL-1)TB5.8±0.2152±3工業蛋白胨5+豆粕粉56.7±0.2115±3工業蛋白胨5+豆粕粉158.1±0.2138±3工業蛋白胨5+豆粕粉258.9±0.2158±3工業蛋白胨15+豆粕粉56.5±0.2166±3工業蛋白胨15+豆粕粉158.3±0.2181±3工業蛋白胨15+豆粕粉259.1±0.2192±3工業蛋白胨25+豆粕粉57.1±0.2191±3工業蛋白胨25+豆粕粉158.7±0.2219±3工業蛋白胨25+豆粕粉259.6±0.2225±3
2.1.3 碳源種類及濃度優化
碳源不僅可以提供菌體生長所需的細胞結構物質,更重要的是提供合成次級代謝產物所需要的碳及能量。培養基中碳源的濃度過低會導致菌體衰老和自溶,過高會抑制菌體生長及產酶。合適的碳源有利于菌體的快速吸收和利用,選取常見的碳源甘油、葡萄糖、麥芽糖、蔗糖、玉米糊精、可溶性淀粉探究最優的單一碳源。
從圖3中可以看出以麥芽糖為單一碳源時,酶活力最高可達211 U/mL,以玉米糊精或甘油為單一碳源時,酶活均為209 U/mL,考慮到工業化生產過程中的成本問題,甘油較其他2種碳源更廉價,綜合考慮,選取甘油作為單一碳源,進一步探究碳源濃度對發酵的影響。

圖3 碳源種類對重組菌生長和發酵產酶的影響Fig.3 Effects of the different carbon sources on cell growth and recombinant G4-amylase activity
分別在培養基中添加0、1、5、10、15、20、25 g/L甘油替代TB中的碳源,從圖4中可以看出當甘油濃度為5 g/L時,酶活力最高可達236 U/mL,此時OD600值為12.5。
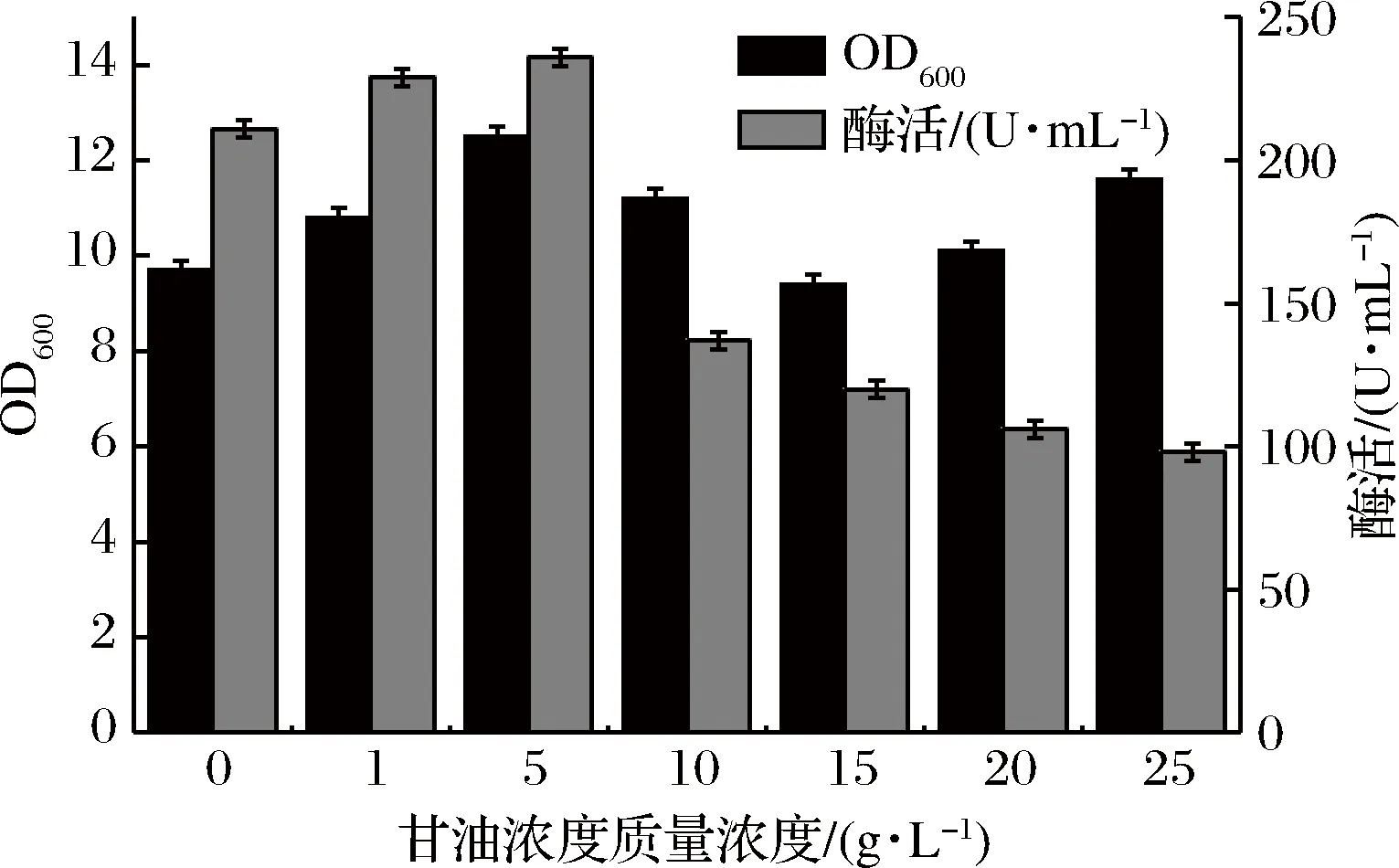
圖4 碳源濃度對重組菌生長和發酵產酶的影響Fig.4 Effects of the concentration of carbon sources on cell growth and recombinant G4-amylase activity
此后,隨著碳源濃度的增加,酶活呈下降趨勢,這是因為高濃度的碳源引起分解代謝物阻遏效應,使胞內的cAMP水平下降,不足以使分解物激活蛋白CAP的構象發生變化成為激活狀態,無法結合到啟動子上游,從而導致RNA聚合酶不能與啟動基因結合,抑制對營養物質的利用,不利于菌體生長和產酶。
2.2 麥芽四糖制備條件優化
2.2.1 反應初始pH優化
如圖5所示,酶催化生成的麥芽四糖隨著pH值的增加變化較明顯,當pH 7.0時,麥芽四糖的得率達到最大68.9%。過高的pH值會使麥芽四糖的得率下降,這是因為pH會改變酶活性中心的基團的解離狀態,從而影響酶與底物分子的結合效率,這一趨勢與酶學性質相匹配。所以,麥芽四糖淀粉酶轉化麥芽糊精過程中的最適pH值為7.0。
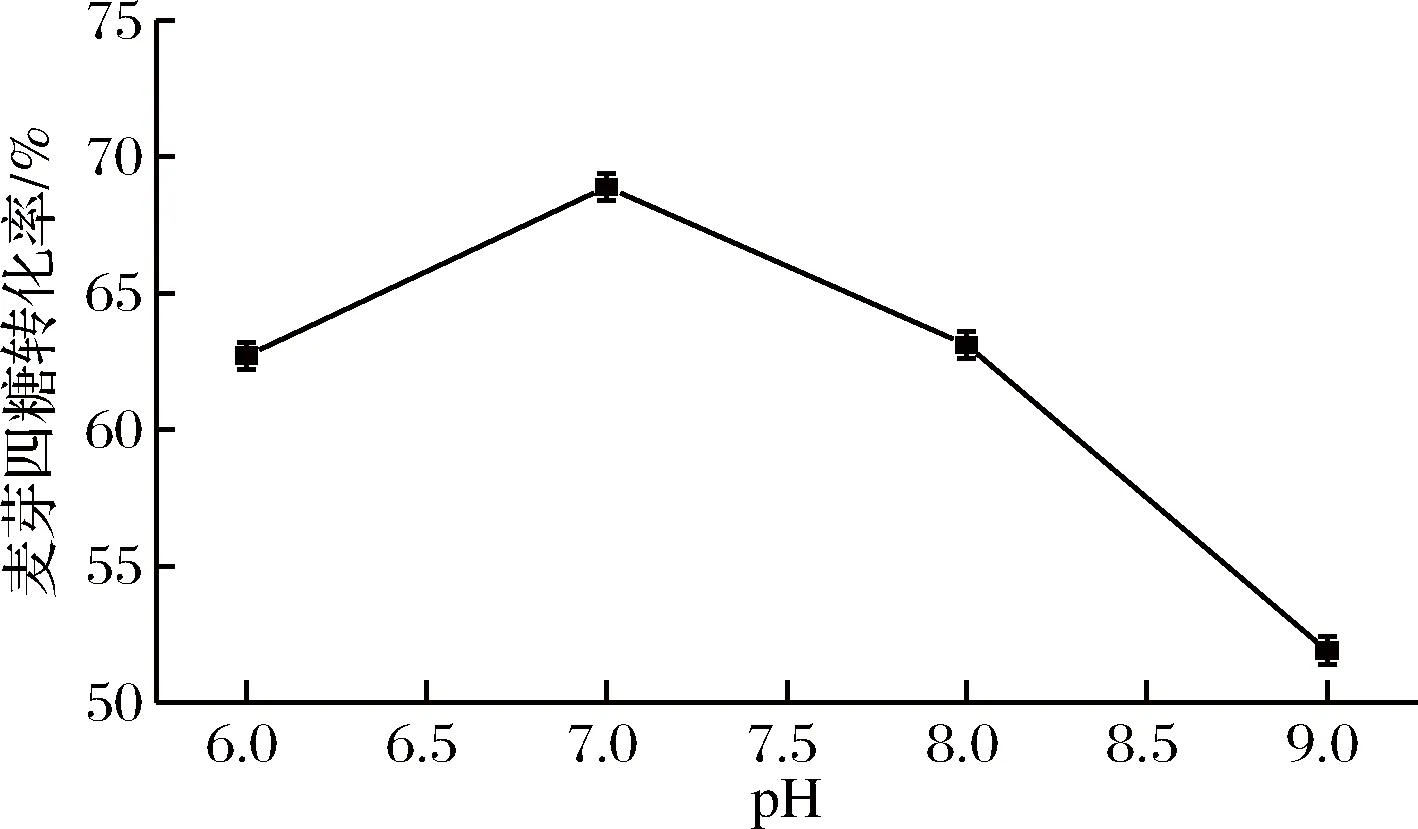
圖5 初始pH對麥芽四糖酶反應的影響Fig.5 Effect of initial pH on the enzymatic conversion
2.2.2 反應溫度優化
在上述優化的基礎上對反應溫度進行優化,如圖6所示,溫度對麥芽四糖的得率影響較大,當溫度為50 ℃時,麥芽四糖的得率達到最大69.6%。此后繼續提高溫度,麥芽四糖的得率開始下降。從前期對麥芽四糖淀粉酶酶學性質的研究可知,當溫度高于55 ℃ 時,該酶的熱穩定性逐漸變差。由于高溫使酶的穩定性變差,因而半衰期縮短,催化效率降低,從而麥芽四糖的得率下降。所以,麥芽四糖淀粉酶轉化麥芽糊精過程中的最適溫度為50 ℃。

圖6 溫度對麥芽四糖酶反應的影響Fig.6 Effect of temperature on the enzymatic conversion
2.2.3 加酶量優化
在上述優化的基礎上對反應所需加酶量進行優化,如圖7所示,麥芽四糖的產量隨著加酶量的增加而升高,當加酶量為30 U/g時,麥芽四糖的得率達到最大69.7%。此后繼續提高加酶量,麥芽四糖的得率略有下降。這是因為,加酶量的增加使底物有更多的機會與酶分子結合從而提高得率,當加酶量達到一定值后,酶與底物的結合達到飽和狀態,再提高加酶量也不會有多余的底物與酶分子結合,反而會使酶團聚在一起從而降低得率。所以,麥芽四糖淀粉酶轉化麥芽糊精過程中的最適加酶量為30 U/g。

圖7 加酶量對麥芽四糖酶反應的影響Fig.7 Effect of enzyme dosage on the enzymatic conversion
2.2.4 底物濃度優化
在上述優化的基礎上對反應的底物濃度進行優化,高底物濃度有利于大規模工業化生產,如圖8所示,當底物質量濃度為250 g/L時,麥芽四糖的得率達到最大73%。濃度過高時,麥芽四糖的得率下降明顯。這可能是因為底物濃度增加到最大后,所有的酶分子都與底物結合,處于飽和狀態,再提高底物濃度反而會使糊精分子相互聚集,減少底物與酶分子的接觸從而降低得率。同時,底物濃度過高也會使底物抑制作用明顯。所以,麥芽四糖淀粉酶轉化麥芽糊精過程中的最適底物質量濃度為250 g/L。

圖8 底物濃度對麥芽四糖酶反應的影響Fig.8 Effect of substrates concentration on the enzymatic conversion
2.2.5 反應時間優化
在上述優化的基礎上對反應的時間進行優化,如圖9所示,在酶反應12 h時麥芽四糖的得率達到最大值73%,12 h后得率開始下降。酶反應過程中,起始的2 h內酶催化反應速率是整個反應過程中的最大值。在2 h到12 h內,催化反應速率逐漸減小。因此,麥芽四糖淀粉酶轉化麥芽糊精合成麥芽四糖的最適反應時間為12 h。

圖9 反應時間對麥芽四糖酶反應的影響Fig.9 Effect of transform time on the enzymatic conversion
3 討論
在前期獲得了能夠分泌表達麥芽四糖淀粉酶的重組枯草芽孢桿菌菌株的基礎上,本實驗初步試驗表明重組菌發酵上清液中麥芽四糖淀粉酶的酶活力可達147 U/mL。之后進一步探討了重組菌在搖瓶中產酶的最適培養基,當使用豆粕粉和工業蛋白胨為氮源,甘油為碳源時,麥芽四糖淀粉酶的酶活力最高可達236 U/mL。利用廉價的培養基獲得了相對較高的酶活,比Pseudomonassp.IMD 353來源的該酶的最高產酶水平13 U/mL[5]高18倍,比培養基優化前的酶活高約1倍。采用該麥芽四糖淀粉酶探究了酶法生產麥芽四糖的工藝條件,結果表明,反應pH值為7.0,溫度為50 ℃,加酶量為30 U/g底物,底物麥芽糊精質量濃度為250 g/L,轉化時間12 h,麥芽四糖的轉化率可達73.2%,比目前已有報道的最高水平54%[19]高19%,為工業化生產麥芽四糖提供了研究基礎。
本研究使用經過載體和宿主菌改造而得到的高表達重組菌,完成了其在搖瓶中的優化及在制備麥芽四糖中的應用。重組菌高密度發酵的培養基及發酵條件有待優化,提高酶活的同時降低發酵成本,以實現麥芽四糖淀粉酶的大規模工業化生產。

