MST4表達對MHCC97H肝癌細胞細胞因子、ERK蛋白、p-ERK蛋白表達的影響及其意義
趙小麗,高 鵬,劉俊華,周鳳蕊,王佳樂,李廣明
(鄭州市第六人民醫院肝病五科,鄭州450000)
肝癌在我國惡性腫瘤的發病率中居于高位,盡管目前臨床具有放療、化療及手術等多種有效方法,但由于原發性肝癌早期臨床癥狀較為隱匿,確診時患者多存在肝癌細胞轉移并多處于晚期,手術治療的效果顯著降低,而由于放療、化療較大的毒副作用在臨床使用受限[1]。因此,探尋肝癌的侵襲、轉移機制對制訂有效的治療方案具有重要意義。研究[2-3]提示絲氨酸/蘇氨酸蛋白激酶4/(mammalian Ste20-like kinase 4,MST4)對肝癌的預后不良具有提示作用并可加速腫瘤細胞的侵襲、生長及轉移,還可調節炎性細胞因子而介導肝癌的轉移和侵襲,而肝癌細胞上皮間質(epithelial mesechymal transitional,EMT)轉化可被MST4激活,進而增加肝癌嚴重程度[4]。因此,本研究深入探討了MHCC97H肝癌細胞中MST4的表達與癌細胞增殖、侵襲遷移的關系,旨在為肝癌的轉移、侵襲機制提供新的思路。
1 材料與方法
1.1 MHCC97H肝癌細胞系 MHCC97H肝癌細胞系購買于復旦大學醫學院基礎醫學院教研室;實驗所用質粒均由南京建成生物研究所提供。
1.2 實驗藥品、儀器 胎牛血清及DMEM培養液購于美國 Hyclone 公司;MST4(1:500)、EDTA 消化液(0.02%)及胰蛋白酶(0.25%)購于美國Proteintech公司;Western blot試劑盒及細胞核蛋白、總蛋白試劑盒購于 Millipore公司;白細胞介素-2(IL-6)、白細胞介素-1β(IL-1β)、腫瘤壞死因子-α(TNF-α)、趨化因子-2(CCL2)ELISA試劑盒及Transwell小室試劑盒均購于南京建成生物研究所;大鼠ERK及大鼠抗人磷酸化ERK多克隆抗體均購于美國上海康城生物公司;辣根過氧化物酶標記羊抗大鼠IgG美國BD公司;酶標儀購于美國GE公司。
1.3 實驗方法 胎牛血清(10%)高糖DMEN于5%CO2及37℃條件培養箱傳代培養,3 d傳代1次;將MHCC97H肝癌細胞培養至對數生長期后,接種于96孔板上培養,分為空白組、高表達組(MST4轉染高表達)、低表達組(MST4轉染siRNA)。
1.4 指標檢測方法 采用ELISA法檢測各組培養24h后上清液中白細胞介素-2(IL-6)、白細胞介素-1β(IL-1β)、腫瘤壞死因子-α(TNF-α)、趨化因子-2(CCL2)。
采用Western-blot法檢測各組的ERK、p-ERK的表達情況,提取總蛋白后,取20 g總蛋白行SDSPAGE電泳,常規轉膜后5%脫脂奶粉2 h室溫封閉,分別加入大鼠ERK及大鼠抗人磷酸化ERK一抗,次日常規洗膜后加入辣根過氧化物酶標記羊抗大鼠IgG,室溫1 h孵育,暗室曝光顯色。
采用MTT實驗檢測3組腫瘤細胞的增殖能力。取對數生長期MHCC97H肝癌細胞,接種于96孔板,每孔約2 000個,每組設5個平行孔,5%CO2、37℃條件培養箱培養,細胞貼壁后每孔加入5 g/L MTT 10 μL,37℃4 h孵育,棄除上清培養基后每孔加150 μL DMSO,振蕩后酶標儀(492 nm波長)檢測吸光度。
采用Transwell實驗檢測各組細胞的侵襲遷移能力。轉染的MHCC97H肝癌細胞48 h培養后消化,取1×105個細胞于滅菌EP管(1.5 mL),細胞重懸后具體操作依據Transwell小室試劑盒說明書,24 h常規培養后取出小室,乙醇(95%)固定,結晶紫染色后取5個視野200倍顯微鏡下觀察侵襲情況并計數。
1.5 統計學方法 統計軟件采用SPSS16.0版本,數據表述采用±s表示,數據統計分析采用單因素方差分析法,組間比較采用LSD-t檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 3組細胞MST4蛋白表達比較 高表達組的MST4蛋白表達顯著高于空白組和低表達組(P<0.05);空白組和低表達組的MST4蛋白表達水平差異無統計學意義(P>0.05,表1)。
表1 3組細胞的MST4蛋白表達水平比較(±s,相對表達強度)Tab 1 Comparison of MST4 protein expression levels in cells of 3 groups of patients(±s,relative expression intensity)

表1 3組細胞的MST4蛋白表達水平比較(±s,相對表達強度)Tab 1 Comparison of MST4 protein expression levels in cells of 3 groups of patients(±s,relative expression intensity)
與高表達比較*P<0.05
組別I L-6/(p g/m L)F P空白組 0.1 0 9±0.0 5 3* 5 1.3 9 2 0.0 0 0高表達組 0.7 7 8±0.1 8 0低表達組 0.1 1 7±0.0 5 9*
2.2 3組細胞的上清液中細胞因子水平比較 高表達組的上清液中 IL-6、IL-1β、TNF-α、CCL2 水平均顯著高于空白組和低表達組(P<0.05);空白組和低表達組的上清液中 IL-6、IL-1β、TNF-α、CCL2 水平差異無統計學意義(P>0.05,表 2)。
表2 3組細胞的上清液中細胞因子水平比較(±s)Tab 2 Comparison of cytokine levels in the supernatant of three groups of cells(±s)
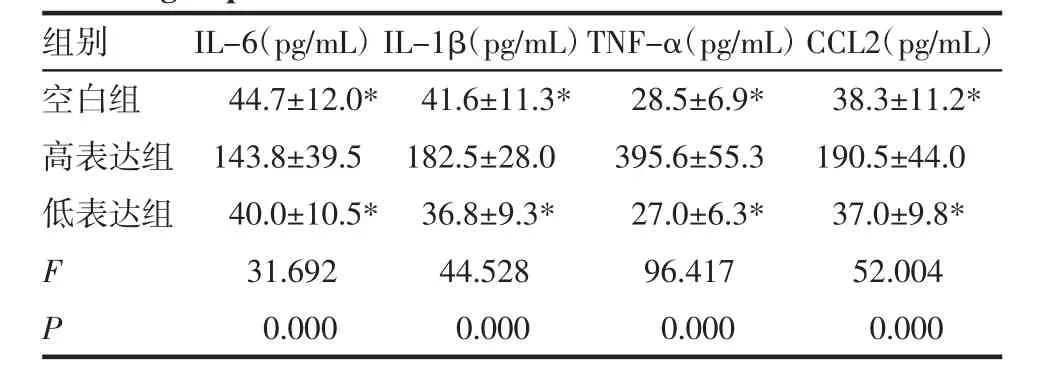
表2 3組細胞的上清液中細胞因子水平比較(±s)Tab 2 Comparison of cytokine levels in the supernatant of three groups of cells(±s)
與高表達比較*P<0.05
組別 I L-6(p g/m L)I L-1 β(p g/m L)T N F-α(p g/m L)C C L 2(p g/m L)空白組 4 4.7±1 2.0* 4 1.6±1 1.3* 2 8.5±6.9* 3 8.3±1 1.2*高表達組 1 4 3.8±3 9.5 1 8 2.5±2 8.0 3 9 5.6±5 5.3 1 9 0.5±4 4.0低表達組 4 0.0±1 0.5* 3 6.8±9.3* 2 7.0±6.3* 3 7.0±9.8*F 3 1.6 9 2 4 4.5 2 8 9 6.4 1 7 5 2.0 0 4 P 0.0 0 0 0.0 0 0 0.0 0 0 0.0 0 0
2.2 3組細胞中的ERK、p-ERK蛋白表達情況 空白組、高表達組和低表達組的ERK蛋白表達差異無統計學意義(P>0.05);高表達組的p-ERK蛋白顯著高于空白組和低表達組(P<0.05),空白組和低表達組的p-ERK蛋白表達差異無統計學意義(P>0.05,表 3,圖 1)。
表3 3組細胞的中ERK、p-ERK蛋白表達情況(±s)Tab 3 Expression of medium ERK,P-ERK protein in three groups of cells(±s)
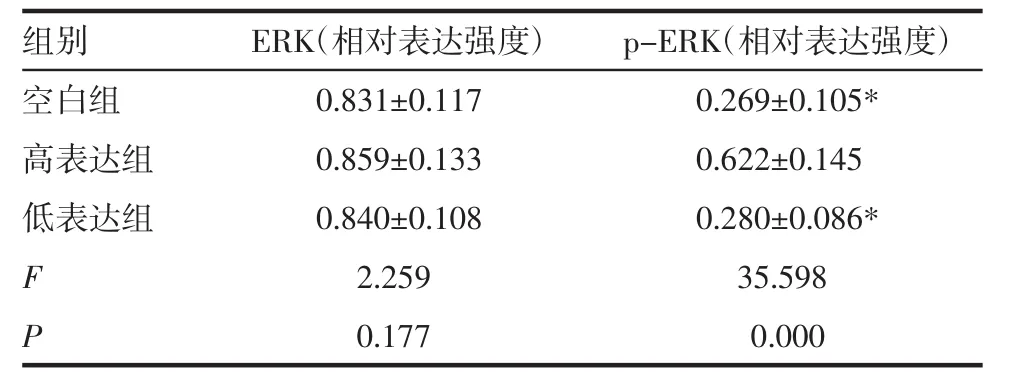
表3 3組細胞的中ERK、p-ERK蛋白表達情況(±s)Tab 3 Expression of medium ERK,P-ERK protein in three groups of cells(±s)
與高表達比較*P<0.05
組別 E R K(相對表達強度) p-E R K(相對表達強度)空白組 0.8 3 1±0.1 1 7 0.2 6 9±0.1 0 5*高表達組 0.8 5 9±0.1 3 3 0.6 2 2±0.1 4 5低表達組 0.8 4 0±0.1 0 8 0.2 8 0±0.0 8 6*F 2.2 5 9 3 5.5 9 8 P 0.1 7 7 0.0 0 0

圖1 Western-blot法檢測結果Fig 1 Detection result Western-blot
2.3 3組細胞的MTT實驗檢測結果 高表達組的MTT實驗吸光度值高于空白組和低表達組(P<0.05);空白組和低表達組的MTT實驗吸光度值差異無統計學意義(P>0.05,表 4)。
表4 3組細胞的MTT實驗檢測結果(±s)Tab 4 Results of MTT assay in three groups of cells(±s)

表4 3組細胞的MTT實驗檢測結果(±s)Tab 4 Results of MTT assay in three groups of cells(±s)
與高表達比較*P<0.05
組別 M H C C 9 7 H肝癌細胞(吸光度值) F P空白組 0.2 0 6±0.0 7 7* 2 5.8 2 6 0.0 0 0高表達組 0.3 7 5±0.0 8 3低表達組 0.2 1 4±0.0 6 9*
2.4 3組細胞的Transwell實驗檢測結果 高表達組的Transwell實驗MHCC97H肝癌細胞遷移數目高于空白組和低表達組(P<0.05);空白組和低表達組的Transwell實驗MHCC97H肝癌細胞遷移數目差異無統計學意義(P>0.05,表 5)。
表5 3組細胞的Transwell實驗檢測結果(±s)Tab 5 Transwell test resules of three groups of cell(±s)

表5 3組細胞的Transwell實驗檢測結果(±s)Tab 5 Transwell test resules of three groups of cell(±s)
與高表達比較*P<0.05
組別 M H C C 9 7 H肝癌細胞(細胞數) F P空白組 8 8.3±1 4.6* 3 5.1 7 4 0.0 0 0高表達組 3 0 8.6±4 7.2低表達組 9 2.0±1 8.6*
3 討論
肝癌是指起源于肝間葉組織和肝臟上皮細胞的惡性腫瘤,肝癌患者早期臨床癥狀多隱匿,被診斷時已多為晚期并伴有乏力、消瘦、肝區疼痛及肝大等臨床癥狀,臨床治療困難[5-6]。此外,肝癌細胞極易出現轉移、浸潤,這給肝癌的根治造成了嚴重障礙。因此,研究肝癌癌細胞侵襲、轉移的相關機制并探尋靈敏、準確抑制肝癌轉移的治療靶點及方法對改善和提高肝癌患者預后意義顯著。
MST4屬于機體的重要激酶,可參與細胞骨架的形態形成、重排、細胞分化及凋亡等多種細胞活動,可促進細胞的轉化及生長[7-8]。高表達組的MST4蛋白表達顯著高于空白組和低表達組;空白組和低表達組的MST4蛋白表達水平差異無統計學意義。文獻[9-10]提示前列腺及乳腺癌患者腫瘤的惡性程度及侵襲性與MST4的高表達具有高度相關性,這也與本研究結果一致。
研究[11-12]證實腫瘤的轉移及侵襲過程與炎癥因子具有密切聯系,炎癥因子可激活腫瘤細胞及炎癥細胞,對抑制免疫介導的腫瘤監視作用顯著。IL-6、IL-1β、TNF-α、CCL2 均為重要的促癌炎癥因子,認為上述炎癥因子的分泌失調可促進肝癌的早期發生及進展[13]。本研究結果顯示,高表達組的上清液中IL-6、IL-1β、TNF-α、CCL2 水平均顯著高于空白組和低表達組;而空白組和低表達組的上清液中IL-6、IL-1β、TNF-α、CCL2水平差異無統計學意義。上述結果提示,肝癌細胞存在較高的炎癥因子水平,可能促進肝癌細胞的增殖、轉移及侵襲。動物實驗[14]證實,肝癌模型小鼠機體IL-1β及TNF-α表達水平明顯升高,這也與本研究結果相符。炎癥因子由免疫細胞和某些非免疫細胞產生和分泌,具有免疫調節作用,參與細胞生長、分化、修復和免疫過程。而慢性病大多為炎癥因子參與的病理生理過程,腫瘤的發生均是由于一個長期的慢性炎癥刺激而導致的。故而,MST4可能是通過調控IL-6、IL-1β、TNF-α、CCL2等炎癥因子的分泌而影響腫瘤組織的病理發展。
本研究結果顯示,空白組、高表達組和低表達組的ERK蛋白表達差異無統計學意義;高表達組的p-ERK蛋白顯著高于空白組和低表達組;空白組和低表達組的p-ERK蛋白差異無統計學意義。上述結果提示,MHCC97H肝癌細胞中MST4高表達,將會激活p-ERK蛋白表達,從而提高細胞因子的表達,促進肝癌細胞的增殖和侵襲。MST4可通過MAPK通路的激活誘導EMT肝癌細胞轉化,對肝癌的預后不良具有顯著的提示作用。ERK屬于MAPK家族最重要的蛋白激酶,其磷酸化后形成p-ERK才能成為具有活性的蛋白激酶,進而調節包括細胞分化、增殖、衰老及凋亡等多種細胞調節作用,并調節炎癥因子的分泌及產生[15]。
增殖及侵襲實驗結果顯示,高表達組的MTT實驗吸光度值、Transwell實驗MHCC97H肝癌細胞遷移數目高于空白組和低表達組;空白組和低表達組的MTT實驗吸光度值、Transwell實驗MHCC97H肝癌細胞遷移數目差異無統計學意義。上述結果證實MHCC97H肝癌細胞中MST4高表達與癌細胞的遷移具有密切聯系,與上述研究結果一致。
綜上所述,MHCC97H肝癌細胞中MST4高表達,將會激活p-ERK蛋白表達,從而提高細胞因子的表達,提高MHCC97H肝癌細胞的增殖和侵襲能力。

