鋅指蛋白A20在過敏性哮喘中的研究進展
袁為遠,包凱帆,賈志榮,王曉鈺,鄭 劼,洪 敏,江國榮
(1.南京中醫藥大學藥學院,科技部國家規范化中藥藥理實驗室,江蘇省中藥藥效與安全性評價重點實驗室,江蘇 南京 210023;2.南京中醫藥大學醫學與生命科學學院藥理系,江蘇 南京 210023;3.南京中醫藥大學附屬蘇州市中醫醫院蘇州市吳門醫派研究院,江蘇 蘇州 215003)
過敏性反應是機體受到過敏原,如花粉、屋塵螨(house dust mite, HDM)等誘導后,引起的病理性組織損傷或者功能紊亂的一種免疫反應。過敏性疾病主要包括過敏性哮喘、過敏性皮炎、過敏性鼻炎等,其中患病率及復發率最高的為過敏性哮喘。據Global Burden of Disease Study資料顯示,全球約有2.4億過敏性哮喘患者,預計到2025年將達到3億,并且有研究顯示,該數值近年內將持續上升[1]。過敏性哮喘是一種變應原或其他因素引起的肺功能失常[2],以適應性的2型輔助性T細胞(type 2 T helper cell, Th2)功能異常為主要特征的2型免疫反應。發病時,主要伴隨著Th2型細胞因子白介素(interleukin, IL)-4、IL-5、IL-13的產生,表現為嗜酸性粒細胞(eosinophils, EOS)增多、黏液分泌旺盛、氣道高反應性,以及E型免疫球蛋白(immunoglobulin E, IgE)的表達增加。過敏性哮喘的病因及發病機制十分復雜[3],目前尚未被完全了解,因此,進一步研究過敏性哮喘的發病機制,并建立有效的干預或治療手段,對于降低其發病率、復發率尤為重要。
20世紀末,美國學者Dixit等[4]通過實驗,首次發現了鋅指蛋白A20,因其最初是由腫瘤壞死因子α(tumor necrosis factor α, TNF-α)誘導內皮細胞產生的,所以又被稱為腫瘤壞死因子α誘導蛋白3(tumor necrosis factor alpha-induced protein 3, TNFAIP3)。隨著對于A20的深入研究,目前它被認為是炎癥信號通路的關鍵調控因子,主要是核轉錄因子κB(nuclear factor κB, NF-κB)的一種負調控因子,可以通過多種途徑抑制NF-κB的活化。目前已有若干報道證實,A20參與了過敏性疾病的發生和發展[5-6],其在過敏性哮喘的發病機制中的重要作用也越來越被重視。因此,對A20與過敏性哮喘的最新研究進展進行綜述,有利于為過敏性哮喘的預防和治療提供新思路。
1 A20的起源與結構
鋅指蛋白A20,根據其cDNA克隆數而命名,是一種具有高度生物活性的胞質蛋白質。研究發現,人類的A20基因序列定位于染色體中6q23.3位,其cDNA全長為4 426 bp,發揮轉錄活性作用的可讀區域框為2 370 bp(67~2 436 bp)。人的A20蛋白總共由790個氨基酸組成,蛋白分子質量為90 ku。進一步對其蛋白結構分析可知,A20屬于去泛素化酶(deubiquitinating enzymes, DUBS)卵巢腫瘤(ovarian tumor, OTU)家族的一種,其N末端區(1~385)含有的半胱氨酸蛋白酶類OTU是A20蛋白的特征性結構區域之一[7]。同時,A20蛋白也具有泛素化功能,A20蛋白的鋅指結構區在其C末端(386~775),該鋅指區域由7個Cys2-Cys2結構組成[8],其中第4個結構區具有E3泛素連接酶活性,可特異性地與底物結合,招募26S蛋白酶體,將靶蛋白降解。正是因為這兩種特殊的蛋白結構(Fig 1),A20蛋白具有了泛素化和去泛素化雙重功能,在炎癥調節中起著重要作用。
2 A20的生物學功能
A20是一種具有高度保守性的、胞質誘導表達性蛋白,其在上皮細胞、T淋巴細胞、B淋巴細胞、樹突狀細胞等中均有表達。已有研究表明,A20作為NF-κB的負調控因子,在多種炎癥性反應中扮演著重要的角色。A20蛋白可在多種促炎因子,如細菌脂多糖(lipopolysaccharides, LPS)、TNF-α、IL-1等刺激細胞后大量表達,其中,A20基因3’端非翻譯區含有的4個“ATTTA”序列,是A20蛋白快速表達的基礎。盡管目前廣泛認為A20是一種存在于細胞質中的抗炎蛋白,但最初研究發現其是一種能夠保護由TNF-α誘導細胞毒性的蛋白質。進一步研究發現,A20可以通過不同途徑,抑制TNF-α誘導的NF-κB的活化,除此之外,還可以抑制由CD40、IL-1,以及包括模式識別受體(pattern recognition receptor, PRR)等在內誘導的NF-κB的活化,并且還可以抑制T細胞和B細胞抗原受體的激活[8]。A20在多種炎癥反應中起著重要作用,特異性敲除小鼠體內A20基因不久后,小鼠體內多種器官即可產生炎癥反應,并且缺失A20蛋白的細胞無法阻斷由刺激因子誘導的NF-κB的活化。除此之外,近年來A20還被報道能調節其他細胞信號轉導通路,如Wnt通路、干擾素調節因子(interferon regulatory factor, IRF)、自噬應答等途徑。研究發現,A20還可以通過直接結合白細胞介素17受體A(interleukin-17 receptor type A, IL-17RA)的C末端結構域,來抑制IL-17信號轉導,并且A20可以抑制TNFR、IL-1R和NOD樣受體(NOD like receptors, NLR)信號通路,但是A20是否直接與這些受體結合,尚待考證。
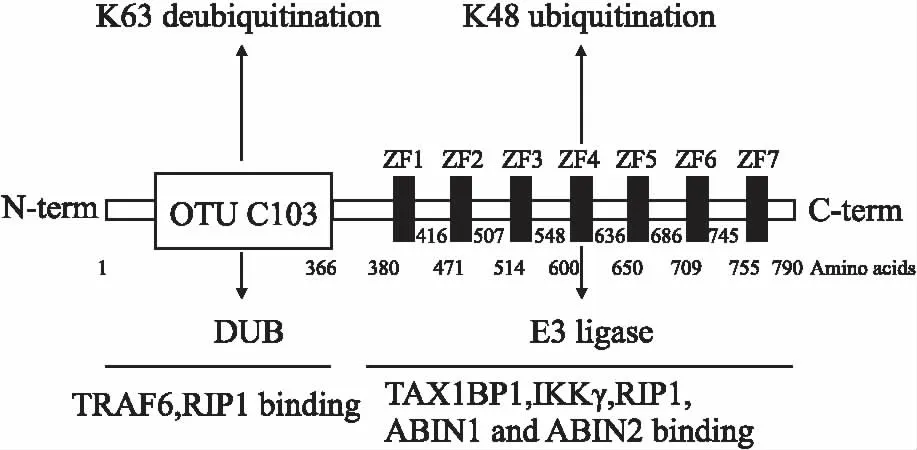
Fig 1 Biochemical characteristics of A20 protein
TNF受體1(TNF receptor 1, TNFR1)能夠激活NF-κB活化的信號轉導途徑,A20被認為能通過調節該通路而成為炎癥性疾病的潛在治療靶點(Fig 2)。眾所周知,蛋白質泛素化是生物體內的一種重要調節方式。該過程通過對靶蛋白進行一系列的特異性修飾后,即可招募26S蛋白酶體,將靶蛋白降解,其中起蛋白質降解標簽作用的為K48多聚泛素蛋白鏈。除此之外,蛋白質的泛素化也可以進行信號轉導,這主要依賴于K63多聚泛素蛋白鏈的作用,其可以被特異性的調控因子識別,啟動相應信號[9]。A20被普遍認為是一種NF-κB信號的經典負調控因子,且已有文獻證明,A20是一種泛素編輯酶復合體,同時具有E3泛素連接酶和DUB去泛素化酶活性。目前認為,A20抑制NF-κB信號的機制一方面是因其蛋白N末端的OTU結構域[7],而受體相互作用蛋白激酶1(receptor interacts with the protein kinase 1, RIP1)、腫瘤壞死因子受體相關因子6(tumor necrosis factor receptor- associated factor 6, TRAF6)和NF-κB必需調節蛋白(NF-κB- essential modulator, NEMO)等為OTU結構域的結合底物[10-12],并且RIP1、TRAF6、NEMO等被激活后,均能募集泛素蛋白聚合,形成K63多聚泛素化鏈。因此,A20能夠特異性地趨向K63鏈,破壞其多聚泛素化鏈完整性,從而阻斷相關信號的轉導[10]。除了去泛素化活性之外,A20蛋白第4個鋅指結構區域ZF4所具有的泛素連接酶功能,也參與NF-κB的抑制作用。A20的E3泛素連接酶活性能促進RIP1募集以lys48位點連接為主的泛素蛋白的多聚化,也就是可以促進靶蛋白附著K48多聚泛素化鏈,從而招募26S蛋白酶體降解RIP1,阻斷下游的信號轉導。除此之外,研究還發現,A20可以通過去泛素化黏膜相關淋巴組織淋巴瘤易位蛋白1(mucosa-associated lymphoid tissue lymphoma translocation protein 1, MALT1),負調控由T細胞受體(T cell receptor, TCR)誘導的NF-κB的活化。在淋巴細胞中,TRAF6對MALT1的泛素化也是NF-κB活化所必需的[13]。A20的生物學功能依賴于其蛋白結構基礎,隨著研究的發展,A20蛋白的更多功能也將會被發現。
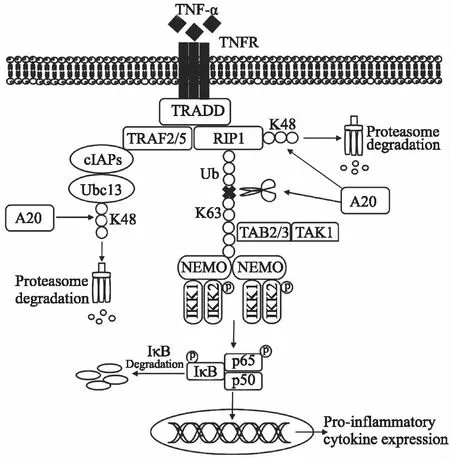
Fig 2 A20 protein function in tumor necrosis factor receptor (TNFR)- induced NF-κB inhibition
3 A20與過敏性哮喘
過敏性哮喘是兒童和成人中最常見的慢性非傳染性疾病之一,其特征是以呼吸道癥狀多變、氣流受限為主。過敏性哮喘異質性強,是由環境和基因相互作用的結果,發病后出現嚴重的氣道炎癥和氣道重塑[3]。目前,過敏性哮喘的治療目標主要是實現對其良好的控制,盡量緩解過敏性哮喘癥狀,以及降低疾病復發幾率。抗炎以及支氣管擴張藥物的使用是治療過敏性哮喘的主要手段,盡管這些手段廣泛應用于臨床,但仍難以緩解惡性哮喘的發病癥狀,也無法防止哮喘的復發。目前,全球有很多機構都在研究過敏性哮喘,但其發病機制仍不明確。A20作為NF-κB的負調控因子,能夠有效調節炎癥反應,在過敏性哮喘中的研究也逐漸受到了重視。
目前,主要用于治療過敏性哮喘的為糖皮質激素(glucocorticoid, GC)類藥物,可以有效緩解氣道炎癥以及哮喘癥狀。GC既可以促進抗炎因子分泌,又可抑制許多促炎因子的表達[14]。糖皮質激素受體(glucocorticoid receptor, GR)是一種存在于細胞質中的轉錄因子,通過與GC特異性結合后轉入到細胞核,參與相關基因調控。GC的治療作用與A20的表達有關,Altonsy等[5]研究發現,特異性敲除A20后能明顯增加人支氣管上皮細胞分泌TNF-α,并且長效β2受體激動劑(longacting β2-adrenoceptor agonists, LABAs)能通過增加A20的表達,負調控NF-κB的活化,進而提高吸入性GC的抗炎作用。GC的抗炎作用還可通過與GR結合,促進抗炎因子A20和NFBIA基因、蛋白的表達[15]。
A20功能紊亂能夠引起包括哮喘等多種免疫性疾病,但也有研究證明,A20可以限制過敏性氣道炎癥和耐受反應[6]。研究發現,A20參與了低劑量LPS誘導的免疫耐受。持續給予小鼠低劑量LPS,能夠增強HDM誘導的哮喘小鼠的耐受性,支氣管肺泡灌洗液(bronchoalveolar lavage fluid, BALF)和肺組織勻漿中IL-4、IL-5、IL-13的表達明顯減少。而特異性敲除小鼠上皮細胞A20基因(Tnfaip3EC-KO)后,可明顯影響LPS誘導的免疫耐受、過敏性哮喘模型外周血中嗜酸性粒細胞數目,以及BALF和肺組織勻漿中IL-4、IL-5、IL-13表達均明顯增加[6]。Tan等[16]發現,滅活的銅綠假單胞菌藥劑能夠通過降低Act1,以及增加TLR4、A20的表達,來抑制卵清蛋白(ovalbumin, OVA)引起的過敏性氣道炎癥。此外,A20也參與了鋅對哮喘的調控機制。Morgan等[17]發現,短期鋅處理組并未改變A20和TRAF6水平,但是導致了RIP1(IKK上游一種重要的激活因子)的降解。為進一步確定鋅作為哮喘治療劑的應用效果,隨后建立過敏性氣道炎癥模型,給予鋅治療,結果表明鋅補充劑能夠通過調節A20活性而抑制NF-κB的表達,同時,補鋅后可以降低氣道高反應性和血清中IgE水平,但對Th2型細胞因子表達無影響。因此,補充鋅可能是治療哮喘的一種潛在方法,并且主要是通過調控A20的表達而實現的。
過敏性哮喘的發生伴隨著大量Th2型細胞因子IL-4、IL-5、IL13的表達,在哮喘發病的初始階段,2型固有淋巴細胞(type 2 innate lymphoid cell, ILC2)是經典的,除了2型輔助性T細胞以外的Th2型細胞因子的主要來源之一。哮喘患者BALF和唾液中能夠檢測到大量ILC2的存在[18],并且ILC2已被報道在炎癥反應、組織修復以及代謝平衡中十分重要,因此,ILC2與過敏性哮喘關系密切。與此同時,miRNAs作為調控基因表達的重要因子,在過敏性哮喘的研究中也逐漸受到重視[19]。研究發現,miR-19a能夠通過抑制ILC2中A20和SOCS1蛋白、基因的表達,從而促進IL-4、IL-5、IL-13的分泌[20]。在外源OVA誘導產生的小鼠過敏性肺部炎癥模型中,當體內轉染入含有A20 cDNA(Ad-A20)的腺病毒后,能夠明顯減少氣道炎癥性細胞的募集,減輕氣道高反應性及支氣管炎癥的發生,并且Ad-A20的保護性作用是通過抑制NF-κB信號轉導途徑實現的。HDM誘導的過敏性哮喘小鼠肺勻漿中A20(通過調節關鍵信號蛋白TRAF6的泛素化來抑制TLR反應)、IRAKM(結合MyD88和TRAF6,可以阻斷TLR作用,穩定信號復合物)、Tollip(與IL-1R、TLR2和TLR4相互作用以防止細胞激活,并抑制IRAK自磷酸化)均有明顯增加[21]。且有報道表明,哮喘組中肺組織TGF-β1和CTCF mRNA水平與正常組相比明顯上升,而體內給予外源性A20重組蛋白后明顯下降,提示外源性A20對于氣道上皮增生、平滑肌增殖的抑制作用與降低TGF-β1、CTCF的表達有關。
總之,目前A20均被視為一種抗炎蛋白,可以有效抑制各種炎癥信號通路轉導。除了傳統的一些炎癥信號外,近年來也發現了A20的一些新的調控因素。NLRP3作為一種炎癥小體,參與了多種疾病的發生,哮喘患者體內能夠檢測到NLRP3的高表達,并且HDM誘導的小鼠過敏性哮喘模型中能夠激活NLRP3炎癥小體的組裝。A20是TNF-α誘導的NF-κB信號激活通路的有效抑制劑,A20的缺失能夠導致IL-1β的表達增加[22],并且A20可以抑制NLRP3炎癥小體的激活[23],說明A20可以通過調控NLRP3的表達,緩解過敏性哮喘的炎癥狀態。此外,A20還可以調控一些轉錄因子的表達。JAK-STAT是一種經典的信號通路,膜受體活化后,能夠引起JAKs的磷酸化,隨后募集STATs,通過Src同源體2(Src homology 2, SH2)結構域與受體結合,經過JAKs信號傳遞引起STATs的磷酸化,進一步形成STATs二聚體,進入核內與DNA啟動子結合,啟動靶基因轉錄。JAK-STAT通路參與了Th2細胞的分化,并且IL-4、IL-13與其受體IL-4Rα、IL-13Rα結合后,也可激活JAK-STAT通路。De Wilde等[24]發現,小鼠體內特異性敲除A20基因后,IRF4、STAT1的表達明顯增加。Lee等[25]研究表明,小鼠體內過表達A20蛋白后,可以明顯改善小鼠潰瘍性結腸炎的炎癥表現,并且過表達A20后,轉錄因子p-p65和p-STAT3的表達均明顯減少。因此,A20可通過多種途徑調控哮喘的發生。隨著研究的進一步發展,A20更多的調控功能也將會被發現,其可能成為治療過敏性哮喘的一個潛在新靶點。
4 小結
越來越多的結果顯示,A20在過敏性哮喘中扮演著重要的作用,參與了多種過敏性疾病的發生、發展。目前普遍認為A20主要是NF-κB的一種負調控因子,在參與過敏性哮喘發生的支氣管上皮細胞及免疫細胞(如Th2細胞、ILC2等)中的研究較為廣泛,但其具體調控機制仍不清楚。體內特異性敲除A20后,能夠加重過敏性哮喘發病癥狀,給予重組A20能夠明顯緩解炎癥反應,這些反應主要是依賴于A20蛋白與RIP1、NEMO、TRAF6等特異性結合后,發揮泛素化和去泛素化雙重功能,起到信號抑制作用。除此之外,也有最新研究發現,A20可以調控IRF4、STAT3、STAT6等轉錄因子的表達,以及NLRP3炎癥小體的組裝,但是具體方式仍不清楚,提示A20可能存在多種負調控機制,并且其可能是治療哮喘的潛在靶點。過敏性哮喘發病機制復雜,其多復發性成為世界性的難題,因此,對A20進行基因解析、蛋白質結構分析及調控機制探討,對于過敏性哮喘的預防和治療具有重大意義。

