‘泡桐1201’幼苗對鈉鹽脅迫的生理響應
朱秀紅,王美紅,孫喜營,楊金橘,茹廣欣
(河南農(nóng)業(yè)大學,鄭州 450002)
目前,城鎮(zhèn)化的擴張、工業(yè)化的建設造成環(huán)境土地壓力越來越大,人們越來越重視鹽堿地的改造和利用,積極解決土壤鹽漬化的環(huán)境問題[1]。中國有超過3 000萬 hm2土地屬于鹽堿地[2],鹽漬化土壤抑制植物的生長發(fā)育,造成植物產(chǎn)量銳減[3]。因此,提高植物的耐鹽性顯得尤其重要。鹽脅迫對植物的傷害表現(xiàn)在4個方面,滲透脅迫、離子毒害、營養(yǎng)元素缺失和氧化脅迫,最終導致植物的生長發(fā)育被抑制甚至死亡[4]。Han等[5]報道,鹽漬化的土壤主要通過植物組織的離子毒害和滲透脅迫來影響植物生長。鹽脅迫最先傷害植物根系的細胞質(zhì)膜,對細胞質(zhì)膜的選擇透過性、穩(wěn)定性的傷害成為直接原初鹽害[6]。植物組織中過多Na+的積累,打破細胞質(zhì)內(nèi)的離子平衡,對植物產(chǎn)生毒害影響[7]。
泡桐(PaulowniaSieb.et Zucc)作為一種速生木材,在中國分布廣泛,具有較強的耐干旱能力和適應能力。但關(guān)于‘泡桐1201’對鹽脅迫的響應機制,特別是關(guān)于根系離子平衡鮮見報道,因此,探究鹽脅迫對‘泡桐1201’幼苗生長的生理響應情況與適應機制,了解‘泡桐1201’鹽脅迫下離子應答機制,為選育耐鹽堿性作物,大力推廣該樹種提供科學依據(jù)。
1 材料與方法
1.1 試驗材料
供試材料采自河南農(nóng)業(yè)大學毛莊‘泡桐1201’號種子。
1.2 試驗設計
以‘泡桐1201’幼苗為研究對象,在鹽濃度為0~200 mmol·L-1進行脅迫處理,每50 mmol·L-1設置1組,共5組,測定幼苗的生理指標以及根系離子流速。
種子用次氯酸鈉浸泡30 s左右,無菌水反復沖洗4~5次后,將沖洗凈的種子浸泡在無菌水中催芽5~7 d后置于光照培養(yǎng)箱中培養(yǎng),每天定時向培養(yǎng)皿中補水。待種子萌發(fā)至子葉展開后,將發(fā)芽的種子接種于(對照組)鹽脅迫濃度分別為 0、50 mmol·L-1、100 mmol·L-1、 150 mmol·L-1和200 mmol·L-1的MS培養(yǎng)基中。取30 d的幼苗測定其生長指標、抗氧化性指標和離子流速。
1.3 測定方法
生長指標為株高、主根長度以及根、莖、葉的鮮質(zhì)量和干質(zhì)量。葉綠素質(zhì)量分數(shù)的測定采用乙醇提取比色法[8]。SOD活性的測定采用氮藍四唑法[9]。POD活性的測定采用愈創(chuàng)木酚法[10]。MDA的質(zhì)量摩爾濃度測定采用硫代巴比妥酸法[11]。CAT酶活性測定采用雙氧水法[12]。離子流速采用非損傷微測技術(shù)測定根尖Na+、K+、H+和Ca2+流速[13]。
1.4 數(shù)據(jù)分析
鹽脅迫處理設置 3 個生物學重復,每個生物學重復設置 3 個操作重復。生長指標的測定方法為每個處理測量10棵,抗氧化酶活性測定每個處理設置3個重復,離子流速測定每個處理重復5次。采用SPSS 17.0軟件對數(shù)據(jù)進行處理,采用Duncan’s法進行處理間的差異顯著性比較。柱狀圖的繪制使用Origin 8.0軟件,結(jié)果以“平均數(shù)±標準差”表示。
2 結(jié)果與分析
2.1 鹽脅迫對‘泡桐1201’幼苗生長情況的影響
植物的生物量可以反映出植物的生長情況,鹽脅迫濃度越大,植物受到的迫害越嚴重,干質(zhì)量和鮮質(zhì)量的減少量越大[14]。由表1可知,鹽脅迫下,各項生長指標均低于對照組。幼苗的株高、根長隨鹽脅迫濃度的增大而逐漸下降。在鹽濃度為50 mmol·L-1時,幼苗株高和根長降低不明顯,在鹽脅迫濃度為100 mmol·L-1、150 mmol·L-1和200 mmol·L-1時,株高分別顯著降低14.6%、27.2%和44.3%,主根長分別顯著降低14.0%、41.4%和 62.8%。在植株生長的過程中,根系首先接觸鹽分,所以根系受到的抑制最明顯,隨著鹽分的增加,主根長受到的脅迫越明顯,主根長越短。
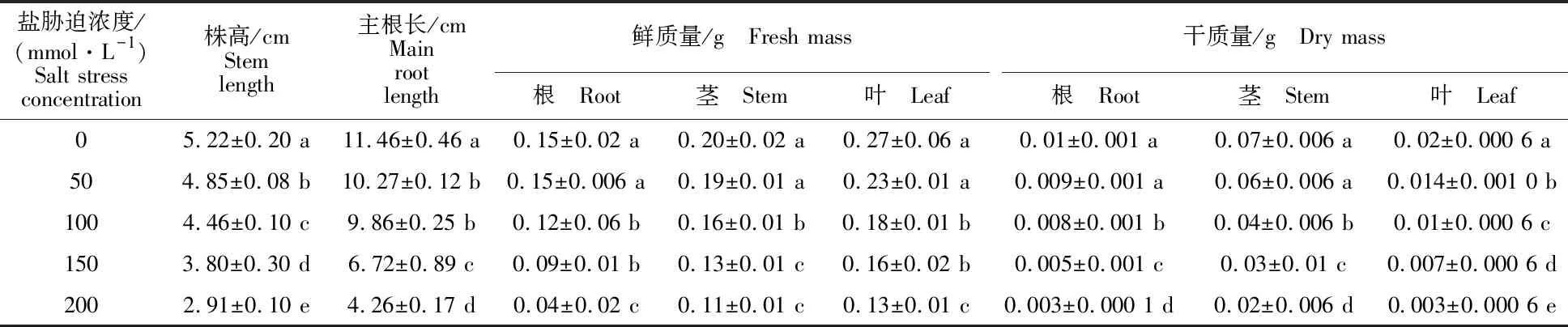
表1 鹽脅迫下‘泡桐1201’幼苗生長情況Table 1 Growth of‘P.1201’ seedling under salt stress
注:同列不同小寫字母表示差異顯著(P<0.05)。下同。
Note:Different lowercase letters represent significant difference(P<0.05). The same below.
2.2 鹽脅迫對‘泡桐1201’幼苗葉片葉綠素質(zhì)量分數(shù)的影響
葉綠素在植物的光合作用中發(fā)揮著重要作用,葉綠素質(zhì)量分數(shù)少的植物光合能力弱,同時用葉綠素質(zhì)量分數(shù)來衡量植物抗逆性[15]。由圖1可以看出,鹽脅迫使‘泡桐1201’幼苗綠素a明顯降低,隨鹽脅迫濃度的增加,呈下降的趨勢,與對照組相比,葉綠素a在鹽脅迫濃度為50 mmol·L-1變化不明顯,在150 mmol·L-1和200 mmol·L-1濃度下,分別降低43.8%和58.6%。葉綠素b變化不大,與葉綠素a變化趨勢一致。類胡蘿卜素隨著鹽脅迫濃度增加,質(zhì)量分數(shù)逐漸減少。葉綠素質(zhì)量分數(shù)在鹽脅迫濃度為100 mmol·L-1時下降趨勢較顯著,與對照組相比下降28.8%。在高濃度鹽脅迫下,葉綠素質(zhì)量分數(shù)低于對照。在鹽脅迫濃度為200 mmol·L-1時,植物受到較為嚴重的外界脅迫,葉綠素質(zhì)量分數(shù)降低,光合作用能力減弱。
2.3 鹽脅迫對‘泡桐1201’幼苗SOD活性的影響
SOD活性反應植株活性氧基清除能力的大小,與作物抗鹽性有密切聯(lián)系[16]。植株體內(nèi)自由基的清除能力可通過增大SOD和POD活性降低對細胞的損害。由圖2可知,SOD活性隨鹽脅迫濃度變化而變化,先增強后減弱。在50 mmol·L-1鹽脅迫濃度下,與對照組相比,葉片和根尖SOD活性差異不顯著。在濃度為100 mmol·L-1時,SOD活性最高,葉片的SOD活性相比對照組顯著增加26.6%,‘泡桐1201’植株的SOD活性增幅較大,此時植株表現(xiàn)較強的抗性。SOD活性都隨著鹽脅迫濃度的增大呈先增加后降低的趨勢。根尖的SOD活性變化趨勢與葉片中的基本一致。
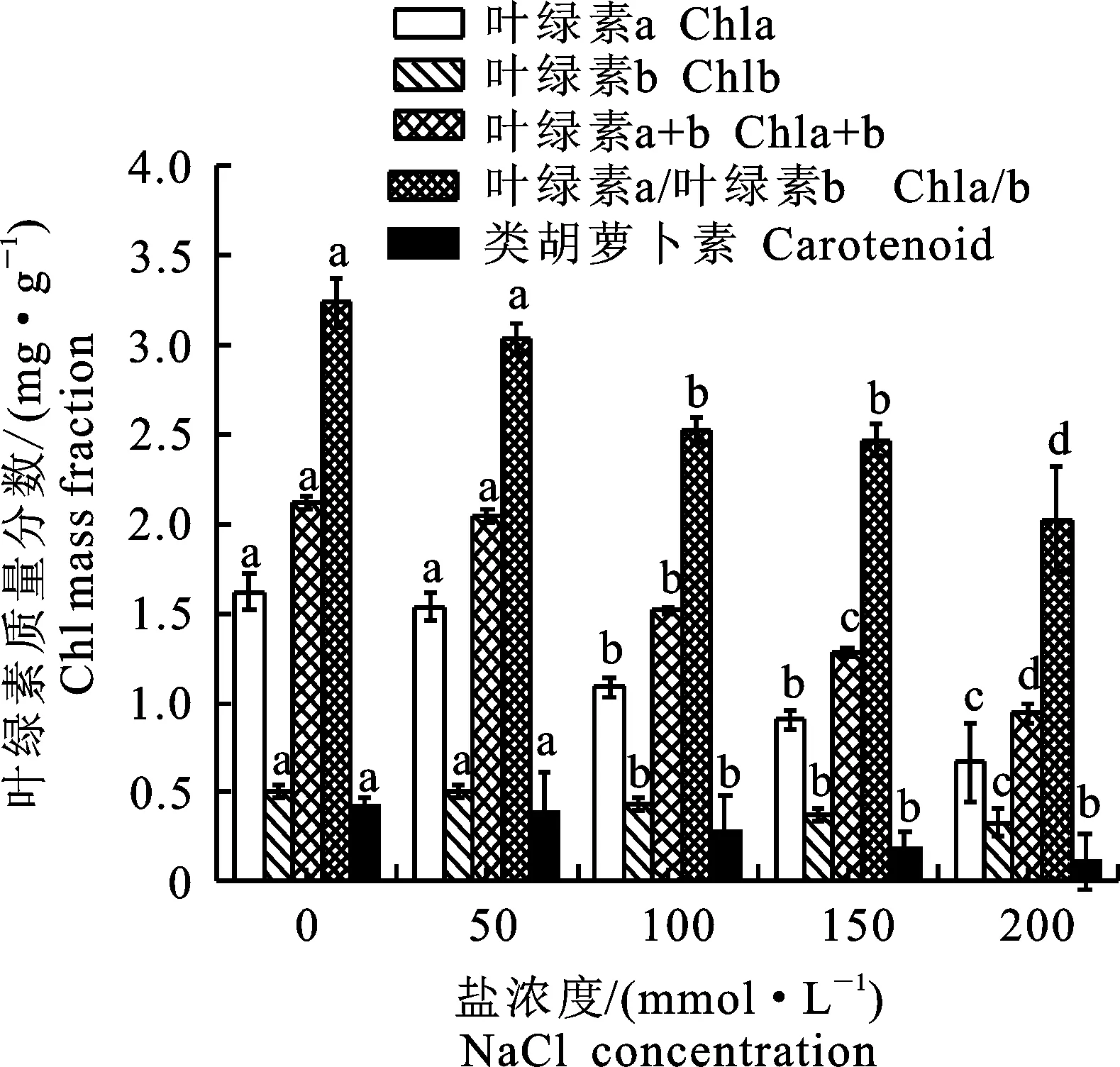
不同小寫字母表示差異顯著(P<0.05)。下同 Different lowercase letters represent significant difference(P<0.05).The same below
圖1鹽脅迫下‘泡桐1201’葉綠素質(zhì)量分數(shù)
Fig.1Chlorophyllmassfractionof
‘P.1201’undersaltstress
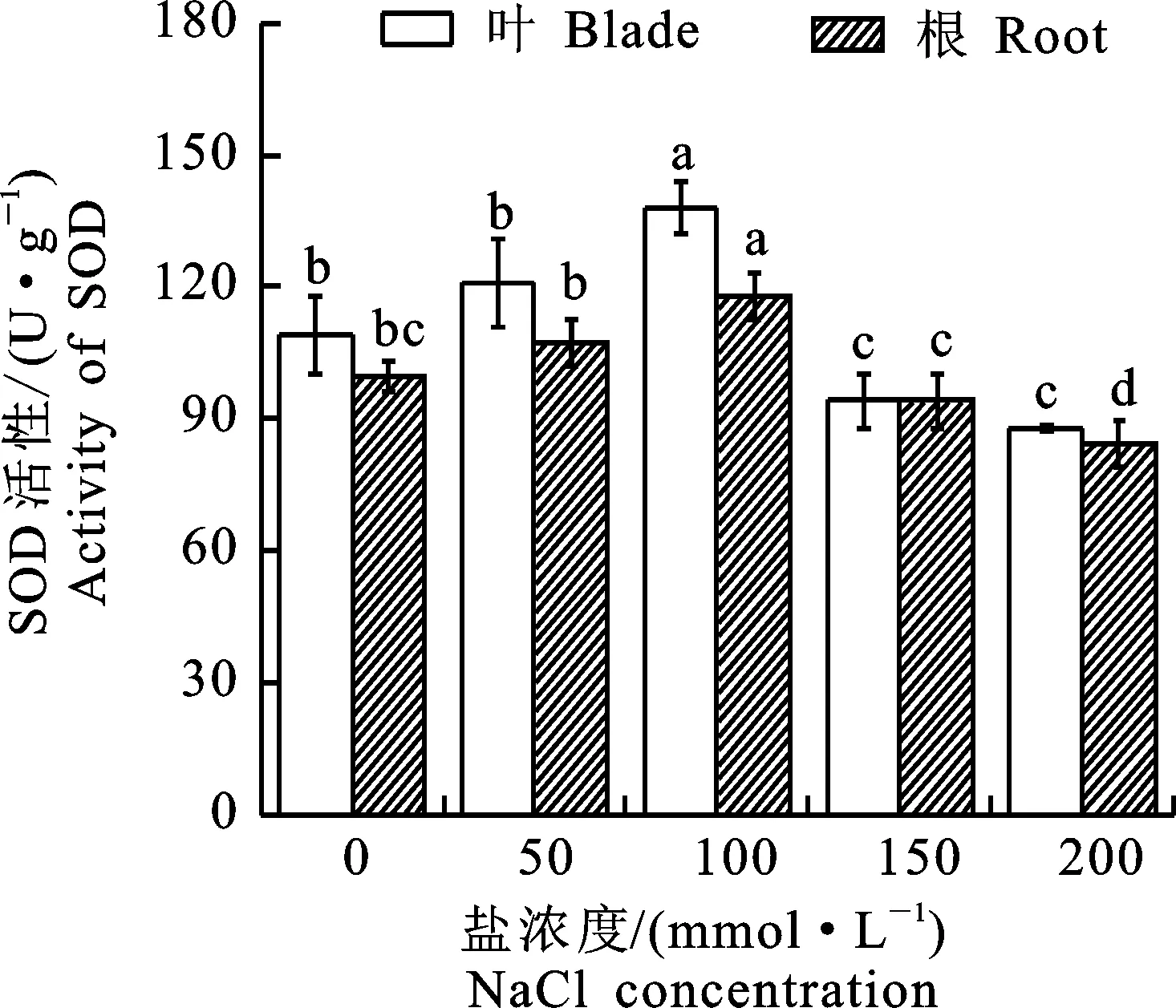
圖2 鹽脅迫下‘泡桐1201’SOD活性Fig.2 SOD activity of‘P.1201’ under salt stress
2.4 鹽脅迫對‘泡桐1201’幼苗POD活性的影響
POD是植物體內(nèi)保護酶的一種,在植物體中活性很高,通過將植物體內(nèi)自由基生成的過多的過氧化物分解為水和氧,以降低過氧化物對細胞和組織的毒害性[17]。由圖3可知,在鹽濃度為50 mmol·L-1時‘泡桐1201’幼苗中POD活性顯著升高。當鹽脅迫濃度為100 mmol·L-1時,與對照組相比,POD活性升高66.8%。在150 mmol·L-1時較100 mmol·L-1POD活性下降 28.6%。在200 mmol·L-1時葉片中POD活性下降至最低,達244 U·g-1。根尖和葉片在50 mmol·L-1時與對照組差異較大,此時POD活性達到最大值。在鹽脅迫濃度超過50 mmol·L-1時,隨著鹽脅迫濃度的增加POD活性顯著下降,表明此時鹽脅迫已經(jīng)超過植物的自我保護范圍,影響植物的生長。
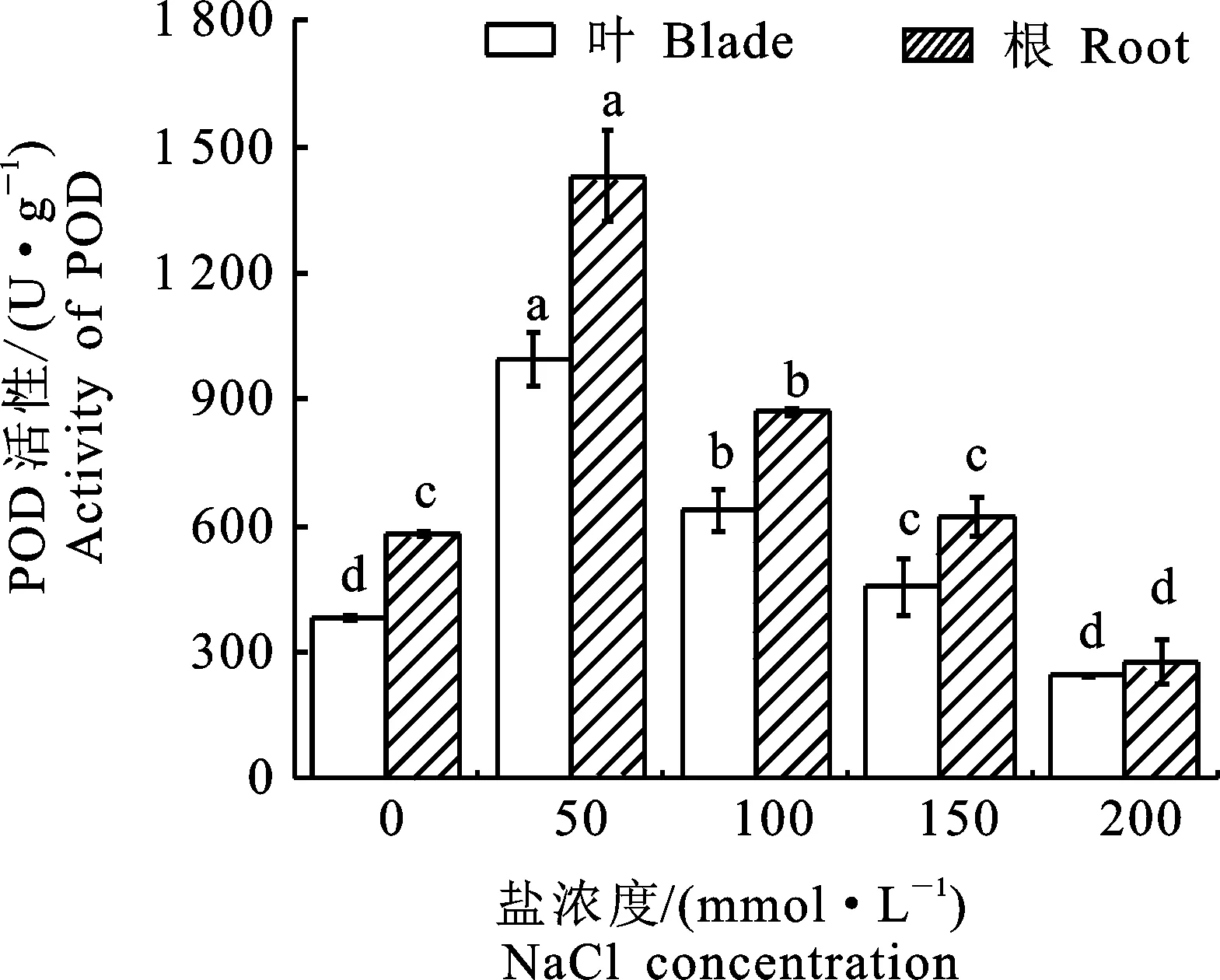
圖3 鹽脅迫下‘泡桐1201’POD活性Fig.3 POD activity of‘P.1201’ under salt stress
2.5 鹽脅迫對‘泡桐1201’幼苗MDA質(zhì)量摩爾濃度的影響
MDA是植物體組織發(fā)生膜脂過氧化后的最終產(chǎn)物,與植物的抗性呈負相關(guān),MDA質(zhì)量摩爾濃度的多少可以判斷在鹽脅迫下膜結(jié)構(gòu)受傷害的程度,MDA質(zhì)量摩爾濃度越多膜結(jié)構(gòu)損害程度越大,進而判斷植物的抗逆性差[18]。由圖4可以看出,在鹽脅迫濃度為0~200 mmol·L-1時,葉片和根部MDA質(zhì)量摩爾濃度呈現(xiàn)升高趨勢。在200 mmol·L-1濃度下,MDA質(zhì)量摩爾濃度最大達到3.36 μmol·g-1。在鹽脅迫濃度為50~100 mmol·L-1時,MDA根部質(zhì)量摩爾濃度無明顯變化,當鹽脅迫濃度高于100 mmol·L-1一定范圍后,隨著鹽濃度的增加,MAD質(zhì)量摩爾濃度也顯著增加,MDA質(zhì)量摩爾濃度較低的植株具有較強的抗性。在鹽脅迫濃度為200 mmol·L-1時,MAD質(zhì)量摩爾濃度最高,說明此時‘泡桐1201’幼苗的膜脂過氧化傷害最嚴重,受到的迫害最嚴重。
2.6 鹽脅迫對‘泡桐1201’幼苗CAT活性的影響
在植物的生長過程中,CAT發(fā)揮著重要作用,該酶是植物體內(nèi)一種重要的氧化還原酶。主要清除植物通過呼吸作用和光合作用等途徑產(chǎn)生的過氧化物,同時CAT主要負責植物葉綠體細胞外的過氧化物,維持活性氧代謝的平衡,保護細胞膜的完整性[19-20]。由圖5可知,在50 mmol·L-1鹽脅迫濃度下CAT活性變化不明顯,但是當鹽脅迫濃度達到100 mmol·L-1時,CAT活性升高。在濃度較低的50 mmol·L-1鹽脅迫時,植物的抗性能力較強,在植物自身的防御機制內(nèi),CAT活性顯著升高。但是達到100 mmol·L-1時,鹽脅迫對植物造成迫害,產(chǎn)生較多的過氧化物,植物自身的防御機制啟動,因此CAT活性升高抵抗鹽脅迫對植物產(chǎn)生的有害物質(zhì)。隨著鹽濃度的不斷升高,超過植物自身的調(diào)節(jié)機能,過氧化物產(chǎn)生過多,破壞植物細胞體內(nèi)抗氧化性酶的合成,導致CAT酶活性隨之降低。
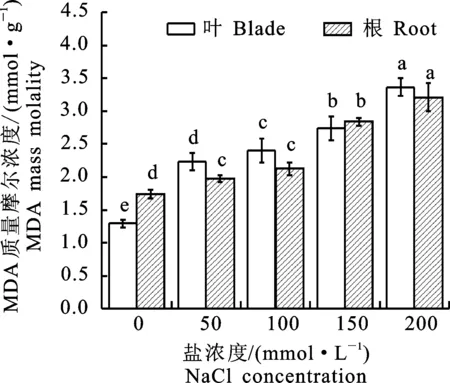
圖4 鹽脅迫下‘泡桐1201’MDA質(zhì)量摩爾濃度Fig.4 MDA mass molality of‘P.1201’ under salt stress
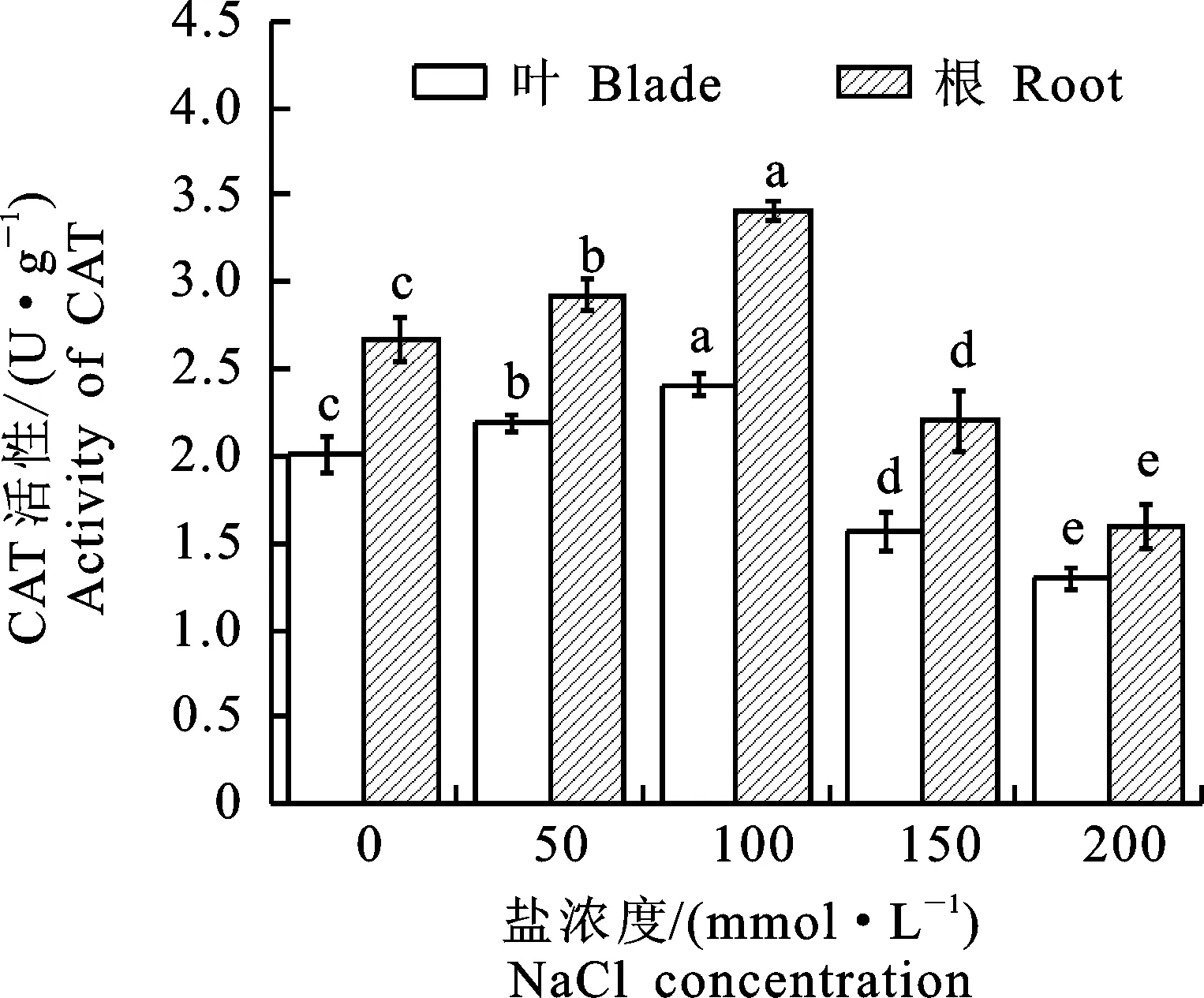
圖5 鹽脅迫下‘泡桐1201’CAT活性Fig.5 CAT activity of‘P.1201’ under salt stress
2.7 鹽脅迫對‘泡桐1201’幼苗根尖離子流速的影響
土壤中高濃度的鹽分不利于根系吸收水分,植物組織中的高濃度鹽分會導致離子毒。鹽脅迫條件下,由于植物吸收了較多的Na+和Cl-,從而降低了對K+、Ca2+和Mg2+的吸收,打破了植物體內(nèi)動態(tài)的離子平衡[21]。進而影響其細胞的生長和光合作用的傳遞,抑制多種細胞質(zhì)酶的合成,造成一定程度的單鹽毒害。本研究利用非損傷微測技術(shù)(NMT),對‘泡桐1201’根系分生區(qū)0~600 μm處掃點,正值表示離子外流,負值表示離子內(nèi)流,測得流速為離子進出植物細胞的凈流速值。在距離根尖200 μm和600 μm處離子相對較活躍,所以測定該位點的離子流速。
由圖6可知,‘泡桐1201’幼苗Na+均為外排。在鹽脅迫濃度為50 mmol·L-1時,與對照組相比,距根尖200 μm和600 μm處Na+的外排速率顯著增加,泡桐幼苗根系Na+的排出主要是由質(zhì)膜逆向轉(zhuǎn)運調(diào)控的,Na+/H+逆向轉(zhuǎn)運蛋白活性增加提高Na+的排出。在600 μm處測得離子外排速率普遍高于200 μm處,并且在150 mmol·L-1和200 mmol·L-1處Na+外排速率逐漸減少。
K+流速如圖6顯示,均為外排,隨著鹽脅迫濃度的增加,流速顯著增大。200 μm和600 μm處K+流速差異不大,試驗組流速均大于對照組,并且差異顯著。鹽脅迫濃度達到200 mmol·L-1時,200 μm和600 μm處K+流速都達到最大,分別為2 277 pmol·cm-2·s-1和2 641 pmol·cm-2·s-1。
H+的流速圖顯示(圖6),對照組在200 μm和600 μm處H+表現(xiàn)為內(nèi)流,流速為4 pmol·cm-2·s-1和5 pmol·cm-2·s-1。在其他試驗組,H+隨著鹽脅迫的濃度增大內(nèi)流速率先增加后降低,在100 mmol·L-1鹽脅迫處理下最高,200 μm和600 μm處H+內(nèi)流速率分別為33 pmol·cm-2·s-1和34 pmol·cm-2·s-1。
在200 μm和600 μm處,Ca2+均為內(nèi)流(圖6)。鹽脅迫濃度為50 mmol·L-1的試驗組與對照組相比,在200 μm和600 μm處Ca2+流速增加差異不顯著,當鹽脅迫濃度超過50 mmol·L-1時,隨著鹽脅迫濃度的增加,流速顯著增加。在距離根尖200 μm和600 μm處,流速最大值是鹽脅迫濃度為200 mmol·L-1,分別達到163 pmol·cm-2·s-1和136 pmol·cm-2·s-1。
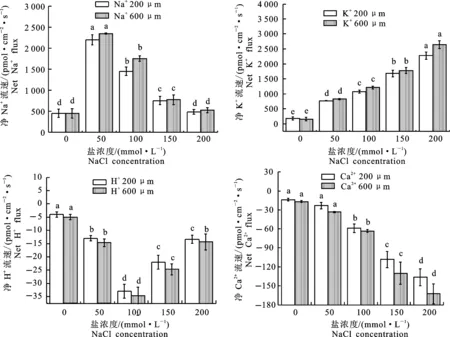
圖6 鹽脅迫下‘泡桐1201’根尖Na+、K+、H+、Ca2+流速Fig.6 Na+,K+,H+ and Ca2+ flux rate in root tip of ‘P.1201’ under salt stress
3 討 論
本研究結(jié)果表明,用0~200 mmol·L-1濃度鹽脅迫30 d可以明顯抑制‘泡桐1201’幼苗的生長,株高、根長、干質(zhì)量和鮮質(zhì)量隨鹽脅迫濃度的增大而逐漸下降。在50 mmol·L-1鹽處理時,‘泡桐1201’幼苗生長指標降低不明顯,植物能夠正常生長,說明‘泡桐1201’幼苗對低鹽脅迫有一定的耐受性。但在鹽濃度高于100 mmol·L-1時,株高、主根長、干質(zhì)量和鮮質(zhì)量顯著降低,表明‘泡桐1201’耐鹽能力一般,并且鹽脅迫強度越大,干物質(zhì)量降低幅度越大,與 Qadir等[22]研究結(jié)論一致。
植物在鹽脅迫的影響下,會通過各種代謝途徑和表型的變化去維持生命活動。特別是高鹽脅迫使植物細胞內(nèi)的水勢高于細胞外,導致細胞失水,植物細胞內(nèi)的離子含量升高,引起植物細胞內(nèi)的葉綠素和光合作用相關(guān)的酶解離,導致光合作用下降,影響植物生長發(fā)育,影響程度由植物耐鹽性決定[23-26]。植物體內(nèi)在正常生長過程中會通過產(chǎn)生活性氧來維持自由基的產(chǎn)生與消除,防御系統(tǒng)的能力,取決于SOD、POD和CAT等保護酶的相互協(xié)調(diào)作用達到一個動態(tài)平衡[27]。本研究結(jié)果表明,‘泡桐1201’幼苗葉綠素質(zhì)量分數(shù)隨著鹽脅迫濃度的增加而減小;MDA質(zhì)量摩爾濃度隨著鹽脅迫濃度增加而增大,并且與前人[28-29]對麻瘋樹和紅樹的研究結(jié)果一致。SOD、POD 和 CAT 活性都隨著鹽脅迫濃度的增大呈先增加后降低的趨勢,與郭瑞等[30]研究結(jié)果一致。并且‘泡桐1201’幼苗 SOD 和 CAT 活性在 100 mmol·L-1時都達到最大值。原因可能是低鹽可以誘導SOD和CAT活性增強,抗性氧化酶活性升高,清除過量的氧自由基等活性物質(zhì)[31-32]。當 鹽 脅迫達到 150 mmol·L-1時,SOD、POD 和 CAT 酶活性都顯著降低,MDA質(zhì)量摩爾濃度升高,植物膜脂過氧化作用增強,細胞膜結(jié)構(gòu)被破壞,各種保護酶的活性均下降,植物生長受到抑制[33]。本研究中,POD 活性在鹽濃度為50 mmol·L-1時達到最大值,說明POD在‘泡桐1201’幼苗內(nèi)對鹽脅迫濃度較為敏感,耐受閾值低。由此推測,‘泡桐1201’幼苗抗鹽脅迫的酶促機制可能是SOD和CAT起主要作用,也可能是由于SOD、POD、CAT三者不能協(xié)調(diào)一致完成活性氧的清除,導致‘泡桐1201’幼苗抗氧化能力減弱,從而引發(fā)一系列活性氧傷害。‘泡桐1201’幼苗在低濃度鹽脅迫下能夠正常生長,但是隨著鹽脅迫濃度的增加,生長受到抑制,這與劉雅輝等[34]在蒲公英上的研究結(jié)果一致。
Na+能夠維持植物的離子平衡,調(diào)節(jié)細胞的滲透壓;H+在生理調(diào)節(jié)過程中有重要的意義,是生理調(diào)節(jié)的重要表現(xiàn),調(diào)節(jié)pH和電化學梯度。‘泡桐1201’幼苗受到鹽脅迫,Na+主要為外排,H+主要表現(xiàn)為內(nèi)流,Ca2+隨著鹽脅迫濃度的增加,內(nèi)流速率顯著增大,但是隨著鹽脅迫的濃度增大K+外排速率增大。Ashraf等[35]研究表明,高等植物質(zhì)膜上的H+-ATPase水解ATP 產(chǎn)生能量,將H+從細胞質(zhì)中泵出,從而產(chǎn)生跨質(zhì)膜的H+電化學勢梯度,H+順著電化學勢梯度進入細胞的同時,Na+逆著電化學勢梯度被排出細胞,從而保持細胞內(nèi)較低的Na+含量,以此來維持植物細胞的離子平衡,降低鹽脅迫對植物的危害。植物細胞質(zhì)中的K+/Na+平衡對細胞代謝和抵御鹽脅迫都起著重要作用[36]。但是隨著鹽脅迫濃度的增加,‘泡桐1201’根部細胞的自我調(diào)節(jié)機制被破壞,更多的Na+被留在根部細胞,過多的Na+導致‘泡桐1201’細胞中Ca2+進入減少,K+/ Na+平衡遭到破壞,離子平衡紊亂,進而對植物產(chǎn)生不可逆的傷害。植物根系積累過多的Na+會產(chǎn)生離子毒害,通過調(diào)節(jié)細胞內(nèi)的離子平衡,降低毒害作用,從而增加其抗逆能力[37]。
4 結(jié) 論
本研究結(jié)果表明,輕度鹽脅迫(50 mmol·L-1)下,‘泡桐1201’幼苗各生長指標和綠素質(zhì)量分數(shù)降低不顯著,葉片和根部內(nèi) SOD、CAT 清除活性氧活力增強,有效抵御鹽脅迫傷害,維持植株的正常生長,可作為低鹽土壤環(huán)境改良樹種引種栽培;但隨著鹽脅迫強度的增加,雖然葉片內(nèi)滲透調(diào)節(jié)物質(zhì)合成被激發(fā),質(zhì)膜損害嚴重,穩(wěn)定性下降,抗氧化酶活性受到抑制,離子穩(wěn)態(tài)干擾加劇,‘泡桐1201’幼苗生長受到抑制,甚至在高鹽(200 mmol·L-1)脅迫下出現(xiàn)植株枯萎死亡。綜上,‘泡桐1201’幼苗對鹽脅迫濃度較敏感,但對低濃度的鹽脅迫具有一定的耐受性。
Ding等[38]研究表明,植物SOS1編碼質(zhì)膜 Na+/H+逆向轉(zhuǎn)運體,主要負責鹽脅迫下 Na+的主動外排,NHX1編碼液泡膜定位的 Na+/H+逆向轉(zhuǎn)運體,可將 Na+運入液泡,形成區(qū)隔化,降低胞質(zhì)中 Na+的濃度,從而達到自我調(diào)節(jié)防御機制來抵制鹽脅迫的危害。關(guān)于離子流動力以及所涉及的基因在不同時刻的表達對植物的抗逆性密切相關(guān),在以后的試驗里可以開展研究。

