乙酰氨基葡萄糖合成關鍵酶氨基葡萄糖-6-磷酸乙酰轉移酶的篩選及酶學性質分析
徐小芳 , 劉延峰 , 李江華 *, 劉 龍 , 堵國成 , 陳 堅
(1.江南大學 工業生物技術教育部重點實驗室,江蘇 無錫 214122;2.江南大學 生物工程學院,江蘇 無錫214122)
N-乙酰氨基葡萄糖 (N-acetylglucosamine,GlcNAc)是氨基葡萄糖(Glucosamine,GlcN)的 衍生物,具有重要的生理功能,在食品、醫藥及化妝品領域具有廣泛應用[1],如可以提高關節抗炎活性和蛋白活性[2];食品方面的添加劑和抗氧化劑[3];可作為天然的保鮮劑和抗菌劑廣泛應用于食品保藏[4];最近研究表明,GlcNAc能夠提高內質網蛋白質內穩態,從而起到延長細胞壽命的作用[5]。
GlcNAc的生產方法可分為3種:甲殼素水解法、生物轉化法和微生物發酵法[6-8]。發酵法生產GlcNAc利用的生產菌株主要有真菌和大腸桿菌(Escherichia.Coli,E.coli)[9-10]。目前本實驗室采用枯草芽孢桿菌(Bacillus.subtilis,B.subtilis)發酵生產GlcNAc[8,11],B.subtilis 已被廣泛應用于發酵工業,其產品被認定為是食品安全級[12],且遺傳背景清晰、基因操作技術成熟、發酵工藝成熟并且不易被噬菌體污染,是生產GlcNAc的理想宿主[13]。
氨基葡萄糖-6-磷酸乙酰轉移酶(glucosamine-6-phosphate N-acetyltransferase 1,Gna1,EC 2.3.1.4)作為合成GlcNAc代謝途徑上的關鍵酶是GCN5相關的GNAT蛋白質超家族中的一員[14],是一組參與相關天冬酰胺連接型(N-)聚糖合成與加工的重要酶類,能夠催化生成GlcNAc-6P,將Acetyl-CoA中的乙酰基轉移到GlcN-6P的氨基上[15-16],生成的GlcNAc-6P進一步在胞內轉化為GlcNAc并被轉移到胞外。目前GNA的三級結構在人類、酵母、人類、秀麗隱桿線蟲、煙曲霉及布氏椎蟲中有所報道[16-21]。許多物種包括白假絲酵母、釀酒酵母(Saccharomyces cerevisiae,S.cerevisiae)、布氏椎蟲、小鼠等GNA缺失后,均引起致死表型[15,20-22]。然而前期研究GNA表達相關內容僅集中于調控不同表達元件優化GNA表達量,因此,找到一種能夠提高目標產物GlcNAc產量氨基葡萄糖乙酰轉移酶并且對其酶學性質進行系統研究對提高發酵法生產GlcNAc具有重要意義。
本研究首先異源表達7種不同來源的GNA,篩選出秀麗隱桿線蟲來源的Cegna1能夠更有效的積累乙酰氨基葡萄糖。其次,考察了7株重組酶的動力學參數米氏常數Km與Kcat/Km發現重組Cegna1相比較其他6種重組酶均對GlcN-6P和Ac-CoA有較高的親和力和催化效率。最后發現底物GlcN-6P對重組Cegna1的抑制作用明顯,下一步可采用定向進化策略改造Cegna1,解除底物GlcN-6P對重組Cegna1的抑制作用。本研究結果篩選到的Cegna1可用于GlcNAc合成途徑的優化,同時為應用定向進化策略改造GNA提供理論依據和指導。
1 材料與方法
1.1 材料
1.1.1 菌株與質粒 本文所用的菌株、質粒及引物見表1和表2,出發菌株為重組BSGN6-PxylA-glmS,為本實驗室所改造[11],出發菌株在野生型菌株B.subtilis 168基礎上進行改造得到。質粒pP43NMK由張曉舟博士惠贈 (美國弗吉尼亞理工大學,生物系統工程學院)。表達氨基葡萄糖乙酰化酶7種不同來源基因Cegna1(Caenorhabditis elegans,NCBIGenBank:AB017628.1)、Tbgna1 (Trypanosoma brucei,NCBI GenBank:FR715998.1)、Scgna1 (S.cerevisiae,NCBI GenBank:NM_001179949.1)、Cagna1(Candida albicans,NCBI GenBank:XM_715990.1)、Afgna1(Aspergillusfumigatus Af293 ,NCBI GenBank:XM_742738.1)、Dfgna1(Dictyostelium fasciculatum,NCBI GenBank:XM_004367264.1)、Osgna1(Oryza sativa,NCBI GenBank:AY772189.1)進行枯草密碼子優化后借由上海生工生物工程技術服務有限公司合成,見表3。

表1 本論文中使用的菌株和質粒Table 1 Strains and plasmids used in this chapter

表2 本研究所使用的引物Table 2 Oligonucleotides used in this study

表3 氨基葡萄糖乙酰化酶7種不同來源基因經枯草密碼子優化優化后序列總表Table 3 Sequence table of glucosamine acetylase with 7 different source genes after codon optimization

續表3
1.1.2 試劑 常用試劑及試劑盒,均購于TaKaRa生物工程有限公司;玉米漿和酵母粉,分別購自山東西王食品和上海一品鮮生物科技有限公司。基因與引物合成、DNA測序等,由上海生工生物工程有限公司完成。
1.1.3 培養基與培養條件 發酵培養基成分為(g/L):玉米漿干粉 20,酵母粉 20,K2HPO4·3H2O 12.5,KH2PO42.5,CaCO35,微量元素 15 ml/L;pH7.5;微量元素溶液按 g/L 計含有:MnSO4·5H2O 1.0,CoCl2·6H2O 0.4,NaMoO4·2H2O 0.2,ZnSO4·7H2O 0.2,AlCl3·6H2O 0.1,CuCl2·H2O 0.1,H3BO40.05,含 5 mol/L HCl。
1.2 實驗方法
1.2.1 菌株構建 分別使用相對引物擴增由上海生工生物工程有限公司合成的目的基因(如使用引物CeGna1-F和 CeGna1-R擴增出CeGna1基因)獲得相應的目的片段,分別插入pP43NMK質粒中,獲得重組質粒。重組質粒在Escherichia.coli JM109中擴增后轉入目的菌株BSGN6-PxylA-glmS,獲得重組菌株。通過菌落PCR驗證篩選出陽性菌株,挑選的陽性菌株在含有100 μg/mL氨芐青霉素的LB培養基中37℃培養過夜,最后提取質粒進行酶切驗證及測序鑒定。
1.2.2 3 L發酵罐補料分批發酵 將種子液以體積分數4%的接種量轉接至裝液量為1.5 L的3 L發酵罐中,通氣量為1.5 vvm在37℃條件下培養,pH使用體積分數25%氨水和3 mol/L鹽酸調節維持在7.4,發酵罐初始的攪拌轉速為600 r/min,使用木糖其終質量濃度為5 g/L進行誘導在菌體OD600達到0.4時。培養基中含20 μg/mLKana,葡萄糖初質量濃度為20 g/L,葡萄糖發酵后8 h后開始流加,其質量濃度控制在5 g/L,每隔4 h取樣分析。
1.2.3 蛋白質濃度測定 采用Bradford法測定蛋白質濃度,具體步驟詳見蛋白濃度測定試劑盒說明書。
1.2.4 乙酰氨基葡萄糖HPLC測定方法 GlcNAc通過高效液相色譜法測定。高效液相色譜條件:檢測器為示差折光檢測器(RID);色譜柱為Aminex?HPX-87H,300 mm×7.8 mm 柱(250 mm×4.6 mm,5 μm),柱溫為35℃;流動相為5 mmol/L硫酸;流速為0.6 mL/min;進樣體積為10μL。樣品處理方法:發酵液經12000 r/min離心4 min后,取適量上清液用超純水稀釋一定倍數,再將該樣品稀釋液用0.22 μm濾膜過濾。
1.2.5 重組氨基葡萄糖轉移酶的分離與純化 將重組菌株的單菌落分別接種于含相應抗性的LB培養基中,在37℃、200 r/min的條件下培養到OD600值為0.6,加入木糖(終質量濃度5 g/L)誘導后培養4 h。菌液在4℃ 下8 000 r/min離心后棄上清液,沉淀用100 mmol/L PBS(pH 7.5)洗滌3次,經750 W超聲破碎 (工作強度60%)后離心收集上清液。
鎳柱純化操作方法:采用AKTA蛋白純化儀,先用緩沖液 A (pH 7.4,20 mmol/L PBS,20 mmol/L咪唑,500 mmol/L NaCl)平衡鎳柱,然后以1 mL/min流速進行上樣;再用緩沖液A以1mL/min流速沖洗掉鎳柱中沒有結合蛋白質;最后,用緩沖液B(pH 7.4,20 mmol/L PBS,500 mmol/L 咪唑,500 mmol/L NaCl)以流速為1 mL/min進行梯度洗脫。純化后通過酶活測定和SDS-PAGE鑒定重組目的蛋白質;純化后的目的蛋白質用透析袋在20 mmol/L PBS(pH 7.4)中透析過夜,純化后的重組酶保存于-80℃冰箱。
步入21世紀的中國,面臨新的發展機遇和挑戰。這十年是極不平凡的十年:戰勝了2003年非典、2008年汶川地震等自然災害等,經受了2008年金融危機考驗,舉辦了第29屆奧運會、第41屆世博會。這十年也是中國成長的十年,一次次的經歷增強了中華民族的凝聚力,同時也提升了中國的國際影響力。這期間黨中央召開了十六大、十七大,更加堅定了改革開放的步伐。黨的十六大向世人昭示了新世紀的中國舉什么旗、走什么路、實現什么樣的目標等重大問題,并圍繞這些問題做了全方位的部署,大踏步向全面建成小康社會的目標邁進。黨的十七大總結了改革開放的歷史進程和經驗,對深入貫徹科學發展觀提出明確要求,將改革開放不斷深入推進。
1.2.6 酶活測定 乙酰氨基葡萄糖合成酶酶活的檢測具體方法如下[15]:50 μL反應體系包含50 mmol/L Tris-HCl (pH 7.5), 200 μmol/L GlcN-6-P,5 mmol/L MgCl2, 體積分數 10%甘油,200 μmol/L Ac-CoA 和10 μL樣品 30°C反應 10 min后加入50 μL終止溶液,包括50mmol/LTris-HCl(pH7.5)及 6.4 mol/L鹽酸胍;最后加入50 μL測量溶液,包括50 mmol/L Tris-HCl(pH 7.5),1 mmol/L EDTA 以及 5,5-二硫代雙-2-硝基苯甲酸,產物可通過412 nm下的吸光度進行檢測,從而計算乙酰氨基葡萄糖合成酶酶活。
氨基葡萄糖乙酰化酶酶活單位的定義為:在30℃下,每分鐘催化合成1 μmol乙酰氨基葡萄糖所需的酶量定義為1個酶活單位,酶活單位為U/mL或U/mg。
1.2.7 實驗數據分析方法 菌體比生長速率(specific growth rate)通過Origin軟件模擬獲得;底物GlcN-6P對重組酶Cegna1的抑制曲線由軟件Graph Pad模擬獲得,并得到抑制常數Ki;重組酶的米氏常數Km和催化常數Kcat的值通過Graph Pad模擬獲得。
酶雙底物反應機制分析方法:分別固定某一底物幾個不同濃度(底物濃度不飽和),研究每個不同濃度下另一種底物對合成GlcNAc-6P含量的影響。如分別固定 Acetyl-CoA底物濃度為 50、100、500 mmol/L,測定這3個濃度下GlcN-6P底物濃度對合成GlcNAc-6P的影響。如果分別得到3條平行線則為乒乓反應機制,如果3條直線相交于一點,則為序列機制。所有數據由3次平行實驗獲得。
2 結果與分析
2.1 表達不同來源GNA對B.subtilis重組菌生產GlcNAc的影響
參照1.2.1步驟,獲得重組質粒pP43-CeGna1、pP43-CaGna1、pP43-ScGna1、pP43-DfGna1、pP43-AfGna1、pP43-OsGna1、pP43-TbGna1。 重組質粒在E.coli JM109中擴增后轉入出發菌株BSGN6-PxylA-glmS, 獲得重組菌株 CeBSGN、CaBSGN、ScBSGN、DfBSGN、AfBSGN、OsBSGN和TbBSGN。如表1所示,上述菌株分別表達來源于Caenorhabditis elegans、Candida albicans 、S.cerevisiae、Dictyostelium fasciculatum、AspergillusfumigatusAf293、Oryzasativa、Trypanosoma brucei。
將7株重組菌進行搖瓶發酵,并檢測GlcNAc的產量,搖瓶發酵48 h,各重組菌株發酵產乙酰氨基葡萄糖的情況如圖1所示。重組菌株CeBSGN中GlcNAc 的 產 量 比 CaBSGN、ScBSGN、DfBSGN、AfBSGN、OsBSGN和 TbBSGN,分別高 26.23%、25.43%、53.32%、83.37%、110.39%、92.19%。 綜上所述,重組菌CeBSGN6對目的產物GlcNAc的合成效果最佳。重組菌株CeBSGN中GlcNAc的產量最高,達到7.31 g/L。

圖1 不同重組菌株搖瓶發酵產GlcNAc產量比較Fig.1 Comparison of different recombinant strains for GlcNAc shaking flask fermentation production
將7株重組菌進行搖瓶發酵培養,每4 h取一次樣并檢測殘糖質量濃度,搖瓶發酵48 h,各重組菌株發酵殘糖情況如圖2所示。搖瓶發酵初始葡萄糖質量濃度為20 g/L,在整個發酵過程中,葡萄糖被迅速消耗,重組7株菌株均在16 h左右將葡萄糖耗光,平均耗糖速率為1.25 g/L。從圖2中可以發現7株重組菌株在對碳源葡萄糖的消耗上情況較為一致。
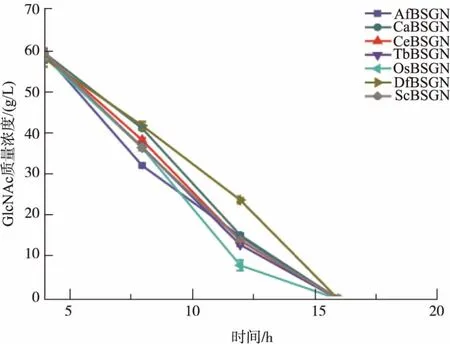
圖2 不同重組菌株葡萄糖消耗情況比較Fig.2 Comparison of different recombinant strains for glucose consumption
7株重組菌搖瓶發酵細胞生長情況如圖3所示。從圖3(a)中可以看出,在整個發酵過程中,重組7株菌株細胞干重在0~16 h增長趨勢較快,16 h后隨著葡萄糖的耗盡,細胞干重開始下降。7株重組菌株細胞干重均在16 h左右達到最大值。經計算,7株重組菌株中CeBSGN目標產物GlcNAc對細胞得率(YGlcNAc/X)最高,最大值為 1.12。
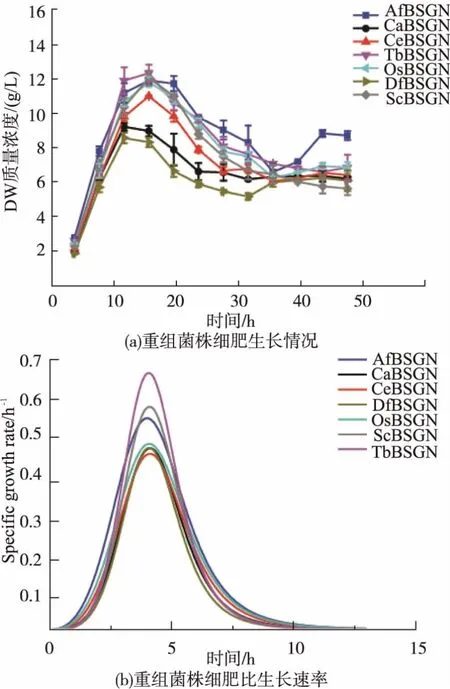
圖3 不同重組菌株細胞生長情況和比生長速率Fig.3 Cell growth and specific growth rate for different recombinant strains
7株重組菌株在對碳源葡萄糖的消耗上情況較為一致,雖然重組菌株CeBSGN相比較6株菌株,發酵生產CeBSGN的產量最大,產物GlcNAc對細胞得率最高,但是從圖3(b)中可發現,在細胞生長對數期菌株CeBSGN的比生長速率相比較卻低于其他6種重組菌株。很多微生物的目標代謝產物一般都是在進入穩定期后才開始大量的合成與分泌,比生長速率與微生物的生命活動有關,如果菌體在對數期比生長速率過大,菌體量增加過多,代謝向菌體合成的方向發展,反而不利于目的產物的累積[23]。由此可以推斷,在相同碳源利用率的情況下,重組菌株CeBSGN比生長速率相對較小,目標產物GlcNAc對細胞得率較高,代謝更易于向目標產物GlcNAc合成的方向發展,從而更有利于產物的合成。
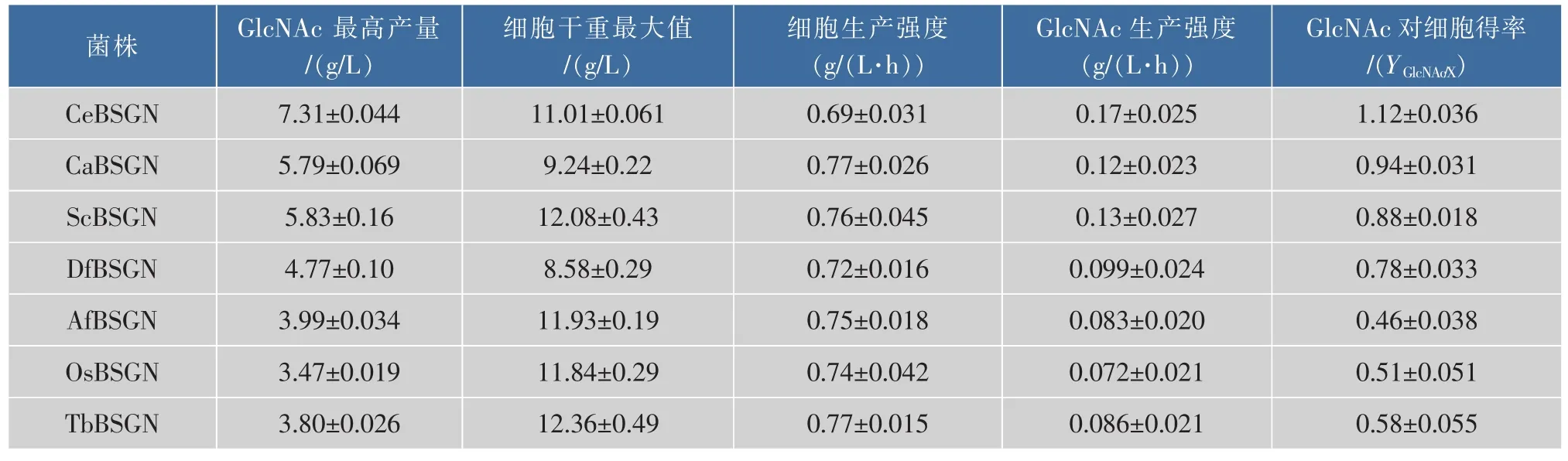
表4 7株重組菌株生產GlcNAc的搖瓶發酵動力學參數比較Table 4 Comparison of GlcNAc shaking flask fermentation parameters on seven recombinant strains
進一步對7株重組菌株的發酵動力學參數進行測定,結果如表4所示,重組菌株CeBSGN的葡萄糖最高產量出現在45 h左右,最高產量為19.43 g/L,重組菌株CeBSGN6乙酰氨基葡萄糖最高產量出現在35 h,最高產量為24.23 g/L,較對照菌株提高了24.69%。GlcNAc生產強度和GlcNAc對細胞得率均高于其他6株菌株;但是對比細胞生產強度,重組菌株CeBSGN卻低于其他菌株。上述數據分析進一步驗證了重組菌株CeBSGN葡萄糖的消耗較其他六株重組菌株更多的用于產物GlcNAc的合成而非菌體量的增加,再一次驗證了重組菌CeBSGN6能夠更好地合成目的產物GlcNAc。
在搖瓶上進行初步篩選,獲得重組菌株CeBSGN最高GlcNAc產量達到7.31 g/L,為進一步驗證GlcNAc的產量,將重組菌株CeBSGN和對照菌株ScBSGN在3 L罐進行上補料分批發酵,發酵過程曲線如圖4所示。對照菌株ScBSGN6乙酰氨基

圖4CeBSGN6和ScBSGN6 3 L罐GlcNAc產量比較Fig.4 Comparison of CeBSGN and ScBSGN for GlcNAc production in 3 L fermentor
在維持葡萄糖質量濃度為5 g/L不變的情況下進行補料分批發酵,重組菌株CeBSGN和對照菌株ScBSGN發酵動力學參數如表5所示,重組菌株CeBSGN的細胞生產強度是對照菌株ScBSGN的3.82倍、GlcNAc生產強度是對照菌株ScBSGN的1.69倍、GlcNAc對細胞得率是對照菌株ScBSGN的2.53倍。綜上所述,表達了重組酶Cegna1的重組菌株CeBSGN能夠更好的利用葡萄糖合成目的產物GlcNAc。
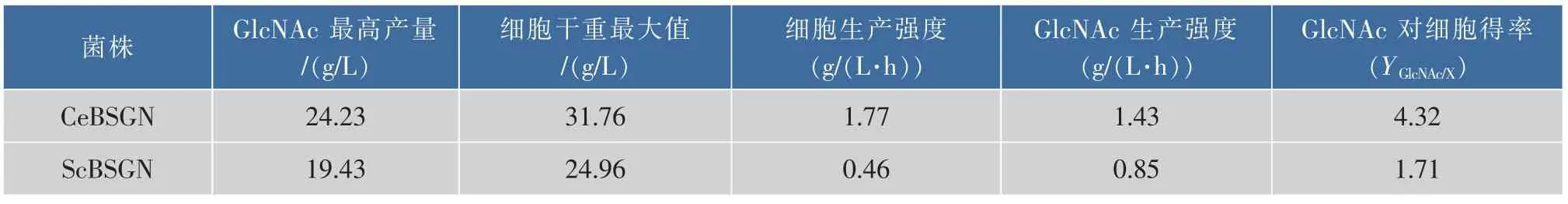
參數 表5 7株重菌株組菌株CeBSGN6和ScBSGN6生產GlcNAc的上罐發酵動力學參數比較Table 5 Comparison of GlcNAc shaking flask fermentation parameters on recombinant CeBSGN and ScBSGN
2.2 重組氨基葡萄糖乙酰轉移酶的分離純化及動力學分析
按1.2.4的方法對重組氨基葡萄糖乙酰轉移酶進行分離與純化,將純化后的蛋白按1.2.5的方法進行酶活測定,情況如圖5,重組菌株菌株CeBSGN的 Cegna1比酶活為 208.33 U/mg,比 CaBSGN、ScBSGN、Df BSGN、AfBSGN、OsBSGN、TbBSGN 分別高了 31.56%、28.29%、137.68%、198.08%、338.87%、344.20%。綜上,重組菌CeBSGN6中的重組酶Cegna1的催化效率最佳。
重組氨基葡萄糖乙酰轉移酶具體動力學參數如表6所示,Cegna1米氏常數Km相對小于其他6株重組菌株,而對應的催化效率Kcat/Km卻相對高于其他6株菌株。Helge C.Dorfmueller等人[17]已解析Cegna1的晶體結構,并發現Cegna1的空間位阻較小,底物更容易和酶的催化活性中心結合,并且2個底物GlcN-6P和Ac-CoA與活性中心形成多個氫鍵,更容易結合到活性中心。因此,重組Cegna1相比較其他六種重組酶均對GlcN-6P和Ac-CoA有較高的親和力和催化效率。

圖5 重組菌株GNA比酶活對比Fig.5 Comparison of recombinant strains GNA enzyme activity
對7株表達不同來源GNA的B.subtilis重組菌株進行篩選,發現表達了重組酶Cegna1的重組菌株CeBSGN能夠更好的利用葡萄糖合成目的產物GlcNAc,并且重組Cegna1相比較其他6種重組酶對GlcN-6P和Ac-CoA有較高的親和力和催化效率。因此,我們對篩選出的重組酶Cegna1進行酶學性質分析,以便為應用定向進化策略改造GNA的實現提供了理論依據。
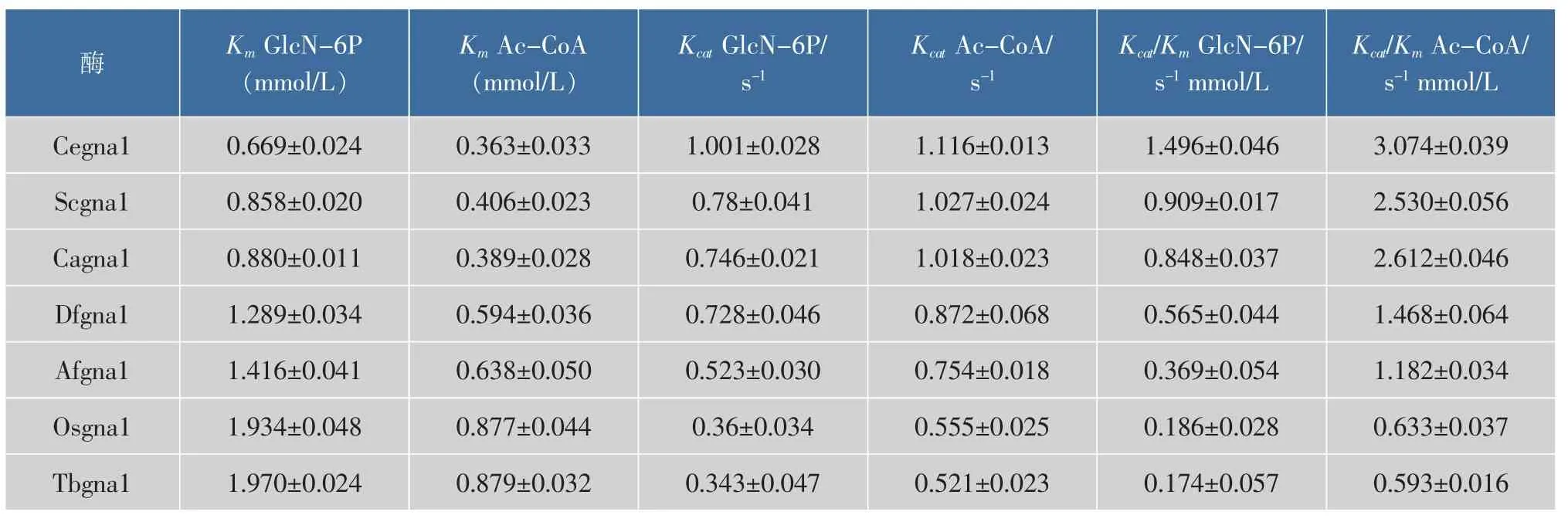
表6 重組菌株GNA動力學參數Table 6 Kinetic parameters of recombinant strains GNA
2.3 重組Cegna1酶學性質
2.3.1 重組Cegna1最適反應時間 50 mmol/L Tris緩沖液(pH 7.5)中,測定Cegna1在酶活反應0~10 min之間催化酶活力,以反應時間為5 min時的酶活力為相對酶活100%。由圖6可知,在反應0~2 min,酶活隨時間延長而迅速升高,在5~6 min,Cegna1催化效率最大,相對酶活可達到103%,在6~10 min,催化效率略有下降,基本能保持穩定。

圖6 重組Cegna1酶活隨反應時間的變化Fig.6 Influence of reaction time on enzyme activities of recombinant Cegna1
2.3.2 重組Cegna1最適反應溫度 50 mmol/L Tris緩沖液(pH 7.5)中,測定Cegna1在10~90℃之間催化酶活力,以初始溫度30℃時的酶活力為相對酶活100%。從圖7可得:當溫度低于37℃時,催化效率隨溫度的升高而快速增加;當反應溫度為37℃時,催化效率最大;當溫度在37~50℃時,催化效率迅速降低;當反應溫度在50~90℃時,酶活基本維持在65%。
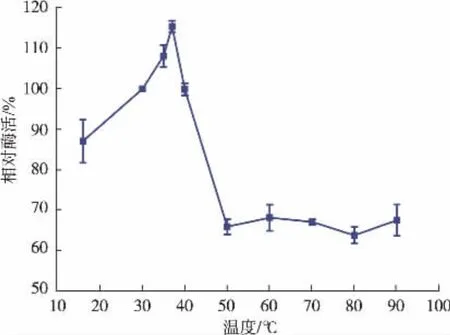
圖7 重組Cegna1酶活隨反應溫度的變化Fig.7 Influence of reaction temperature on enzyme activities of recombinant Cegna1
2.3.3 重組Cegna1最適反應PH 以不同pH的緩沖液 (pH 3~10,50 mmol/L Tris緩沖液)稀釋Cegna1酶液與底物至設定 pH,測定Cegna1催化活力,以初始PH 7.5時的酶活力為相對酶活100%。由圖8可知,在PH值3~10的范圍內,重組Cegna1均能保持75%以上的活性,具有較寬的PH適應范圍,最適反應PH為7。在酸性條件下,催化效率隨著PH值下降而迅速降低;在堿性條件下,催化效率隨PH值升高而下降較緩,PH為10時,仍保留著較高酶活,表明重組Cegna1相對酸性環境在堿性環境中更加穩定。

圖8 重組Cegna1酶活隨反應PH的變化Fig.8 Influence of reaction PH on enzyme activities of recombinant Cegna1
2.3.4 重組Cegna1熱穩定性分析 將酶液在不同溫度下保溫不同時間,迅速冷卻,pH 7.5,30℃測定殘余Cegna1酶活,以未保溫的酶活力為相對酶活100%,計算相對酶活力。由圖9可知,在4℃和30℃條件下Cegna1具有最大的催化活性,低溫下仍能保持較高酶活熱穩定均沒有什么明顯變化;當溫度超過30℃時,催化效率隨溫度的升高而迅速降低。40℃,100 min內Cegna1能保持 80%以上的活性,而在 60℃條件下,100 min內 Cegna1仍能保持45%以上的酶活。
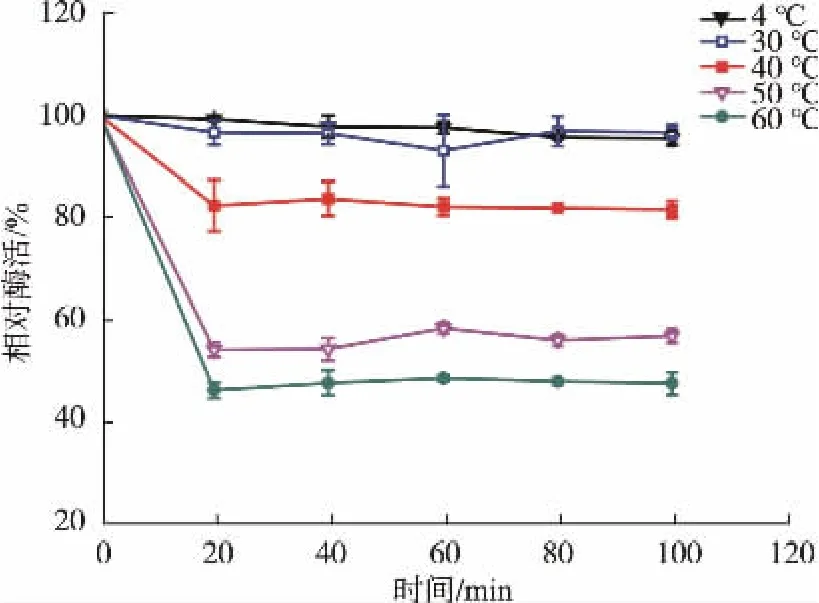
圖9 重組Cegna1熱穩定性Fig.9 thermostability on enzyme activities of recombinant Cegna1
2.3.5 Cegna1的反應動力學的研究 為了研究重組Cegna1的反應動力學,分別以Acetyl-CoA和GlcN-6P為底物,固定一種底物濃度(如Acetyl-CoA)的情況下研究不同濃度的另一種底物(如GlcN-6P)對GlcNAc合成的影響。通過不同底物濃度測定重組Cegna1的酶活,最終獲得Lineweaver-Burk雙倒數(圖10所示)。從圖中可以看出,固定不同濃度的一種底物的情況下,不同濃度的另一底物的倒數為橫坐標,對應的GlcNAc合成速率倒數為縱坐標,擬合得到的直線相交于一點,進一步進行數據擬合,發現其符合序列機制的底物動力學方程1,雙底物反應機制為序列反應。
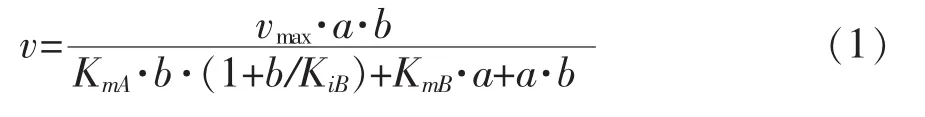
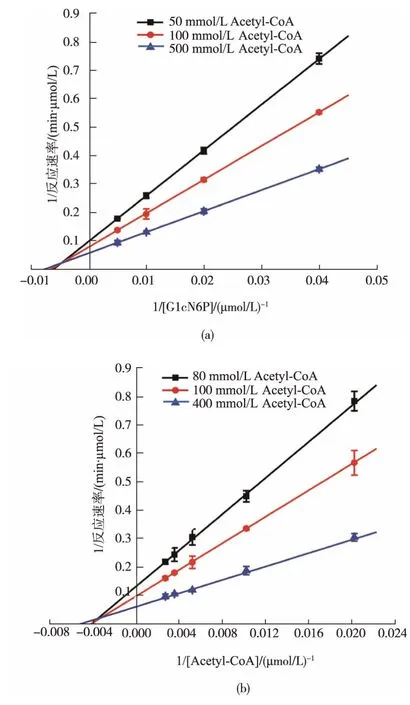
圖10 重組Cegna1催化生產GlcNAc-6P的Lineweaver-Burk雙倒數曲線Fig.10 Lineweaver-Burk plots of the GlcNAc-6P biosynthesis by the recombinant Cegna1
2.3.6 底物與產物對重組Cegna1抑制分析 為了研究底物Acetyl-CoA和 GlcN-6P與產物GlcNAc對的抑制情況,固定Acetyl-CoA和GlcN-6P底物濃度為200 μmol/L,分別向反應體系中加入0~60 mmol/L的添加物Acetyl-CoA、GlcN-6P和GlcNAc,結果如圖 11所示。 由圖11(a)可得,GlcNAc和Acetyl-CoA對重組Cegna1無明顯抑制作用;由圖11(b)可得,底物GlcN-6P對重組Cegna1的抑制作用明顯,5 mmol/L GlcN-6P已可對重組Cegna1的造成明顯抑制作用,采用GraphPad Prism計算抑制常數Ki值,求得重組Cegna1 對 GlcN-6P 的 Ki值為(1.880±0.472) mmol/L,下一步可采用定向進化策略改造Cegna1,解除底物GlcN-6P對重組Cegna1的抑制作用。

圖 11 GlcNAc、Acetyl-CoA(a)及 GlcN-6P (b)對重組Cegna1的抑制情況Fig.11 Inhibition of Cegna1 activity with increasing concentrations of GlcNAc,Acetyl-CoA (a)and GlcN-6P(b).
3 結 語
本文通過在枯草芽孢桿菌中異源表達7種不同來源的氨基葡萄糖乙酰化酶,篩選出秀麗隱桿線蟲來源的氨基葡萄糖乙酰化酶(Cegna1)能夠更有效的積累乙酰氨基葡萄糖搖瓶水平上產量達到7.31 g/L,相較于過量表達來源于釀酒酵母的氨基葡萄糖乙酰化酶編碼基因的對照菌株,GlcNAc的產量提高了24.51%。在3 L發酵罐中,GlcNAc產量達到24.23 g/L,相較于對照菌株GlcNAc的產量提高了24.69%。進一步研究7株重組酶的動力學參數米氏常數Km與 Kcat/Km發現重組Cegna1相比較其他6種重組酶均對GlcN-6P和Ac-CoA有較高的親和力和催化效率。對篩選出的重組Cegna1酶學性質進行研究發現重組Cegna1最適反應時間為5~6 min,最適反應溫度為37℃,最適反應PH為7,熱穩定性良好,雙底物反應機制為序列反應。最后發現底物GlcN-6P對重組Cegna1的抑制作用明顯,下一步可采用定向進化策略改造Cegna1,解除底物GlcN-6P對重組Cegna1的抑制作用。

