釀酒酵母孢子作為GLP-1載體的研究
黃丹娣, 張慧杰, 閆 聽, 馮詩倪, 中西秀樹, 高曉冬
(江南大學 生物工程學院,江蘇 無錫 214122)
糖尿病是目前危害人類健康的主要疾病之一,它是一種有遺傳傾向的內分泌代謝疾病,以高血糖和高血糖繼發的脂肪、蛋白質、水、電解質紊亂為特征。最新數據顯示糖尿病患者的人數將在2030年上升到3.6億[1]。而在我國,近年來隨著人們生活水平的提高,糖尿病的發病率迅速提高,患病人數已經超過了1億人,其中,絕大多數為二型糖尿病患者。糖尿病可引起包括心腦血管疾病在內的多種并發癥,因此,糖尿病的防治已成為人們最為關注的熱點之一。
二型糖尿病又被稱為非胰島素依賴糖尿病,患者本身仍產生胰島素,然而由于胰島β細胞功能低下和胰島素抵抗,患者對胰島素的利用卻大打折扣[2]。目前,二型糖尿病患者的治療手段主要包括使用胰島素和降糖藥物等。雖然這些藥物能夠有效降低血糖,但是也存在一些問題,例如會導致患者低血糖以及體重的增加等。此外,這些藥物只能延緩病情,無法恢復胰島β細胞功能,從而無法從根本上使病情得到控制。因此,開發安全有效的糖尿病治療藥物,已成為現代科學家的研究熱點[3]。
胰高血糖素樣肽-1(Glucagon-like peptide-1,GLP-1)含有37個氨基酸,是已發現的促胰島素分泌作用最強的腸肽類激素。GLP-1的生物活性形式有2種,分別為GLP-1(7-37)和GLP-1(7-36)酰胺。GLP-1可以從多個方面發揮作用,如抑制胃排空,抑制胰高血糖素的分泌,降低血糖等[4],并且能夠恢復胰島β細胞功能。更為重要的是,GLP-1的作用具有葡萄糖濃度依賴性,僅在葡萄糖濃度較高時才發揮作用,因此不會導致由于使用過度而導致的低血糖問題。GLP-1已成為未來治療二型糖尿病的安全有效的多肽藥物[5]。然而天然的GLP-1(7-36)容易被二肽基肽酶(DPP-IV)降解為無活性的GLP-1(9-36),且由于其相對分子質量較小從而易被腎清除,因此導致GLP-1在人體內半衰期不足2 min,這大大限制了其臨床應用。因此,科學家正致力于研究如何延長其在體內的半衰期從而提高其生理活性。目前的研究主要集中在以下幾個方面:篩選GLP-1類似物,例如艾塞那肽,利拉魯肽[6];對天然GLP-1進行結構改造,如GLP-1的N端修飾、脂肪酸修飾GLP-1等[7];將GLP-1與生物大分子蛋白偶聯,如人清蛋白[8],IgG重鏈結合蛋白IgG-Fc[9]等,以及將GLP-1串聯表達等,均取得了一定的效果。此外,傳統的多肽類藥物以及胰島素需要注射使用,這讓病人痛苦不堪。研究發現,GLP-1可以以活性形式被腸道直接吸收進入血液,通過血液循環直接與胰島細胞表面的GLP-1受體結合并最終促進胰島素的釋放[10]。因此,若能夠通過一些方法延長其在體內的半衰期,提高其利用率,并選擇合適的載體構建口服GLP-1藥物,將為有效治療糖尿病提供更有力的方法,并具有巨大的科學意義和市場潛力[11]。
釀酒酵母是單細胞真核生物,其完整的基因組在1996年便已完成測序。釀酒酵母培養簡單,生長迅速,且易于進行基因改造,被最早應用于酵母基因克隆和表達宿主菌及人源化蛋白[12]。釀酒酵母的細胞有2種生活形態,單倍體和二倍體。二倍體細胞可在營養匱乏的條件下減數分裂生成孢子,一個母細胞可分裂成4個孢子。釀酒酵母孢子易于獲得,安全無毒,可以食用。釀酒酵母的孢子壁與母細胞相比有明顯的不同。如圖1所示,成熟的孢子壁從內到外分別是甘露糖層、β-葡聚糖層、殼聚糖層和二酪氨酸層。而釀酒酵母從內到外僅有β-葡聚糖層、甘露糖層。孢子特有的二酪氨酸層具有保護孢子抵御外界環境壓力的能力。因此,在口服過程中,孢子壁可以保護孢內表達的外源蛋白抵抗一定的蛋白酶降解及胃酸低pH的影響。
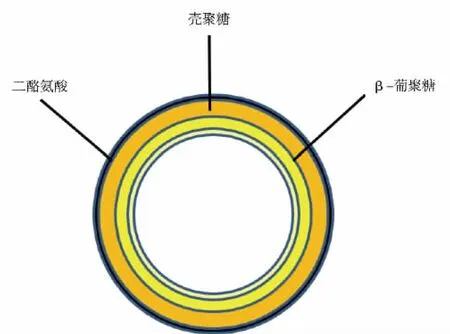
圖1 釀酒酵母孢子壁的結構Fig.1 Structure of yeast spore wall
本研究擬利用釀酒酵母孢子構建GLP-1可口服給藥體系。通過串聯表達GLP-1,突變GLP-1部分堿基等方式對GLP-1進行改造,并同時將改造后的GLP-1表達到釀酒酵母孢子內以提高GLP-1抗酶解能力和體內半衰期。通過模擬腸胃液處理實驗,體外刺激小鼠胰島β細胞分泌胰島素等實驗證實了所構建的GLP-1給藥體系的有效性。
1 材料與方法
1.1 實驗材料
1.1.1 菌株和質粒 釀酒酵母AN120野生型菌株,dit1Δ缺陷型菌株,小鼠胰島β細胞株MIN6細胞(江南大學食品學院孫佳教授饋贈),大腸桿菌DH5α。
pBlueScriptⅡSK(+)質粒,pRS424-TEFpr為本實驗室保存質粒,pRS424-TEFpr-8*GLP-1-GFP和pRS424-TEFpr-ss-8*GLP-1-GFP為本研究所構建的質粒。
1.1.2 培養基 LB培養基:酵母提取物10 g,胰蛋白胨10 g,氯化鈉 10 g,瓊脂粉 20 g(固體),加水至1 L,121℃高壓滅菌20 min。
SD-Trp培養基:無氨基酵母氮源(YNB)6.7 g,瓊脂粉20 g(固體),加水至900 mL,121℃高壓滅菌20 min,使用前加入2 g缺少色氨酸(Trp)的氨基酸粉末以及100 mL滅菌的20 g/dL的葡萄糖溶液。
YPAD培養基:酵母提取物10 g,蛋白胨20 g,腺嘌呤0.03 g,瓊脂粉20 g(固體),加水至900 mL,121℃高壓滅菌20 min,使用前加入100 mL滅菌的20 g/dL的葡萄糖溶液。
YPACe培養基:酵母提取物10 g,蛋白胨20 g,腺嘌呤0.03 g,瓊脂粉20 g,乙酸鉀20 g,加水至1 L,121℃高壓滅菌20 min。
產孢培養基:乙酸鉀20 g,加水至1 L,121℃高壓滅菌20 min。
1.2 實驗方法
1.2.1 大腸桿菌質粒的構建 GLP-1的活性區域含有36個氨基酸,其氨基酸序列從NCBI中獲得,如圖2所示。為了防止其被二肽基肽酶(DPP-IV)和胰蛋白酶(Trypsin)降解,我們對其非保守序列的第2位、第20位、第28位的氨基酸進行了修改優化,已有文獻證明這3個位點的改變并不影響GLP-1的生理活性。同時,為了在孢子內大量表達GLP-1并防止GLP-1被降解,將其4串聯表達,并在序列首尾設計了相應的酶切位點,以方便后面的基因操作。此外,為了防止同源重組,對不同串聯序列的一些堿基也做了微調,整個4*GLP-1序列也根據釀酒酵母偏愛密碼子進行了優化,并由上海生工生物公司合成。
合成的4*GLP-1序列首尾兩端各設計了2個酶切位點,分別為BamHⅠ、SmaⅠ、EcoRⅠ以及EcoRⅤ。大腸桿菌質粒表達載體的構建流程如圖3所示。由于pRS424-TEFpr質粒本身有2個EcoRⅤ酶切位點,無法用于直接構建8*GLP-1重組質粒,因此選擇pBlueScriptⅡSK(+)作為出發質粒。首先為了方便檢測目的蛋白的表達和定位,以pRS424-TEFpr-GFP為模板,通過PCR的方法將綠色熒光蛋白GFP編碼序列連接到載體,分別在5’和3’端加入EcoRⅠ以及XhoⅠ酶切位點。引物序列如下:
上游引物:
5’-CCGGAATTCAAAGGAGAAGAACTTTTCAC-3’下游引物:
5’-CCGCTCGAGTTATTTGTATAGTTCATCCATGC-3’
PCR獲得目的條帶之后,通過酶切連接的方法,將GFP基因序列連接到pBlueScriptⅡSK(+)載體上,轉化大腸桿菌DH5α,挑取4-6個單菌落于LB-AMP液體培養基中,于37℃搖床過夜培養,隨后通過菌液PCR鑒定陽性轉化子,再提取陽性轉化子的質粒,進行酶切驗證。
接著為構建pBlueScriptⅡSK (+)-4*GLP-1-GFP,用BamHⅠ、EcoRⅠ雙酶切4*GLP-1條帶和pBlueScriptⅡSK(+)-GFP重組質粒,連接產物轉化大腸桿菌DH5α,于LB-AMP培養基挑取陽性轉化子。為構建重組質粒pBlueScriptⅡSK(+)-8*GLP-1-GFP,用 SmaⅠ、EcoRⅤ雙酶切目的條帶,用 SmaⅠ單酶切重組質粒pBlueScriptⅡSK (+)-4*GLP-1-GFP,獲得兩端為平末端的片段,連接轉化大腸桿菌DH5α,挑取一定數量的單菌落進行酶切驗證。并挑取陽性單菌落于LB-AMP液體培養基中37℃過夜培養以擴增重組質粒,重組質粒用小提質粒試劑盒提取。
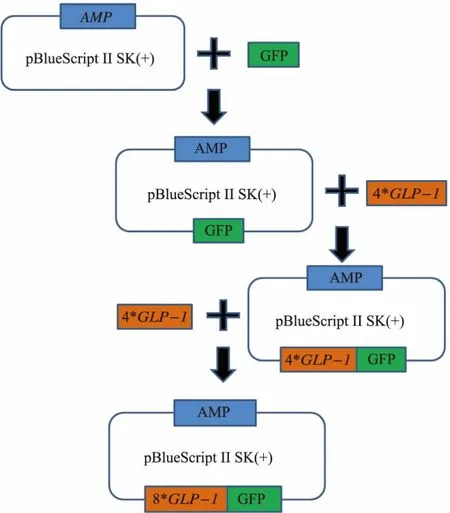
圖3 質粒構建流程Fig.3 Construction of plasmid pBlueScriptⅡSK (+)-8*GLP-1-GFP
1.2.2 釀酒酵母質粒表達載體的構建 為使目的蛋白能夠在釀酒酵母孢子內表達,首先,需構建釀酒酵母轉化質粒pRS424-TEFpr-8*GLP-1-GFP,通過BamHⅠ、XhoⅠ雙酶切重組質粒將8*GLP-1-GFP序列切下來再連接到pRS-424-TEFpr表達載體上,連接產物轉化大腸桿菌,為使目的蛋白8*GLP-1能夠定位在釀酒酵母孢子壁上,需在目的蛋白前添加信號肽序列ss片段。因ss片段大小不足100 bp,本文采用將TEF啟動子與ss序列一同PCR的方法,獲得TEFpr-ss片段以替代重組質粒上的TEF啟動子序列。以pRS424-TEFpr-ss-3HA為模板,通過PCR的方法獲得TEFpr-ss序列,分別在兩端引入SacⅠ和BamHⅠ酶切位點。引物序列如下:上游引物:
5’-GCTGGAGCTCATAGCTTCAA-3’
下游引物:
5’-CCGGATATCGGAAACAGGATTACAG-3’
最終獲得pRS424-TEFpr-8*GLP-1-GFP以及pRS424-TEFpr-ss-8*GLP-1-GFP重組質粒 (圖4-5),構建好的質粒由上海生工測序。
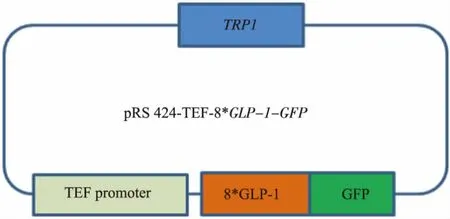
圖4pRS424-TEFpr-8*GLP-1-GFP重組質粒Fig.4Plasmid pRS424-TEFpr-8*GLP-1-GFP
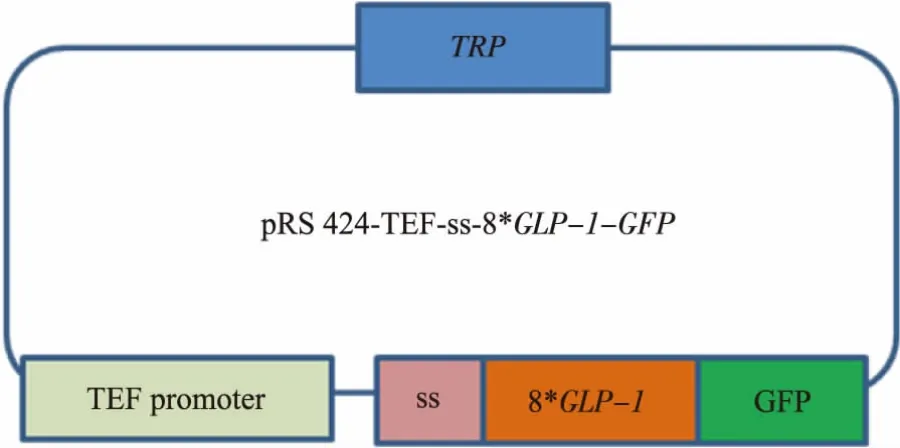
圖5pRS424-TEFpr-ss-8*GLP-1-GFP重組質粒Fig.5 Plasmid pRS424-TEFpr-ss-8*GLP-1-GFP
1.2.3 GLP-1重組蛋白在釀酒酵母孢子的表達以及孢子的純化 將得到的重組質粒通過一步轉化法轉入到釀酒酵母后,涂相應缺陷平板,2天后長出的單菌落即為成功轉入重組質粒的酵母。挑取一個單菌落接種于5 mL SD-Trp培養基的試管中,并于30℃、220 r/min的搖床過夜培養。12 h后取1 mL菌液轉入盛有50 mL的YPACe液體培養基的250 mL三角瓶中,于30℃、220 r/min搖床預產孢24 h;6 000 r/min離心2 min收集菌體,用產孢培養基重懸,并全部轉入250 mL的三角瓶中(無菌操作),于30℃,220 r/min搖床培養 24 h;取 5~10 μL產孢培養基中的菌液,于顯微鏡下觀察酵母產孢情況,正常可以看到視野中有大量四聯球形態的子囊細胞。
為了使單個孢子能夠從子囊孢子中釋放出來,需對重組酵母的子囊孢子進行進一步處理,8 000 r/min離心收集孢子,并重懸于2 mL原生質體buffer中,充分混勻后加入約 100 μL 的 lyticase(1 mg/mL),并置于37℃的搖床處理3 h,隨后超聲破碎以獲得單個孢子。為進一步除去孢子部分破碎的子囊壁和裂解酶,以獲得純凈的孢子。需對超聲破碎的孢子進行純化處理:首先需配制體積分數50%、60%、70%、80%梯度的Percoll溶液,配方如下:5mL Pecoll、4mL體積分數0.5%Triton X-100,1 mL 2.5 mol/L蔗糖;6 mL Pecoll,3 mL 體積分數 0.5%Triton X-100,1 mL 2.5 mol/L 蔗糖;7 mL Pecoll,2 mL 體積分數 0.5%Triton X-100,1mL 2.5 mol/L 蔗糖;8 mL Pecoll,1 mL體積分數 0.5%Triton X-100,1 mL 2.5 mol/L蔗糖。接著將超聲破壁過的孢子懸浮液用5 mL體積分數0.5%Triton X-100洗滌一遍,并溶解在1 mL的體積分數0.5%Triton X-100中,將體積分數80%、70%、60%、50%梯度的Percoll溶液各取 1 mL,沿離心管壁緩慢依次加入10 mL離心管中,最后加入1 mL溶解在體積分數0.5%Triton X-100中的孢子液;4℃、15 000 r/min離心約30 min后,梯度溶液會分層,用移液槍吸取孢子懸浮的一層于干凈離心管中,用5 mL 0.6 mol/L NaCl溶液洗滌1次;接著用1 mL體積分數0.5%Triton X-100洗滌2次;最后將純化后的孢子置于冷凍干燥機中(-50℃,72 Pa)24 h后取出備用。
1.2.4 GLP-1重組蛋白的檢測 為了檢測目的蛋白是否成功表達,需提取重組酵母孢子內的全蛋白進行Western blot檢測,具體方法為:離心收集約5 mL培養基的菌體于1.5 mL離心管中,用dd水洗2遍后用500 μL S buffer重懸,再加入5 μL的溶壁酶(lyticase),于30℃酶解30 min。離心收集沉淀并用 S buffer洗2遍后,加入400 μL lysis buffer重懸,再加入適量玻璃珠以及4 μL PMSF (100 mmol/L),于冰上破碎,具體步驟為冰上靜置1 min,再于振蕩器振蕩1 min,如此循環15次后,于4℃、1 000 g離心10 min,取上清液3 000 g離心10 min進一步去除細胞碎片。所得的上清液即為提取的釀酒酵母全蛋白。全蛋白用Western blot進一步檢測目的蛋白是否表達,Anti-GFP mouse和 Goat Anti-mouse lgGHRP分別作為一抗和二抗。
在Western blot檢測到目的條帶后,通過熒光顯微鏡檢測熒光信號來進一步確定GLP-1在孢子中的表達位置。首先重接種釀酒酵母并產孢,產孢過程同上,獲得四聯球孢子后,收集約5 mL菌液的孢子,并用dd水洗2遍后重懸,調節一定的濃度,取5 μL于載玻片上,并盡快置于熒光顯微鏡下,使用100×油鏡觀察檢測GFP熒光信號,獲得的熒光照片由NIS-Element AR軟件分析。
1.2.5 釀酒酵母孢子給藥體系的體外活性檢測在確定目的蛋白成功表達后,接下來要對釀酒酵母孢子給藥體系的活性進行檢測。為模擬人體內部消化環境,首先用模擬腸胃液對孢子載藥體系進行處理。處理流程圖如圖6所示,首先,稱取10 mg孢子粉,溶于10 mL模擬胃液中,于37℃、180 r/min搖床消化處理2 h,其中模擬腸胃液的配方為:2.0 g氯化鈉、3.2 g胃蛋白酶、7 mL HCL,溶解于 1 L ddH2O。隨后于模擬胃液中加入NaHCO3并調節pH至7.5,再加入胰酶至終質量濃度為10 g/L,配制成模擬腸液,同樣于37℃搖床處理4 h。隨后為使蛋白酶失活,將樣品置于金屬浴中100℃熱處理5 min,然后迅速冷卻至室溫。離心管于3000r/min離心20min,收集上清液后置于真空冷凍干燥機中凍干備用。
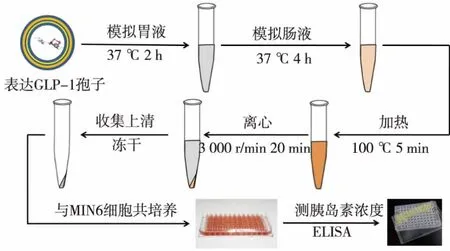
圖6 給藥體系體外活性檢測過程Fig.6 Detection of in vitro activity of the drug deliverysystem
為檢測經模擬腸胃液處理后的消化產物是否具有促胰島素釋放的作用,需將凍干產物與MIN6細胞共培養并檢測上清液中的胰島素濃度。將MIN6細胞接種于96孔板上,接種密度為2×104個/孔,分為空白對照組和實驗組,每組3個平行樣。培養24 h后,取凍干的消化產物,重懸于100 μL的細胞培養基中,再取10 μL加入96孔板的樣品孔中,與MIN6細胞共培養2 h,隨后取上清液,并按照小鼠胰島素ELISA試劑盒的操作步驟進行胰島素水平的測定。
2 結果與分析
2.1 重組質粒的構建
為了能夠將GLP-1表達到釀酒酵母內,需要構建pRS424-TEFpr-8*GLP-1-GFP以及pRS424-TEFpr-ss-8*GLP-1-GFP重組質粒,為使重組蛋白能夠定位在釀酒酵母孢子壁上,需在目的蛋白前添加信號肽序列ss片段。因ss片段大小不足100 bp,本文采用將TEF啟動子與ss序列一同PCR的方法,獲得TEFpr-ss片段以替代重組質粒上的TEF啟動子序列。以pRS424-TEFpr-ss-3HA為模板,通過PCR的方法獲得TEFpr-ss序列,分別在兩端引入SacⅠ和BamHⅠ酶切位點。最終獲得pRS424-TEFpr-8*GLP-1-GFP以及pRS424-TEFpr-ss-8*GLP-1-GFP重組質粒,構建好的質粒首先經過SacⅠ和 BamHⅠ雙酶切驗證(圖 7),圖 7 (a)在 2號泳道有一條約1 490 bp的條帶,與序列8*GLP-1-GFP的長度一致。圖7(b)亦在500 bp(序列TEFprss)處檢測到條帶。在酶切驗證后重組質粒由上海生工進行進一步的確認。

圖7 重組質粒酶切電泳Fig.7 Agarose gel electrophoresis of recombinant plasmid
2.2 8*GLP-1-GFP重組蛋白的表達
為檢測目的蛋白是否成功表達,我們將pRS424-TEFpr-8*GLP-1-GFP和pRS424-TEFpr-ss-8*GLP-1-GFP重組質粒轉化到釀酒酵母AN120野生型菌株,dit1Δ缺陷型菌株內,產孢獲得相應重組酵母孢子并提取蛋白。利用Western blot檢測目的蛋白條帶,從圖 8 可看出,在 55×103(8*GLP-1-GFP)左右有明顯的條帶。在野生型中,相對于胞內表達的重組體系,表達在孢子壁上的目的蛋白量明顯較多,可能是由于表達到孢子壁上的重組蛋白可防止被內部酶解。而在二酪氨酸缺陷型孢子中,情況正好相反,可能是由于其缺少最外層的二酪氨酸,從而導致大量的重組蛋白分泌到胞外。
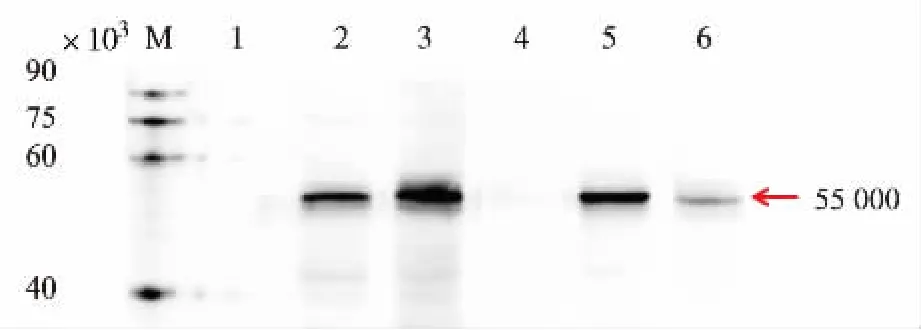
圖8 8*GLP-1-GFP重組蛋白表達的Western blot驗證Fig.8 Western blotting analysis of 8*GLP-1 expressed in yeast spore
2.3 8*GLP-1-GFP重組蛋白的在釀酒酵母孢子的定位
我們進一步通過GFP的熒光定位來確定GLP-1 在孢子中的位置。 圖 9 中(b)、(e)為胞內表達,可以檢測到明顯的熒光,(c)、(f)為胞子壁表達,其熒光強度明顯低于胞內表達,且似乎有少量泄露到子囊殼內。熒光定位實驗進一步證明了重組蛋白8*GLP-1被成功表達到釀酒酵母孢子內。
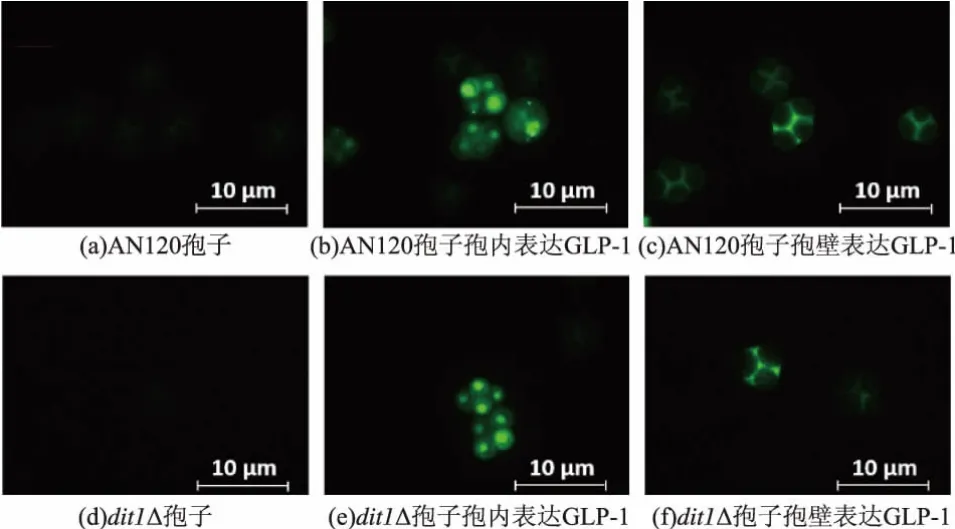
圖9 8*GLP-1-GFP重組蛋白在孢子內的熒光定位Fig.9 Localization of 8*GLP-1-GFP in yeast spore
2.4 釀酒酵母孢子載藥體系的體外活性檢測
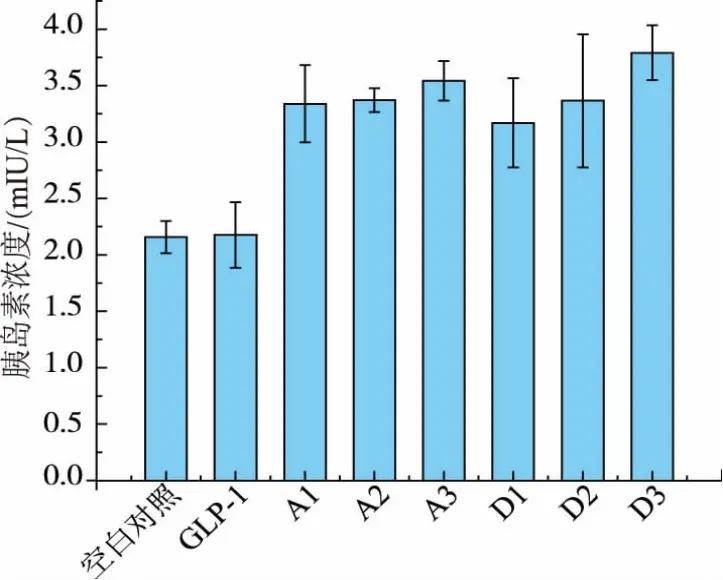
圖10 GLP-1刺激MIN6細胞分泌胰島素結果Fig.10 Insulin secretion stimulated by GLP-1
在確定目的蛋白成功表達后,我們進一步對釀酒酵母孢子GLP-1載藥體系的體外活性進行檢測。將經模擬腸胃液處理后的載GLP-1孢子與MIN6共培養,并用ELISA方法檢測胰島素濃度。如圖10所示,與單純的GLP-1相比,表達了GLP-1重組蛋白的孢子能夠顯著促進胰島素的分泌,同時,胞子壁表達與胞內表達的效果差別不大。說明無論是表達到孢子壁還是表達到孢內,孢子都可以對所表達的GLP-1具有一定的保護作用,并提高其促胰島素活性。
3 結 語
糖尿病作為影響現代人生命健康的一大疾病,至今仍無有效的解決方法。GLP-1及其類似物已成為研究治療二型糖尿病的熱點。本文首先對GLP-1進行基因改造及串聯表達,然后選擇釀酒酵母孢子作為表達和運輸載體構建GLP-1口服給藥體系。本文構建了重組GLP-1質粒并成功在釀酒酵母孢子內表達,形成表達8串聯GLP-1的釀酒酵母孢子載藥體系。該體系在經過模擬腸胃液處理后能有效刺激MIN6細胞分泌胰島素,證明了所構建的GLP-1給藥體系的有效性。綜上,本研究為進一步開發治療糖尿病的口服藥物提供了新的思路。

