二輪復習中與用量有關離子反應的定量思考
2019-04-24 07:38:14四川唐金能
教學考試(高考化學) 2019年1期
四川 唐金能
離子反應是歷年高考的重要考點,與用量有關的離子方程式的書寫和正誤判斷更是考試中的難點,該類試題雖然難度不大,但卻是許多學生的失分點。下面筆者就高考前的二輪復習,立足于高中學生化學的理論水平基礎,談談與用量有關的離子反應在復習中如何進行定量思考。
學生通過高中化學的學習與一輪復習,應該能認識到離子反應之所以能發生,是因為這些離子共存時能發生反應導致離子濃度減小,而與用量有關的離子反應,為什么用量不同,離子方程式就不同?下面舉例說明。
這樣的離子反應,所給出的反應物相互反應時,涉及的不是一個離子反應,而是多個,所給的量始終不能同時滿足兩個或多個離子反應同時完全進行,所以就和用量有關了!
例1.Ca(HCO3)2溶液與NaOH溶液反應。為表達方便,令n(NaOH)∶n[Ca(HCO3)2]=k,在平時的教學和復習中,許多老師們主要給學生講解的是這樣兩種情況:



例2.連續用量的離子反應,如CO2逐漸緩慢通入含有1 mol NaOH溶液中,令n(NaOH)∶n(CO2)=k,平時簡單理解為兩種情況:




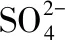
例4.氧化還原反應類型與用量有關的離子反應,如Fe與稀HNO3溶液反應,重點介紹了以下兩種情況:


又如:將Fe(NO3)3溶液與HI混合反應,令n[Fe(NO3)3]∶n(HI)=k,



其他例子:Cl2通入一定量的FeBr2溶液中、Cl2通入一定量的FeI2和FeBr2的混合溶液中、SO2通入Ca(ClO)2溶液的反應等。

猜你喜歡
云南化工(2021年9期)2021-12-21 07:44:22
云南化工(2021年6期)2021-12-21 07:31:40
云南化工(2021年6期)2021-12-21 07:31:38
作文大王·笑話大王(2021年4期)2021-04-26 19:00:35
中學生數理化(高中版.高考理化)(2020年3期)2020-05-30 12:26:34
中學生數理化·高一版(2020年2期)2020-04-21 07:42:48
電影(2018年9期)2018-11-14 06:57:21
作文世界(小學版)(2018年4期)2018-10-16 17:13:34
快樂作文·低年級(2016年12期)2017-01-03 20:52:44
快樂作文·低年級(2016年6期)2016-06-24 18:58:40

