黔產淡黃花百合中多糖含量的測定
黃芯琦,周小媚,鐘可,2*,劉珂,楊婷婷,張丹
(1.貴陽中醫藥大學,貴州 貴陽 550025;2.國家苗藥工程技術研究中心,貴州 貴陽 550025)
百合科百合屬植物淡黃花百合(LiliumsulphureumBaker)是山百合藥材的基原之一,收載于2003版《貴州省中藥材、民族藥材質量標準》,藥用部位為干燥的肉質鱗葉,是貴州省常用的民族民間藥,具有清心安神,養陰潤肺之功效[1]。多糖是百合科百合屬植物的活性成分之一,具有抗腫瘤、抗氧化、抗疲勞、降血糖、調節免疫力等藥理作用[2-4]。目前,有關山百合藥材中多糖含量的研究尚未見報道,本文擬以黔產淡黃花百合為實驗對象,采用苯酚-硫酸法測定其多糖的含量,并對顯色條件、提取條件進行了摸索考察,建立最佳的含量測定方法。對貴州不同產地的淡黃花百合的多糖含量進行了測定,為山百合藥材質量研究提供參考。
1 材料
1.1 材料與試劑
實驗所用淡黃花百合采自貴州省,均為野生品,來源見表1,經貴陽中醫學院張文龍副教授和鐘可副教授鑒定為百合科植物淡黃花百合LiliumsulphureumBaker。鱗莖放入烘箱低溫烘干,粉碎過4號篩備用。D-無水葡萄糖(中國食品藥品檢定研究院,批號110833-201506,僅供國家藥品標準檢驗用);95%乙醇(國藥集團化學試劑有限公司,AR,批號:20151222);苯酚(重慶川東化工有限公司,AR,批號:20130501);濃硫酸(重慶川東化工有限公司,AR,批號:20160601);實驗用水均為娃哈哈純凈水。
1.2 儀器
紫外分光光度計(上海元析儀器有限公司,UV—5900);電子天平(XS205,瑞士梅特勒公司);回流裝置;水浴鍋(常州澳華儀器有限公司,HH-6);數顯電熱鼓風干燥箱(上海博訊公司,GZX-9070MBE)。
2 方法與結果
2.1 對照品溶液的配制
精密稱取D-無水葡萄糖對照品10.02 mg于50 mL的容量瓶中,加水至刻度,搖勻,得到濃度為0.200 4 mg/mL的葡萄糖對照品儲備液。
2.2 檢測波長的確定
精密移取2.1項下對照品溶液2 mL于15 mL具塞試管中,精密加入5%苯酚1 mL和濃硫酸5 mL[5-6],搖勻,常溫避光靜置顯色40 min,以相應試劑為空白,掃描吸收光譜(200~800 nm)。見圖1。
精密移取2.5.3項下供試品溶液2 mL于15 mL具塞試管中,精密加入5%苯酚1 mL和濃硫酸5 mL,搖勻,常溫避光靜置顯色40 min,以相應試劑為空白,掃描吸收光譜(200~800 nm)。見圖2。
掃描結果表明,在489.5 nm處葡萄糖對照品和樣品溶液有最大吸收,故選擇489.5 nm為測定波長。
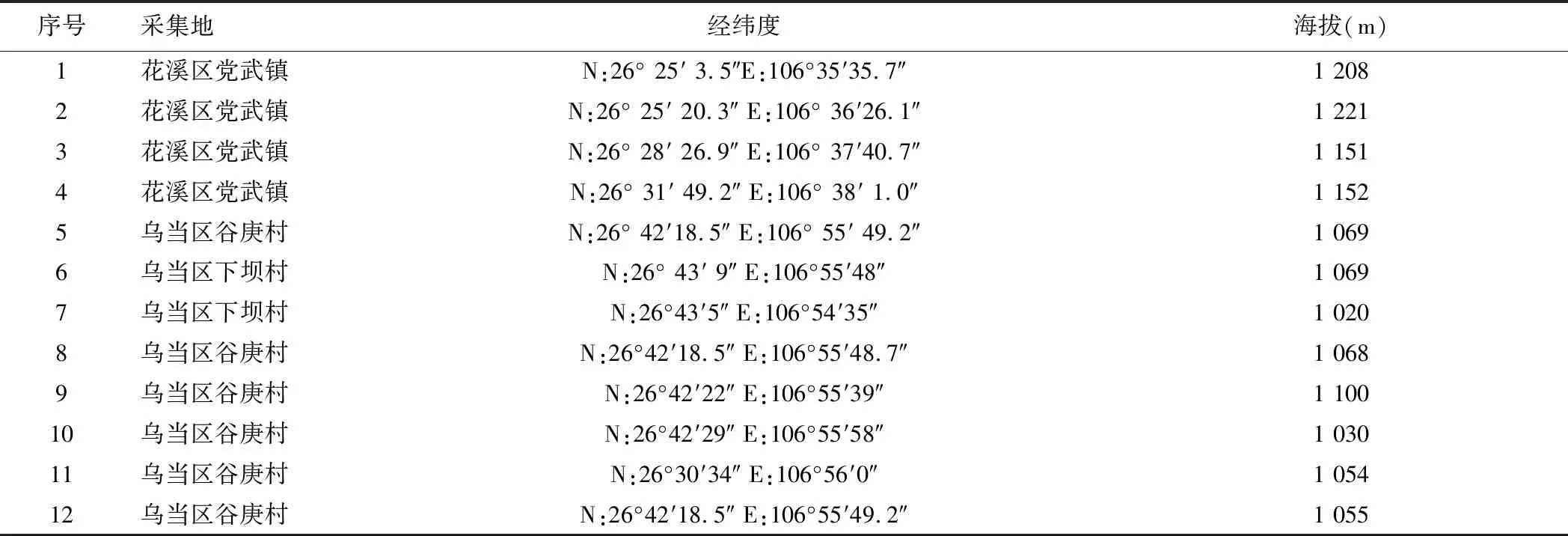
表1 樣品來源
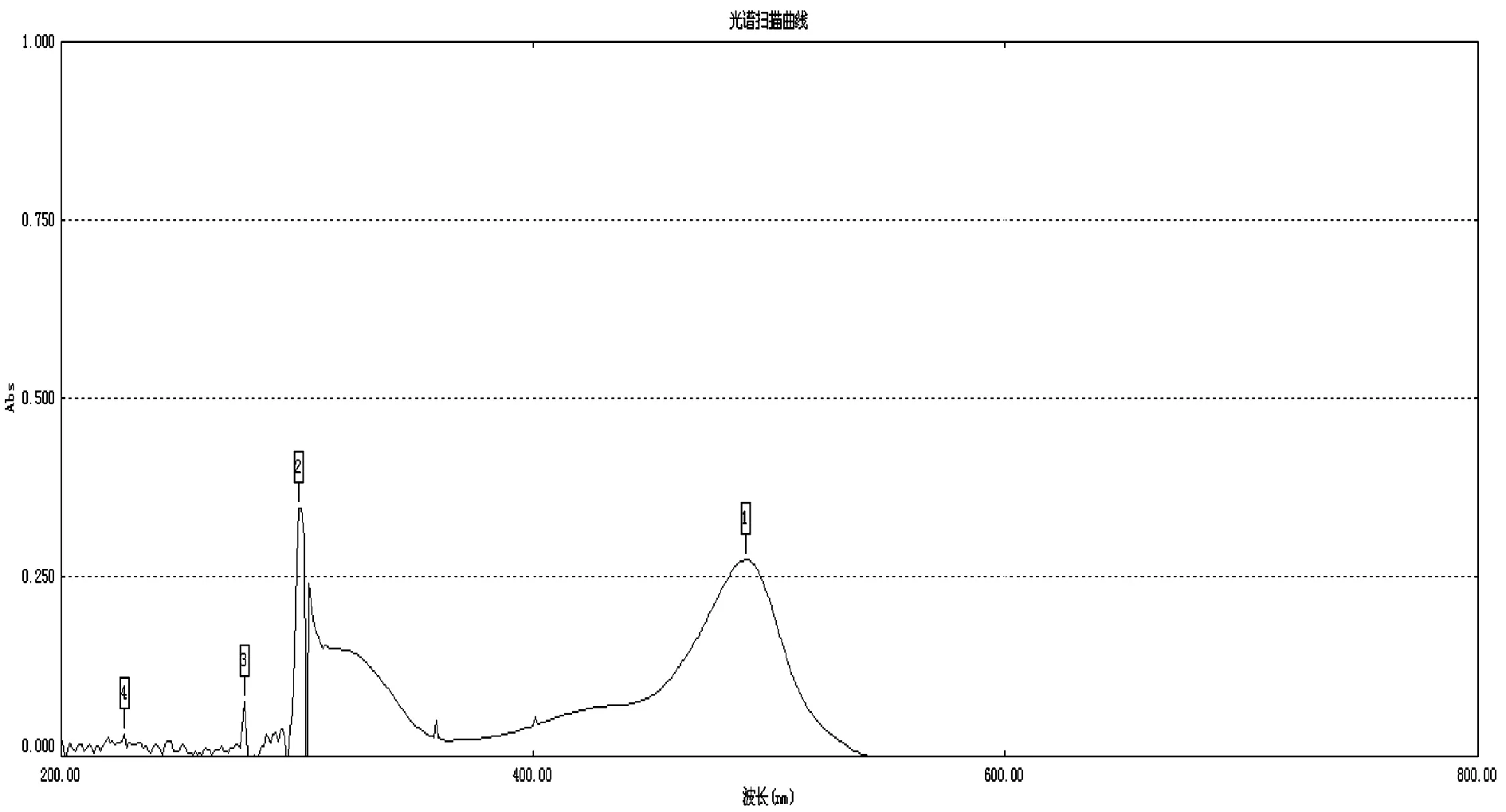
圖1 葡萄糖對照品波長掃描圖
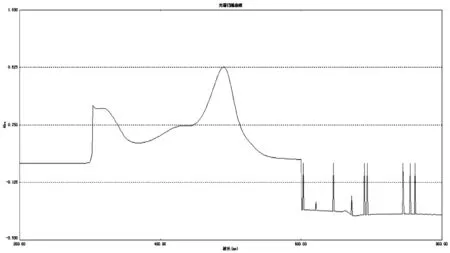
圖2 樣品波長掃描圖
2.3 顯色條件的確定
精密量取2.1項下的對照品儲備液8 mL,置于50 mL的容量瓶中,加水至刻度,搖勻。精密吸取該溶液2 mL置于15 mL的具塞試管中,加入5%苯酚1 mL混勻,迅速加入5 mL濃硫酸,混勻,按表2的條件顯色,以相應試劑為空白,在489.5 nm處測其吸光度。

表2 多糖顯色條件考察(n=3)
由以上結果確定顯色條件為:精密吸取上述溶液2 mL置于15 mL的具塞試管中,加入5%苯酚1 mL混勻,迅速加入5 mL濃硫酸,混勻,避光靜置40 min,顯色。
2.4 標準曲線的繪制
精密吸取2.1項下對照品儲備液2、3、4、5、6 mL置于25 mL的容量瓶中,加水至刻度,搖勻。精密吸取上述各溶液2 mL置于15 mL的具塞試管中加入5%苯酚1 mL混勻,迅速加入5 mL濃硫酸,混勻,常溫避光靜置顯色40 min,以相應試劑為空白,在489.5 nm處測其吸光度,以葡萄糖對照品濃度為橫坐標,吸光度為縱坐標,繪制標準曲線并計算回歸方程和相關系數。得到回歸方程為A=13.076x+0.057,r=0.999 8,線性范圍0.016 0~0.048 1 mg/mL。
2.5 供試品提取條件考察
同屬藥用植物多糖的含量測定中常用的提取方法有回流提取和超聲波提取,回流提取操作簡單、成本低廉但時間長,超聲提取操作簡便、快速[7]。為了明確哪種方法更適合淡黃花百合中多糖的提取,本實驗比較了回流提取與超聲提取。
2.5.1 超聲提取
精密稱取5號樣品粉末,每份約50 mg,置于250 mL錐形瓶中,加入50 mL 95%乙醇,超聲30 min,于90℃水浴揮干,得濾渣;加水50 mL于50℃下超聲提取30 min、45 min、60 min,過濾,取濾液于250 mL容量瓶中,殘渣用蒸餾水洗滌,加水至刻度,搖勻,即得供試品溶液。精密量取上述溶液2 mL于具塞15 mL試管中,按2.3項下條件顯色,以相應試劑為空白,在489.5 nm下進行檢測。實驗結果見表3。
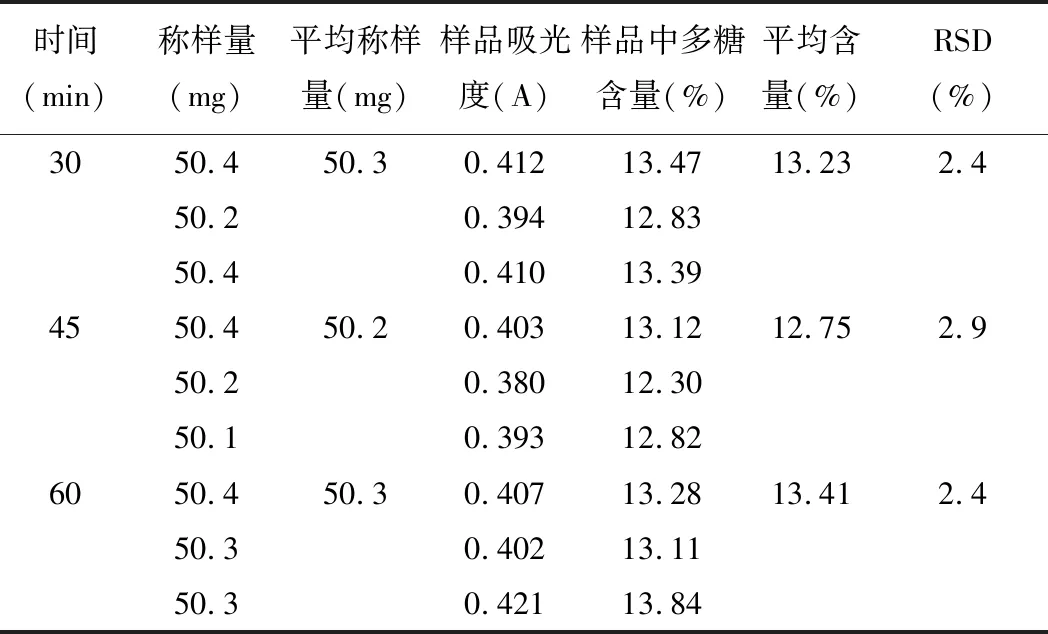
表3 超聲提取時間考察(n=3)
由測定結果可知:超聲提取60 min時,多糖含量最高,所以將多糖超聲提取的時間定為60 min。
精密稱取5號樣品粉末,每份約50 mg,置于250 mL錐形瓶中,加入50 mL95%乙醇,超聲30 min,于90℃水浴揮干,得濾渣;加水50 mL于30℃、40℃、50℃下超聲提取60 min,過濾,取濾液于250 mL容量瓶中,殘渣用蒸餾水洗滌,加水至刻度,搖勻,即得供試品溶液。精密量取上述溶液2 mL于具塞15 mL試管中,按2.3項下條件顯色,以相應試劑為空白,在489.5 nm下進行檢測。結果見表4。
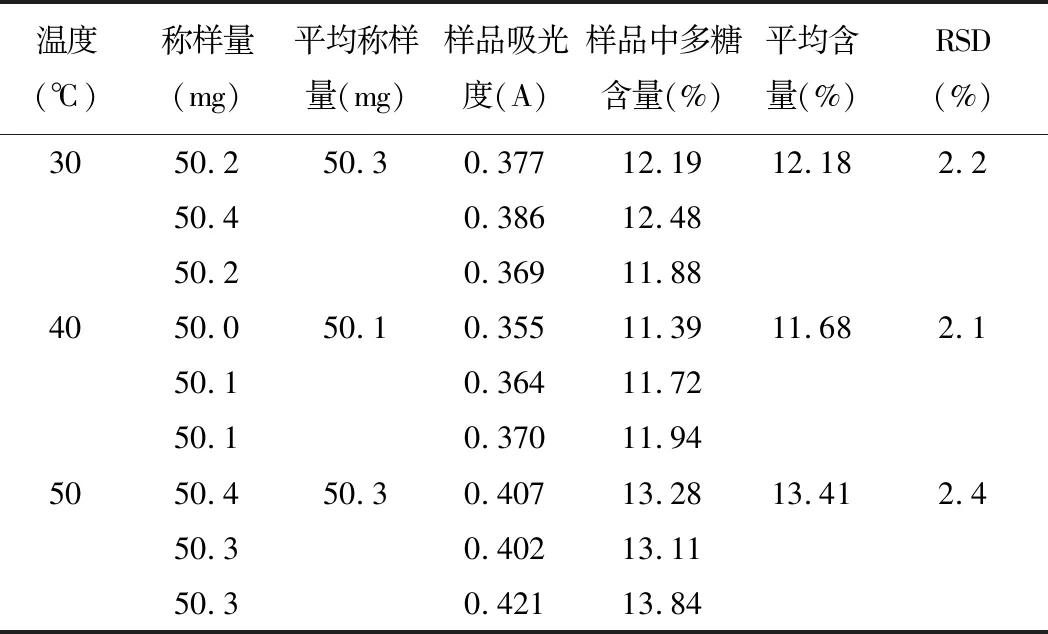
表4 超聲提取溫度考察(n=3)
由測定結果可知:超聲提取溫度為50℃時,多糖含量最高,所以將多糖的超聲提取溫度定為50℃。由以上實驗結果可知,超聲提取的最佳條件為:超聲溫度50℃下提取60 min。
2.5.2 回流提取
精密稱取5號樣品粉末,每份約50 mg,置250 mL圓底燒瓶中,加入50 mL95%乙醇,于80℃下回流30 min,90℃水浴揮干,收集濾渣;冷卻至室溫,加水50 mL,溫度固定為蒸餾水的沸點,沸騰后回流1 h、1.5 h、2 h[8],過濾,得濾液,置于250 mL容量瓶中,殘渣用蒸餾水洗滌,加水至刻度,搖勻,即得供試品溶液。精密量取上述溶液2 mL于具塞15 mL試管中,按2.3項下條件顯色,以相應試劑為空白,在489.5 nm下進行檢測。見表5。
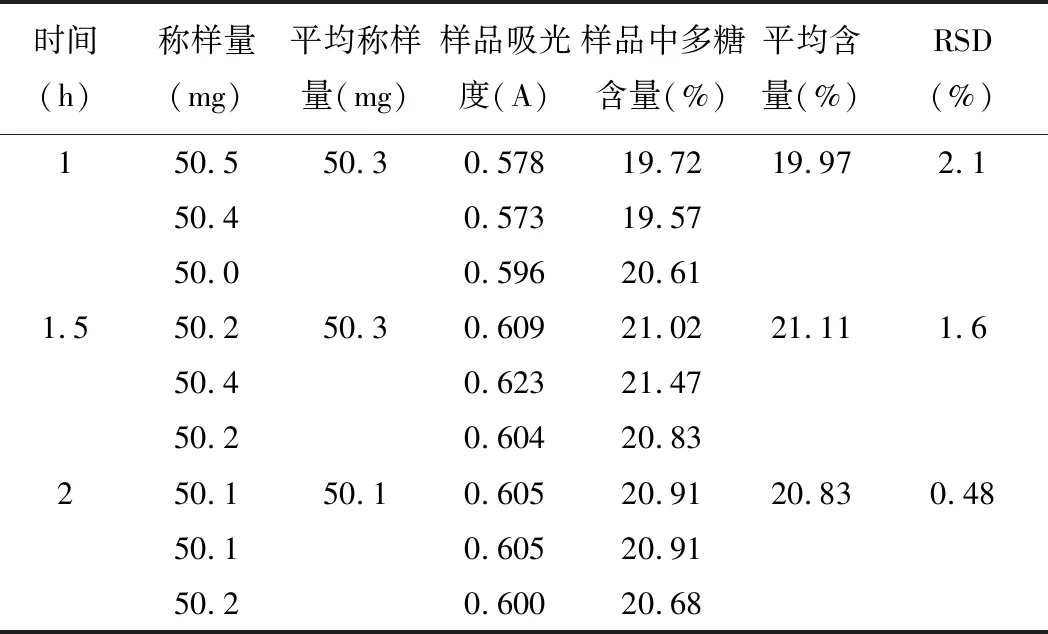
表5 回流提取時間考察(n=3)
由測定結果可知:回流提取的最佳提取條件為:沸騰后提取1.5 h。
2.5.3 供試品溶液制備方法的確定
通過比較超聲提取與回流提取多糖的含量,供試品溶液的最佳制備方法為:精密稱取藥材粉末,每份約50 mg,置250 mL圓底燒瓶中,加入95%乙醇50 mL,于80℃下回流30 min,90℃水浴揮干,收集濾渣;冷卻至室溫,加水50 mL,沸騰后回流1.5 h,過濾,得濾液,轉移至250 mL容量瓶中,殘渣用蒸餾水洗滌,加水至刻度,搖勻,即得供試品溶液。
2.6 精密度試驗
取濃度為0.032 1 mg/mL的葡萄糖標準品溶液2 mL于15 mL具塞試管中,按2.3項下操作,以相應試劑為空白,在489.5 nm下進行檢測連續測定6次。記錄其吸光度值,RSD=0.88%,表明儀器精密度良好,符合要求。
2.7 穩定性試驗
精密稱取5號樣品粉末,每份約50 mg于250 mL的圓底燒瓶中,照2.5.3項方法制備供試品溶液,按2.3項下操作,以相應試劑為空白,在489.5 nm下連續測定5次,分別于0、0.5、1.5、3.5、6.5 h測定其吸光度值,RSD=1.9%。結果表明本法所測樣品在6.5 h內穩定。
2.8 重復性試驗
精密稱取6份5號樣品粉末,每份約50 mg于250 mL圓底燒瓶中,照2.5.3項方法制備樣品溶液,按2.3項下操作,以相應試劑為空白,在489.5 nm下進行檢測。測定其吸光度值,并由回歸方程計算樣品中多糖的百分含量。得平均含量為19.96%,RSD=2.7%,結果所測樣品的重復性良好。
2.9 加樣回收率試驗
精密稱取5號樣品粉末6份,每份約25 mg于250 mL的圓底燒瓶中,照2.5.3項方法制備,過濾得濾液后,在每份樣品中分別加入5.0 mg的葡萄糖對照品,加水定容至250 mL容量瓶。按2.3項下操作,以相應試劑為空白,在489.5 nm下進行檢測,測定吸光度并計算回收率,得平均回收率為99.1%,RSD=0.95%,結果見表6。
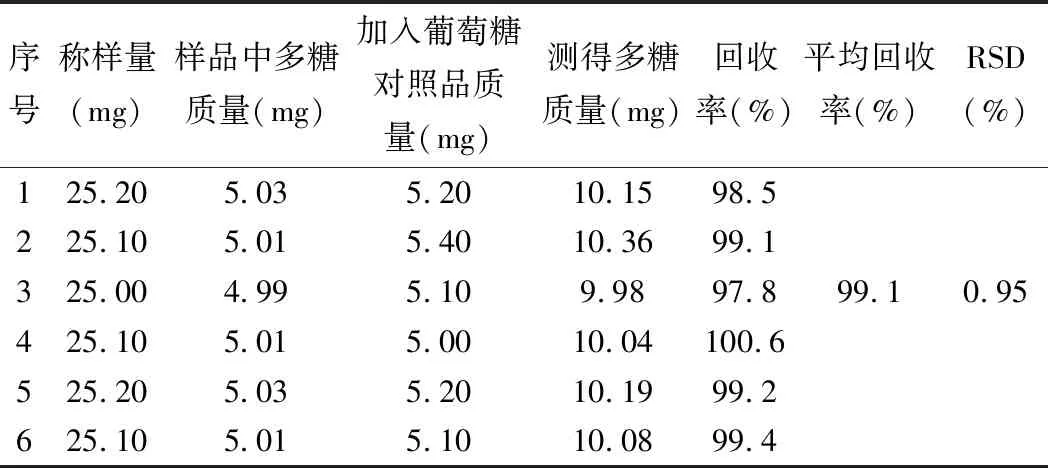
表6 加樣回收率試驗結果(n=6)
2.10 樣品中多糖的含量測定
按2.5.3項方法制備樣品溶液,按2.3項下操作,以相應試劑為空白,在489.5 nm下進行測定,由回歸方程計算樣品中多糖的百分含量。結果見表7。
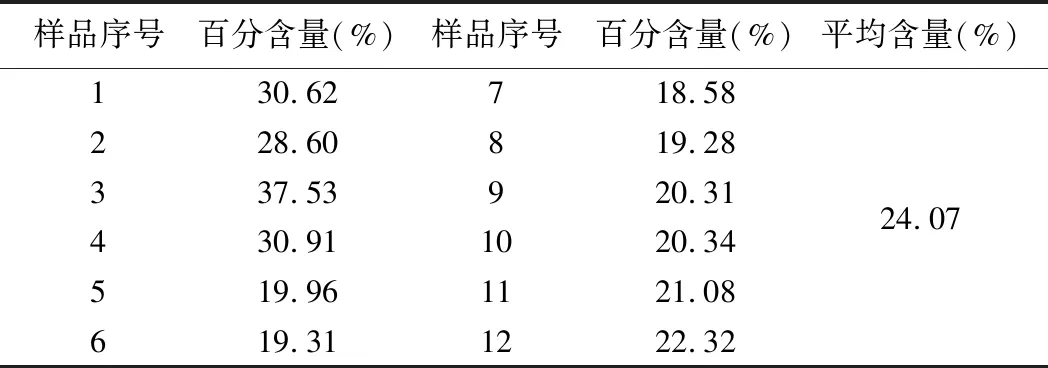
表7 多糖含量測定結果(n=3)
3 討論
實驗結果表明苯酚-硫酸法簡便、靈敏且重現性好,顯色物在6.5 h內穩定,能有效的應用于淡黃花百合中多糖的含量的測定。在提取條件的考察中,超聲提取的最佳條件為50℃下超聲提取60 min;回流提取最佳條件為沸騰后提取1.5 h。兩者相比較,超聲提取法成本較高、但快速簡便,回流提取法操作簡單,但耗時較長;回流提取法多糖得率較超聲提取法更高,故選用回流提取法。本實驗以黔產淡黃花百合為實驗對象,對12個批次的樣本中多糖的含量進行了測定,結果顯示貴州不同產地的淡黃花百合的多糖含量存在差異,多糖的含量范圍為18.58%~37.53%,平均含量為24.07%,其中產于花溪區的淡黃花百合多糖含量較高。淡黃花百合為多年生草本植物,所采集的樣品均為野生品,由于生長環境和生長年限的不同,鱗莖大小不一,多糖含量的高低是否與其有關,還需做進一步研究。

