培養程序及培養基成分對茄子優選植株花藥培養的影響
王 暢,崔群香,朱海佳,周 禎,陳丹陽,汪 輝,劉方嬌
(金陵科技學院,江蘇 南京 211169)
茄子(Solanum melongenaL.),茄科茄屬1年生草本植物,我國茄子栽培面積占世界總面積的52.2%[1],其嫩果具有較高的營養和保健價值[2]。研究證明茄子可采用花藥培養,花粉細胞能夠通過胚狀體發生途徑產生再生植株[3-4],甚至能夠產生自發加倍的雙單倍體(DH)植株,這為快速創制茄子新種質提供了一條高效途徑。但目前茄子花藥培養體系尚未完善,存在污染率高、出胚率以及胚胎成苗率低等問題,且諸多因素如消毒技術、培養基成分、基因型等都會影響上述問題。因此,從上述影響因素入手,篩選最佳消毒方法、調整培養基成分,優化茄子花藥培養程序是花藥培養技術應用于育種實踐時首先需要解決的問題。
采用品種間聚合雜交或多父本花粉授粉等方式,擴大花藥供體的遺傳基礎,才能更有效地創制出聚合多種優良性狀的茄子新種質。本試驗的目的就是在解決了花藥初代培養污染率高的問題的基礎上,設計并配制誘導培養基、分化培養基和壯胚培養基等,對幾個茄子商品種的聚合雜交后代進行花藥培養,試驗培養基成分以及培養程序對胚狀體誘導率和正常生長的作用,以期利用花藥培養結合聚合雜交技術,快速獲得優良茄子新種質。
1 材料和方法
試驗于2016年12月—2018年6月于金陵科技學院園藝試驗站進行。于2016年12月—2017年5月進行商品種栽培和聚合雜交,種果于2017年7月采收,雜種于2017年7月底播種,優良雜交后代選擇于2017年10—11月進行,花藥培養于2017年8月—2018年6月進行。
1.1 試驗材料
1.1.1 花藥
選用果實形狀符合長江流域市場消費習慣的40個紫長茄商品種,2016年冬季育苗,春季定植在金陵科技學院園藝試驗站,并在開花后采集40個品種的混合花粉,對所有品種的茄花進行授粉,每個品種至少保證坐住1個果實,以獲得聚合雜交的后代。從聚合雜交后代中,篩選出以自身表現好的編號為16(鄂優二號)、22(農百萬—黑帥)、35(迎春一號)、36(鄂優春韻)的4個商品種為母本的綜合性狀優良的單株若干,采集所有入選茄子植株上的適宜花蕾作為試驗材料用于花藥培養。植株篩選的標準是果皮紫色亮麗、果實形狀好、果長28 cm以上、果徑3.5 cm以上、單株商品果數超過10個、果實發育快。
1.1.2 培養基
試驗設計了誘導培養基、分化培養基、成熟培養基和生根培養基,各培養基具體成分及含量見表1、表2。
1.1.3 儀器
智能培養箱(寧波賽福實驗儀器有限公司生產的PRX-1000 C型人工氣候箱)。
1.2 試驗方法
采集抱合花瓣頂端距離萼片裂口±2 mm的花蕾,4 ℃低溫下處理2 d后進行表面消毒和接種。消毒前撕去花蕾的萼裂片但保留萼筒,放入無菌三角瓶中,先用75%酒精消毒2 min,倒掉酒精后,加入1滴吐溫-80,然后加入6.5%的次氯酸鈉,搖動10~15 min后倒掉,并用無菌水沖洗花蕾3~5次,無菌紙吸干水分備用。
1.2.1 2種培養基組合對茄子花藥培養胚狀體成苗的影響
將表面消毒過的花蕾,放在無菌濾紙上剝取花藥,接種到直徑6 cm,裝有15 mL誘導培養基的玻璃培養皿中,每種誘導培養基接種10皿,每皿接種20~30個花藥(大約4~5個花蕾);36 ℃黑暗條件下熱處理6 d后轉至25 ℃光照培養。
試驗設計了2種誘導培養基、1種分化培養基和2種胚成熟培養基,組成了2種培養基組合進行茄子花藥培養。組合1:花藥→誘導培養基1(36 ℃黑暗培養6 d,25 ℃光暗培養9 d)15 d→胚分化培養基20~40 d→胚狀體成熟培養基1(無激素)中20 d→胚狀體生根培養基;組合2:花藥→誘導培養基2(36 ℃黑暗培養6 d,25 ℃光暗培養9 d)15 d→胚分化培養基20~40 d→胚狀體成熟培養基2(降低激素濃度)中20 d→胚狀體生根培養基。當生根的胚狀體形成具有2~3片真葉的植株時進行煉苗移栽,成活的植株移栽到土壤中或大花盆中直至開花結果。
除熱處理為高溫黑暗條件外,其余培養過程的培養條件一致,均為25 ℃,16 h光照,光照強度調節至最高。
分化培養結束時,統計其中花藥產生胚狀體的培養皿百分率、出胚的花藥百分率(出胚的花藥百分率=每組合出胚花藥總數/接種花藥總數×100%),觀察并記錄各培養過程中胚狀體產生、發育和生根成苗狀況,以及最終移栽成活植株情況。
1.2.2 誘導培養基和分化培養基成分對胚狀體誘導和發育的影響
為提高胚狀體誘導頻率和成苗率,根據1.2.1培養中胚狀體誘導和發育的結果,調整培養基的配方(表2):為消除1.2.1中基本培養基對誘導結果的影響,誘導培養基采用NLN基本培養基,但不添加絲氨酸、谷胱甘肽和谷氨酰胺等3種固體有機物,僅對蔗糖或葡萄糖以及聚乙二醇的濃度進行了調整,設計了G1、G2、G3、S1、S2和S3等6種誘導培養基;為了減輕胚狀體愈傷化和水漬化程度,在統一采用NLN培養基的基礎上,降低分化培養基中的細胞分裂素的濃度,設制了B2、K1和K2等3種分化培養基;分化培養基上產生的胚狀體及其花藥隨機轉入胚成熟培養基1或2;成熟胚狀體轉入生根培養基。
每種誘導培養基至少試驗3次,每次試驗至少接種10皿,每皿接種4~5個花蕾的花藥。每種誘導培養基的花藥隨機轉入3種不同的分化培養基,每種分化培養基至少接種3皿,至少3次重復試驗。分化培養結束后統計每次試驗6種不同誘導培養基或3種不同分化培養基中接種花藥的出胚百分率(出胚百分率=每種培養基中出胚花藥總數/接種花藥總數×100%),排除培養過程中的花藥或培養基污染等因素,保證每種配方獲得至少2次重復試驗的數據,并利用Excel軟件進行包含2次重復的單因素方差分析。
2 結果與分析
2.1 培養基組合對茄子胚狀體誘導和成苗的影響
熱激結束后,大多數花藥顏色由黃綠色變為棕褐色,50%以上的花藥膨大,少量花藥保持原來大小。在誘導培養基1中誘導培養的花藥,轉入分化培養基15 d后,其中2個培養皿中的部分花藥產生了形態比較正常的胚狀體(圖1-1),甚至有個別胚狀體不僅發育出側根,而且產生了真葉,但胚狀體數量較少;而在誘導培養基2中誘導培養的花藥,則在轉入分化培養基17 d后,1個培養皿中的部分花藥才出現胚狀體,胚狀體數量多,但發育階段較晚,多數處于心形胚期或之前,少量胚狀體有胚根產生,但胚軸膨大腫脹,沒有發育出葉片(圖1-2)。同一花藥或不同花藥誘導產生的胚狀體都存在發育速度不同、發育階段不一致的現象(圖1-3)。
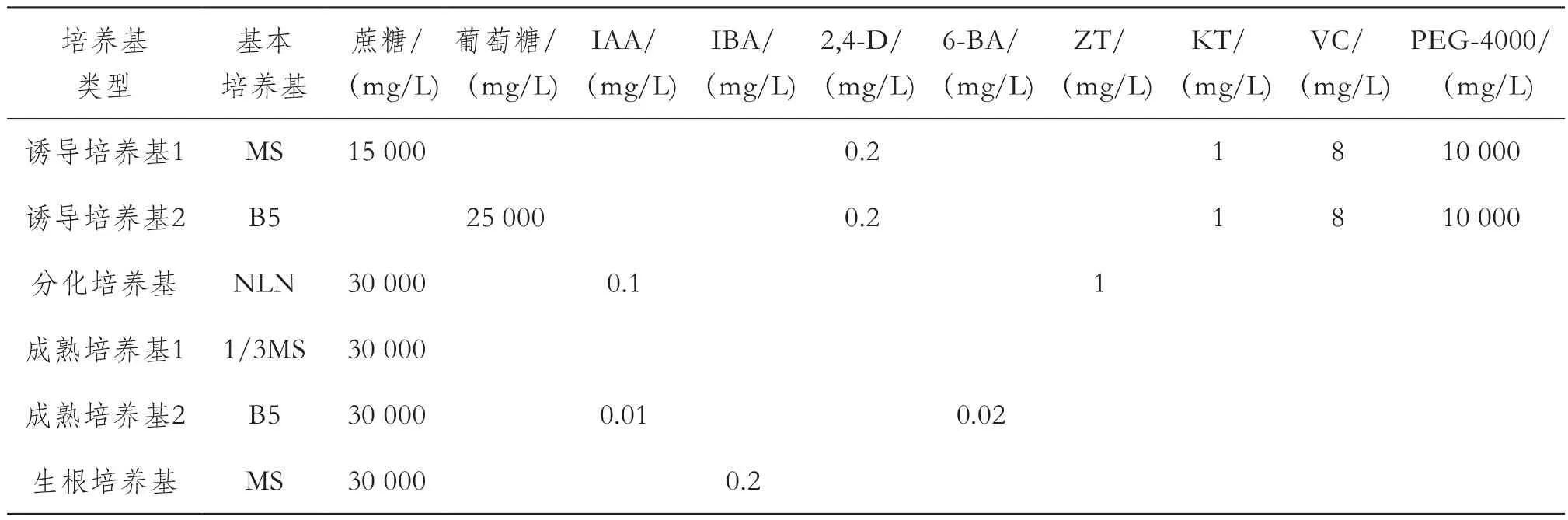
表1 不同培養基的成分及含量
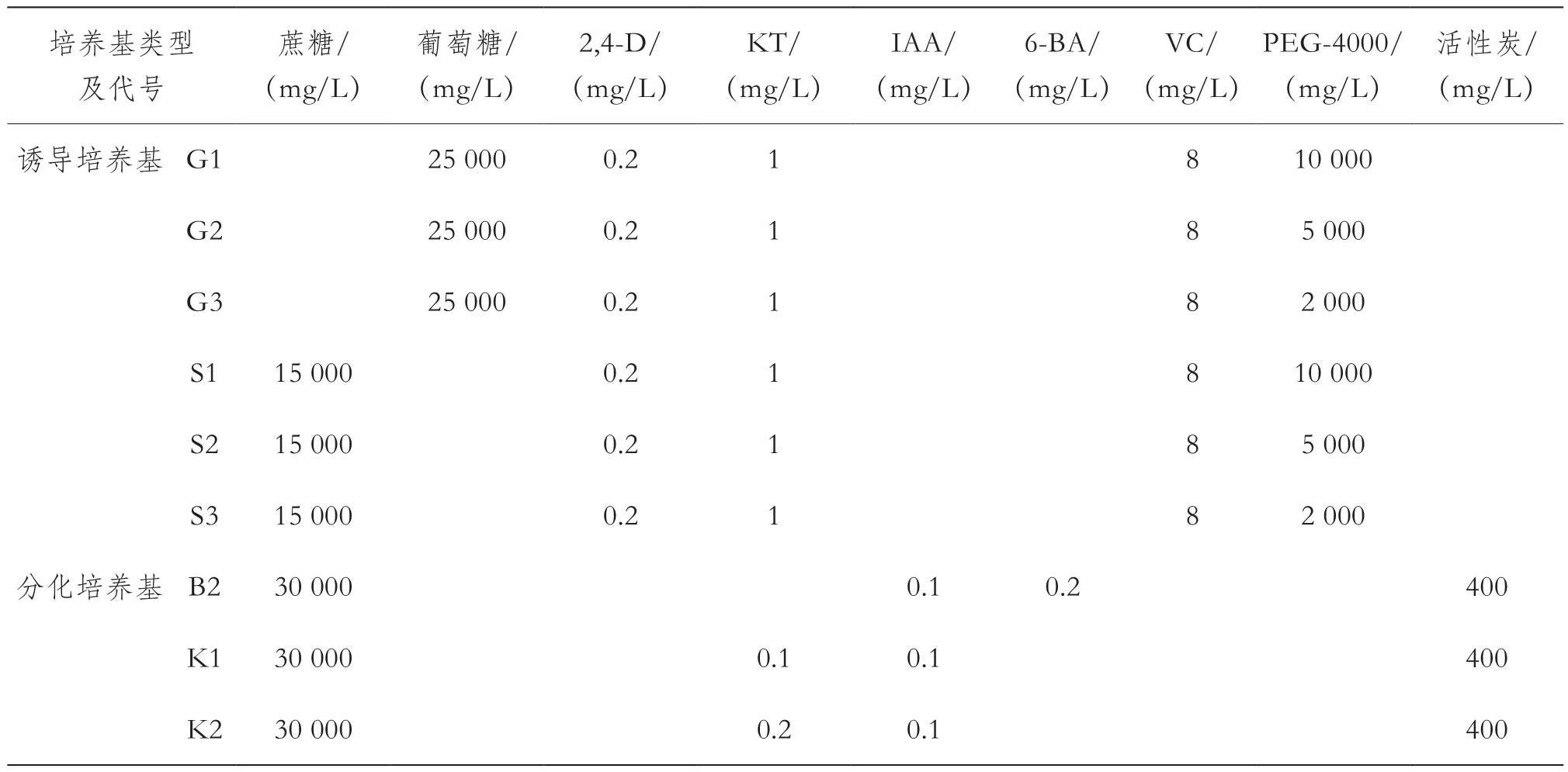
表2 調整后各種培養基的成分及含量
分化培養基上產生的胚狀體,大部分胚軸腫脹,轉入胚成熟培養基1后胚狀體容易褐變死亡;轉入胚成熟培養基2中的幼嫩胚狀體的胚軸甚至愈傷化,最終無法長成能夠移栽成活的植株。在分化培養基上即使產生真葉和胚根的成熟胚狀體,在無激素的胚成熟培養基1中也多數褐化死亡或生長發育停滯,只有及時轉入生根培養基后,才誘導少量形態正常的胚狀體繼續發育,并最終移栽成活。
由表3可知,1.85%~3.33%的接種花藥被誘導產生了胚狀體,其中含蔗糖的誘導培養基1中的花藥產生胚狀體總數少但成熟胚狀體數量多,胚狀體發育快,最終成苗率高(28.6%);而含葡萄糖的誘導培養基2中的花藥產生的胚狀體數量多,但發育速度慢,最終成苗率低(3.3%);因此,提高出胚花藥百分率和胚狀體成苗率,是茄子花藥培養能夠應用于茄子育種實踐的關鍵。
追蹤觀察發現,成活苗的頂芽往往多個并生,只有除去多余的頂芽,保留的頂芽才能進一步發育至開花坐果,說明這類植株來源的胚狀體,可能是多個細胞起源的。隨后試驗中發現,單一胚狀體發育成的植株,存在分株或分支現象(圖2),甚至在分株性狀上存在差異(圖2-2),與前述胚狀體多細胞起源的推測相符。圖2-2顯示,1個胚狀體發育來的植株存在2個分株,2個分株在莖葉顏色方面存在差異,且2個分株都包含2個或3個分枝。據此推斷,胚狀體多細胞起源,每個分株可能來源于不同的花粉細胞,且各分株中的分枝可能來源于2細胞或3細胞雄配子體中的單倍體細胞。
分析茄子花藥培養胚狀體誘導和發育的過程,并根據培養基成分推斷:培養基組合1(程序1)更有利于茄子花藥培養產生移栽成活的再生植株;含葡萄糖的起始培養基更有利于胚狀體的誘導但不利于胚狀體成熟;含蔗糖的起始培養基盡管出胚花藥頻率低,但有利于胚狀體成熟;胚狀體形態不正常可能與培養基中植物生長調節劑濃度過高或種類不合適有關。
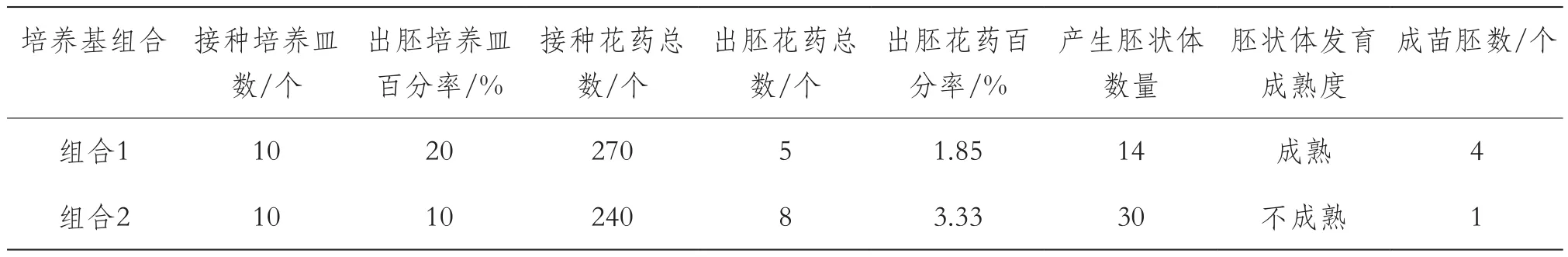
表3 誘導培養基及其與分化和胚成熟培養基組合對茄子花藥胚狀體誘導和發育的影響
2.2 誘導培養基和分化培養基成分對胚狀體誘導和發育的影響
6種誘導培養基以及3種分化培養基對花藥出胚率的作用見表4,由表4可見培養基成分調整后,茄子花藥出胚百分率從原來最高3.33%(表3),提高到最低8.1%,最高達到了12.3%,各培養基間差異不顯著,表現較為一致(表4);以葡萄糖為碳源的誘導培養基,茄子花藥出胚率略高于以蔗糖為碳源的培養基;PEG濃度為10 g/L時,出胚花藥最多;G1、B2分別是出胚花藥百分率最高的誘導培養基和分化培養基。試驗中還發現,每個花藥產生的胚狀體數量顯著增加,平均達到5個以上。

圖1 茄子胚狀體誘導和植株再生成苗情況

圖2 單個胚狀體發育的植株
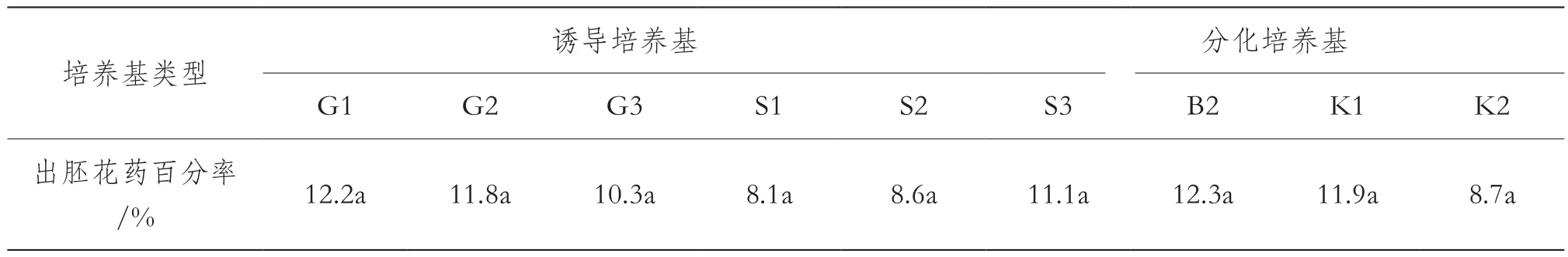
表4 不同培養基成分對花藥胚胎誘導的影響
3 結論與討論
花藥培養的程序對胚胎發育有重要的影響。目前茄子花藥基本沿用Dumas de Vaulx和Chambonnet于1982年建立的程序[5-6],即花藥接種于培養皿中的誘導培養基中,在35 ℃黑暗中培養8 d,然后在12 h/12 h光周期和25 ℃中繼續培養4 d,第12天將花藥轉接至R1分化培養基中培養,每20 d更新1次培養基,直至從花藥中產生胚胎,將胚胎分離并在V3培養基中培養成小植株。本試驗沿用該程序并適當調整,推遲胚胎剝離花藥的時間,建立了優化的培養程序,減輕了胚狀體的褐化,促使更多的胚狀體發育成植株。鑒于發育階段較早的胚狀體如果脫離了花藥母體,在隨后培養時難以被誘導發育成苗,因此本試驗所建立的培養程序還需要補充或者進一步優化。
聚乙二醇是一種滲透調節劑,能夠促進茄子小孢子發育成胚狀體[4],Patricia Corral-Martínez等[7]在進行茄子游離小孢子培養時證實:是PEG而不是甘露醇,能顯著增加小孢子胚胎發生的誘導。本試驗也證實,茄子花藥初代培養的誘導培養基中添加2~10 g/L的聚乙二醇,能夠減輕胚狀體的水漬化,大大提高產生胚狀體的花藥頻率,出胚花藥百分率為8.1%~12.3%,考慮到每茄子花蕾中的花藥數至少5個,則出胚花蕾百分率達到40%~60%;而在后期分化培養基中添加聚乙二醇則不利于胚狀體誘導。
誘導培養基中添加蔗糖或葡萄糖,花藥胚狀體誘導率和發育階段會存在一定的差異。其中添加葡萄糖時胚狀體誘導數量多,而且早期胚胎多,胚胎可確定來源于花粉細胞;而添加蔗糖時,也產生較多的子葉期以前的未成熟胚胎。未成熟的早期胚胎直接轉接至培養基中褐變嚴重,分裂素濃度較高的培養基中胚狀體胚軸部位膨大愈傷化,胚狀體難以成苗。因此,如何促使早期胚狀體發育成熟,就成為影響花藥育種的限制因素之一。
本試驗通過降低分化培養基中激素濃度,促進了胚狀體成苗,但成苗率仍舊很低,Y XING等[8]在進行茄子子葉培養時發現蔗糖濃度影響愈傷組織的產生,較低濃度蔗糖能夠抑制愈傷組織形成而有利于不定芽的產生,蔗糖濃度對于茄子花藥產生的幼胚發育是否也存在類似的影響,值得進一步研究;幼胚下胚軸愈傷化也影響花粉胚進一步發育成苗,多次調整培養基中植物生長調節劑濃度,均未能誘導這種胚胎繼續發育。而茄子下胚軸和子葉培養都有很多成功的報道,能否從形態不正常的胚胎分離出下胚軸和頂芽,誘導其重新通過器官發生途徑產生植株,有待進一步研究。
茄子花藥培養產生的胚狀體,有單倍體、二倍體和多倍體等不同倍性差異,自交結實的二倍體植株,經后代性狀穩定性判斷為單倍體花粉細胞起源,結合胚狀體由脫離花藥的細胞產生的現象,可推斷本實驗室建立起來的茄子花藥培養程序,誘導出的胚狀體主要是花粉細胞起源的。本試驗發現,單個胚狀體發育來的植株,存在分株或分枝現象,根據分枝或分株的表現,推斷胚狀體可能是多細胞起源,至于胚狀體是不同的花粉細胞融合產生,還是同一配子體中的營養細胞和生殖細胞融合產生,尚需要將各個分枝或分株建成單株,并得到自交系,根據自交后代性狀表現,結合細胞學鑒定,加以確定。
茄子花藥培養技術要成功應用于育種實踐,重點需要解決3個問題:一是提高胚狀體誘導和發育成植株的頻率,二是確保胚狀體是單倍體細胞來源,三是單倍體加倍技術。單倍體加倍技術已經取得成功[9],本研究將花蕾胚狀體誘導頻率提高到接近50%,并且獲得了雙單倍體(DH)株系,今后研究重點是確保胚狀體單倍體細胞起源,以提高茄子單倍體誘導技術應用于育種實踐的可靠性,大幅度縮短自交系選育的年限,提高茄子雜交品種選育的效率。
綜合上述研究結果,茄子花藥培養優化的培養程序調整為:花藥→誘導培養基S1培養15 d(36 ℃黑暗條件下培養6 d,25℃光照16 h黑暗8 h培養9 d)→分化培養基B2培養20 d→胚成熟培養基培養20 d→出胚花藥生根培養20 d→萌發胚胎生根培養基成苗→煉苗移栽。利用該程序,能夠多次重復試驗結果,并擴大了茄子花藥培養的基因型反應范圍。

