短期生物炭添加對不同類型土壤細菌和氨氧化微生物的影響
張夢陽,夏浩,呂波,叢銘,宋文群,姜存倉
?
短期生物炭添加對不同類型土壤細菌和氨氧化微生物的影響
張夢陽1,夏浩1,呂波1,叢銘1,宋文群2,姜存倉1
(1華中農業大學資源與環境學院微量元素研究中心,武漢 430070;2江西省信豐縣農業技術推廣站,江西贛州 341600)
【目的】氨氧化作用是硝化作用的第一步,也是硝化作用的限速步驟,是全球氮循環的關鍵環節。本試驗旨在研究在我國不同類型土壤中添加花生殼生物炭對細菌和氨氧化作用的影響,為生物炭的推廣使用提供理論依據。【方法】試驗以黃棕壤、潮土、黑土為供試土壤,通過短期培養試驗,利用16SrRNA測序研究生物炭對不同類型土壤氨氧化微生物、細菌群落結構以及相關酶基因表達量的影響。每種土壤設置4個處理:CK(不施用化肥和生物炭),F(單施化肥),C(單施2%花生殼生物炭),FC(施用化肥+2%花生殼生物炭)。【結果】施用生物炭后(C、FC)酸性土壤pH顯著提高了0.5—1.0個單位,但堿性土壤pH顯著降低了0.5—0.6個單位;單施生物炭(C)造成黃棕壤的微生物豐富度和多樣性顯著提高,潮土在單施生物炭(C)時僅顯著提高了土壤的微生物多樣性指數,在黑土中施用生物炭和化肥都未顯著改變土壤微生物的豐富度和多樣性;在3種土壤中氨氧化細菌的豐度皆高于氨氧化古菌,測得的氨氧化細菌的OTU豐度約為氨氧化古菌的8.1倍;生物炭和化肥并未顯著改變奇古菌門中的OTU豐度,卻對β和γ變形菌中的OTU豐度產生了顯著性影響;3種土壤的氨氧化細菌都以β變形菌為主,約占60%;另外,生物炭的施用(C、FC)在PC1(40.4%)上顯著改變了黃棕壤的微生物群落結構,在PC1(42.3%)和PC2(21.3%)上都顯著改變了潮土的微生物群落結構;施用生物炭后(C、FC),短期內潮土中氨合成相關酶基因表達量顯著降低14.7%—39.9%,氨氧化古菌豐度在單一施炭(C)和化肥與生物炭同施(FC)時分別降低了70.5%和48.7%。【結論】施用生物炭后,短期內顯著改變了黃棕壤和潮土的微生物群落結構,并明顯抑制了潮土的氨氧化作用。
生物炭;化肥;氨氧化作用;微生物群落結構;黃棕壤;潮土;黑土
0 引言
【研究意義】氮是組成生命最重要物質核酸和蛋白質必不可少的元素之一[1],土壤圈是氮循環中最活躍的區域,土壤中氮循環對土壤質量、農業生產力乃至其他地球化學循環都有著重要的作用,而微生物是必不可少的推動者[2-3]。生物炭近年來被廣泛應用于改良土壤、提高土壤固炭能力等[4],但生物炭施用于不同土壤時改良效果不同[5],生物炭在土壤中的具體微生物效應也不明確。因此,研究生物炭對不同類型土壤微生物群落和氨氧化作用在農業生產中意義重大。【前人研究進展】生物炭作為一種土壤改良劑,鄭瑞倫等[6]的研究表明,400℃熱解得到的秸稈炭施用于壤土中顯著改善土壤pH、通氣性、含水量、有效養分等。李昌見等[7]通過大田試驗也發現施用10 t·hm-2到60 t·hm-2玉米秸稈炭都顯著提高了砂壤土的含水量、肥料利用率。呂波等[8]施加3%生物炭后發現紅壤和黃棕壤的pH、速效養分以及酶活性都得到顯著提高。應介官等[9]研究也表明在紅壤中添加生物炭可以顯著降低土壤鋁毒。相應研究也證明了在不同溫度下熱解得到的生物炭都不同程度降低營養物質的淋失,ASADA等[10-11]研究表明,低溫(400—500℃)熱解產生的毛竹生物炭有更強的NH3吸附能力。CLOUGH等[12]發現,高于600℃熱解產生的木材生物炭才具有較好的NO3-吸附能力。前人研究也發現生物炭的施用也與溫室氣體的排放有關,有學者利用9種不同原料經500℃熱解得到的生物炭,研究了它們在14種不同類型土壤中N2O的排放,結果表明施用生物炭提高了土壤pH,從而減少土壤中N2O的排放[13],但也有研究發現施用600℃熱解得到的木質生物炭對草地土壤N2O排放無影響[12],甚至有研究者發現無論是高溫(900℃)生產的核桃炭還是中溫(550℃)生產松木炭都促進砂質黏壤土N2O的排放[14]。氨氧化作用為硝化作用的限速步驟,該作用主要由氨氧化微生物推動,氨氧化細菌廣泛的分布在土壤生態系統、淡水生態系統和海洋生態系統中,且氨氧化細菌主要屬于β變形菌綱和γ變形菌綱[15-16]。氨氧化古菌的發現讓我們了解到參與氨氧化作用的不僅有細菌還有古菌。最初,人們認為氨氧化古菌隸屬于溫泉古菌(Crenarchaeota)[17],BrochierArmanet等[18]研究并提出了新的古菌菌門奇古菌門(Thaumarchaeota)。也有研究證明奇古菌幾乎包括了所有發現的土壤、海洋、熱泉中的氨氧化古菌[19]。目前來看,生物炭對土壤氮循環的影響已開展較多研究,并發現生物炭的添加可能影響著氮素淋溶、氨揮發、硝化作用、固氮作用、以及氧化亞氮的產生[20-24],微生物驅動土壤氮循環的各過程[2-3]。我們可以明確土壤類型差異是導致生物炭施用效果差異產生的主要原因之一。ABUJABHAH等[25]也發現熱解溫度為650—750℃的桉樹生物炭對土壤微生物群落和氮循環細菌的影響主要取決于土壤類型,其中對紅壤和黑土的作用明顯高于棕壤。LIU等[26]施用了0—40 t·hm-2的稻殼生物炭(400℃)于紅壤、棕壤和鹽漬土中,結果發現生物炭對紅壤細菌群落改變最顯著。【本研究切入點】在不同土壤中驅動土壤氨氧化作用的主要微生物可能是氨氧化細菌也可能是氨氧化古菌,但生物炭的添加究竟是改變了土壤中氨氧化細菌的豐度還是氨氧化古菌的豐度;在不同土壤施用生物炭后氨氧化微生物的變化趨勢是否相同;生物炭對酸堿性不同的土壤造成的氨氧化微生物的具體差異是否相同,很多類似的問題仍沒有明確的答案。【擬解決的關鍵問題】本文選取我國3種不同類型土壤(黃棕壤、潮土、黑土)為供試土壤,通過16S rRNA測序分析得到單一施炭、單一施肥、生物炭與化肥同施對不同類型土壤細菌群落結構、氨氧化微生物豐度以及氮代謝通路中相關酶基因表達量的具體差異,從而揭示生物炭對不同土壤細菌群落和氨氧化作用的具體影響,為生物炭的實際應用提供理論依據。
1 材料與方法
1.1 樣本采集及試驗處理
試驗土壤采集湖北黃棕壤、山東潮土、黑龍江黑土,每個地區選擇100 m2的區域,在區域中隨機選擇10個采樣點采集0—20 cm土層的土壤樣品,分別代表酸性、弱酸性和堿性土壤(供試土壤基本性質見表1)。樣品自然風干后挑去石子、植物根系等雜物,全部研磨過2 mm篩,混勻后儲存備用。設4個處理:CK(不施用化肥和生物炭),F(單施化肥),C(單施生物炭),FC(施用化肥+生物炭)。化學肥料施用KH2PO4,KNO3,NH4NO3和Ca(NO3)2(其中N 0.46 g·kg-1干土,P2O50.07 g·kg-1干土,K2O 0.24 g·kg-1干土)。沈陽農業大學提供花生殼生物炭,生物炭在400℃下熱解制備而成,全炭321.9 g·kg-1,全氮18.8 g·kg-1,全磷2.6 g·kg-1,全鉀8.5 g·kg-1,生物炭施用量為2%(生物炭質量/土壤質量)。試驗在塑料杯中進行培養,每杯裝土300 g,根據試驗方案加入化肥和生物炭并混勻,土壤上層平鋪一層濾紙防止澆水時擾動土壤,每個處理設置3次重復,試驗過程中土壤持水量保持在40%左右。土壤與肥料和生物炭按處理混勻后加水至飽和持水量,靜置熟化1周,熟化后培養4周,試驗于2018年5月6日至6月1日在華中農業大學盆栽場進行。試驗結束后采集新鮮土壤于-80℃保存用于DNA的提取以及測定,其余土壤自然風干后,過1 mm篩,用于測定土壤pH(液土比例為2.5﹕1)。
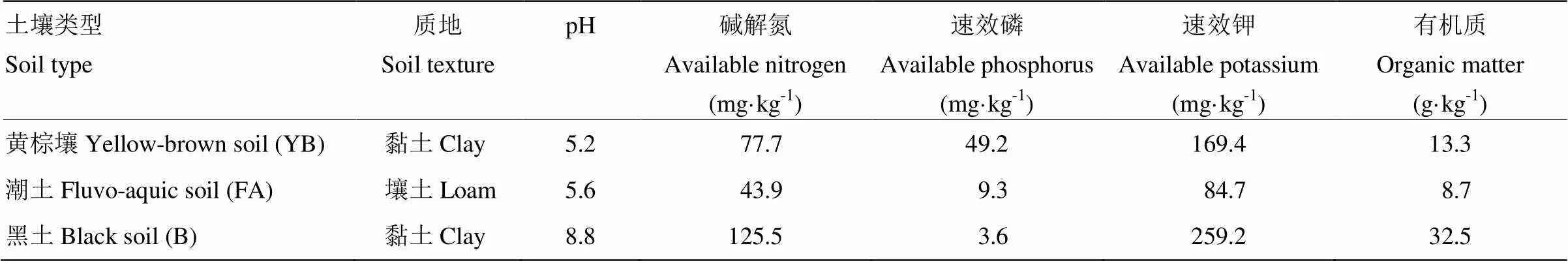
表1 供試土壤的基本性質
1.2 DNA 抽提和PCR擴增
根據E.Z.N.A.? soil試劑盒(Omega Bio-tek,Norcross,GA,U.S.)說明書進行總DNA抽提,DNA濃度和純度利用NanoDrop2000進行檢測,利用1%瓊脂糖凝膠電泳檢測DNA提取質量;用515F(5′-GT GCCAGCMGCCGCGG-3′)和806R(5′-GGACTACH VGGGTWTCTAAT-3′)引物對V4可變區進行PCR擴增。
1.3 Illumina Miseq測序
使用2%瓊脂糖凝膠回收PCR產物,利用AxyPrep DNA Gel Extraction Kit(Axygen Biosciences,Union City,CA,USA)進行純化,Tris-HCl洗脫,2%瓊脂糖電泳檢測。利用QuantiFluor?-ST(Promega,USA)進行檢測定量。根據Illumina MiSeq 平臺(Illumina,San Diego,USA)標準操作規程將純化后的擴增片段構建PE 2*300的文庫。
1.4 數據處理
原始測序序列使用Trimmomatic 軟件質控,使用FLASH軟件進行拼接[27]:
(1)設置50 bp的窗口,如果窗口內的平均質量值低于20,從窗口前端位置截去該堿基后端所有序列,之后再去除質控后長度低于50 bp的序列;
(2)根據重疊堿基overlap將兩端序列進行拼接,拼接時overlap之間的最大錯配率為0.2,長度需大于10 bp。去除無法拼接的序列。
(3)根據序列首尾兩端的barcode和引物將序列拆分至每個樣本,barcode需精確匹配,引物允許2個堿基的錯配,去除存在模糊堿基的序列。
本研究使用UPARSE軟件(version 7.1 http:// drive5.com/uparse/),根據97%的相似度對序列進行OTU聚類,并在聚類的過程中去除單序列和嵌合體[28]。利用RDP classifier (http://rdp.cme.msu.edu/)對每條序列進行物種分類注釋,比對Silv128/16S數據庫,設置比對閾值為70%[29]。分析所用序列為原始序列按照最小樣本序列數進行抽平后得到。文章中物種組成柱狀圖基于tax_summary_a文件夾中的數據表,利用R語言工具作圖,用于分析處理間物種組成差異,物種豐度<0.005合并為Other;Alpha多樣性指數利用mothur(version v.1.30.1 http://www.mothur.org/ wiki/ Schloss_SOP#Alpha_diversity)指數分析[30],指數組間差異檢驗方法采用Student’s T檢驗。β多樣性利用R語言PCA統計分析和作圖。16S功能預測通過PICRUSt去除16S marker gene在物種基因組中的copy數目的影響,通過比對KEGG獲得代謝通路中的各個層級的代謝信息以及相關酶的基因表達量[31]。
采用Microsoft Excel 2010對數據整理,用SPSS 20.0軟件進行單因素方差和多因素分析,ANOVA進行顯著性差異比較,多重比較采用Duncan檢驗,所有數值均為3次重復的平均值。
2 結果
2.1 生物炭對不同土壤pH的影響
圖1所示,在黃棕壤中施用生物炭后顯著提升了其土壤的pH,提升了0.6—1.0個單位,然而單一施用化肥并未產生顯著性差異。在潮土中施用生物炭pH提升了0.5—0.6個單位,而僅施用化肥時降低了0.3個單位。在黑土中,與CK相比,無論是施用生物炭還是化肥都造成了土壤pH的顯著降低,降幅為0.2—0.6個單位。通過三因素方差分析發現,無論單一施肥、單一施炭還是生物炭與化肥同施都對土壤pH產生顯著影響,另外三因素兩兩間的交互效應也對土壤pH存在顯著影響,但三因素間的交互效應并無顯著影響(表2)。
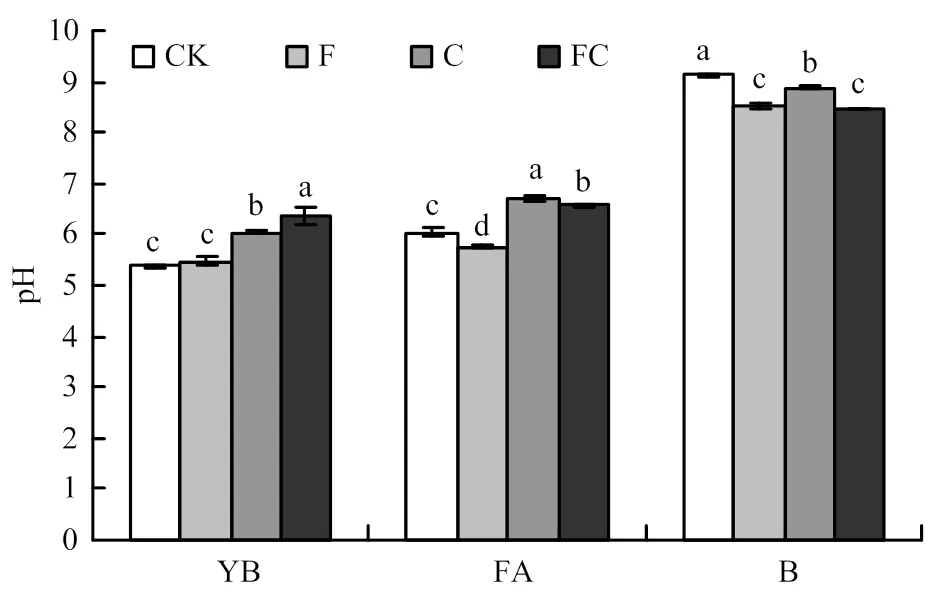
YB:黃棕壤;FA:潮土;B:黑土。CK,F,C,FC分別代表對照,單施化肥,單施生物炭和生物炭與化肥同施4種處理。圖柱上不同字母表示在處理間存在顯著差異(P<0.05)。下同
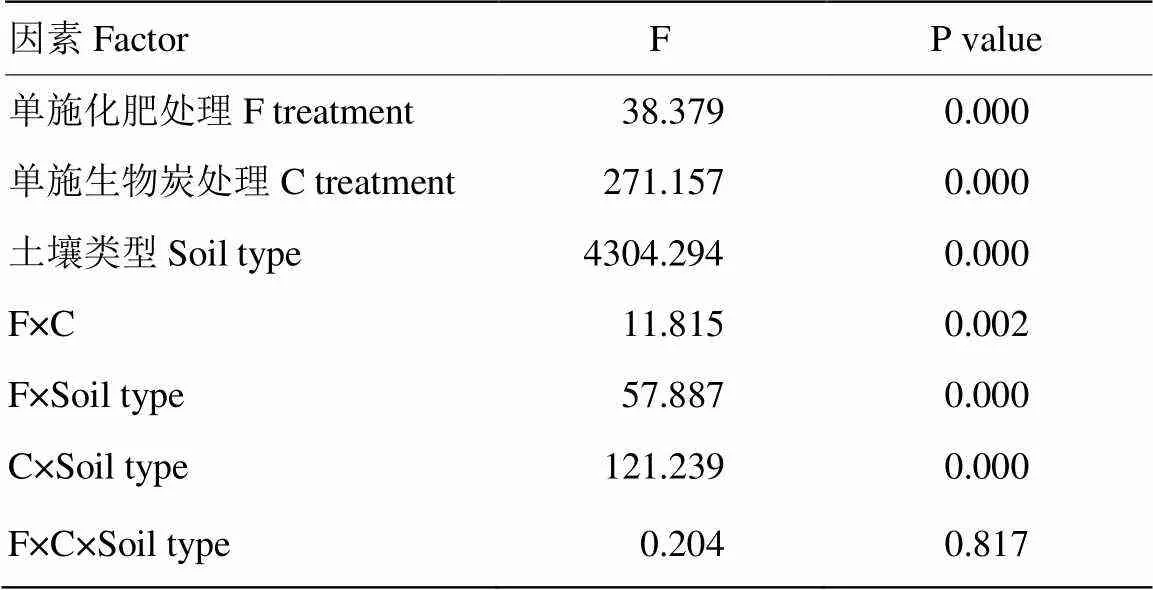
表2 土壤pH三因素方差分析
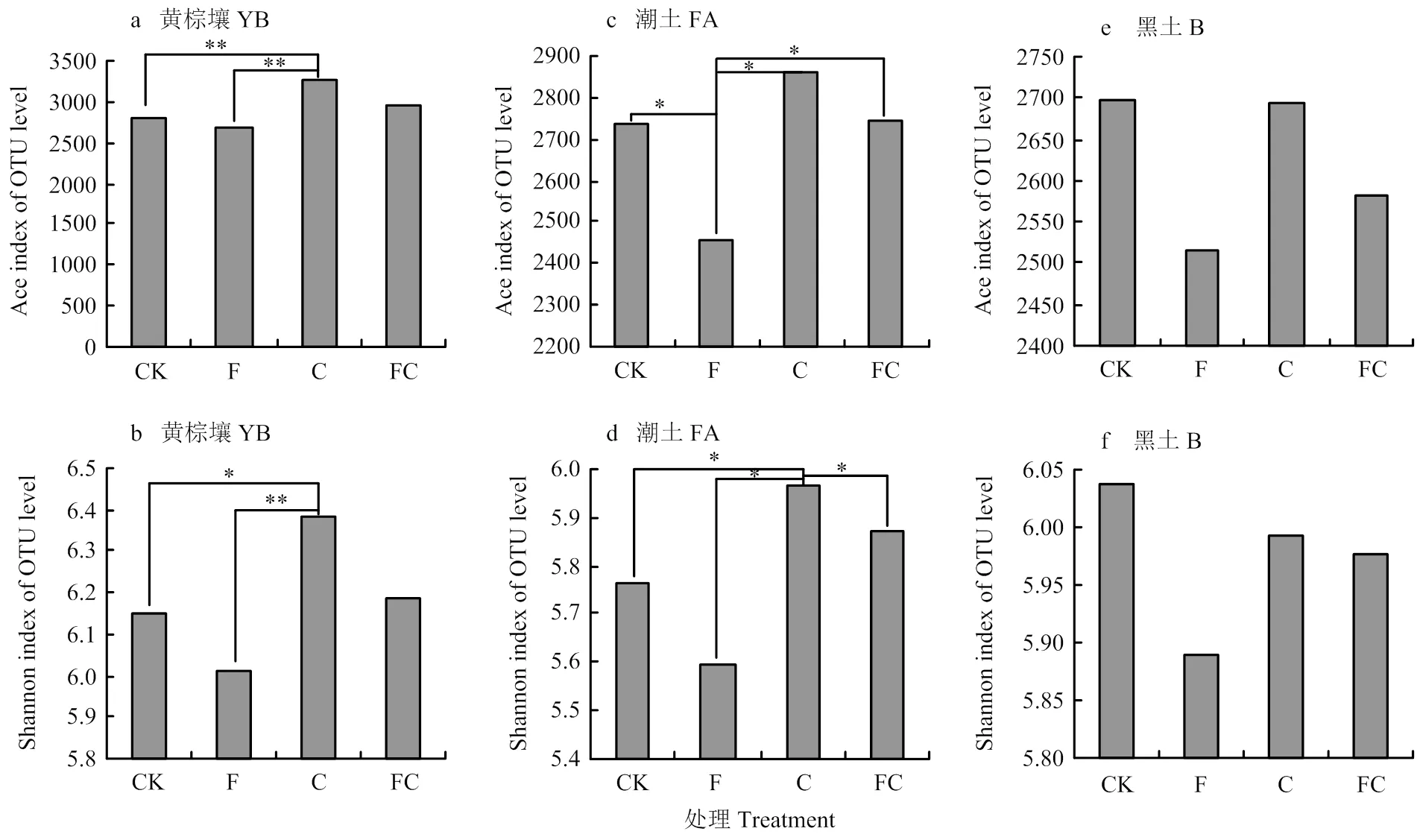
2.2 生物炭對不同土壤細菌、古菌豐富度和多樣性指數的影響
本研究采用Ace指數和shannon指數表示微生物豐富度指數以及多樣性指數,與對照相比分析經化肥或生物炭處理后的指數變化(圖2)。在黃棕壤中單施生物炭提升了土壤細菌和古菌的豐富度和多樣性,且與對照、單施化肥處理之間存在顯著性差異,單施化肥降低了黃棕壤的豐富度和均勻度指數,但無顯著性差異,經炭肥同施后也并未出現顯著變化(圖2-a,圖2-b)。在潮土中,單施化肥降低了土壤細菌和古菌的豐富度和多樣性,但僅在豐富度指數上存在顯著性差異,單施生物炭后細菌和古菌的多樣性指數得到顯著提升,生物炭與化肥同施后細菌和真菌的豐富度和多樣性指數變化幅度均較小(圖2-c,2-d)。在黑土中,不同處理對土壤細菌和古菌豐富度和多樣性指數未出現顯著性改變(圖2-e,2-f)。
2.3 生物炭對不同土壤氨氧化微生物豐度的影響
通過分析測序所得氨氧化微生物的OTU豐度發現,無論是在黃棕壤還是在潮土和黑土中,氨氧化細菌的OTU豐度遠大于氨氧化古菌的OTU豐度。另外,氨氧化古菌經處理后測得的OTU豐度差異性不顯著,而氨氧化細菌在處理后則出現了顯著性差異(表3)。
*代表在0.05水平下差異顯著,**代表在0.01水平下差異顯著
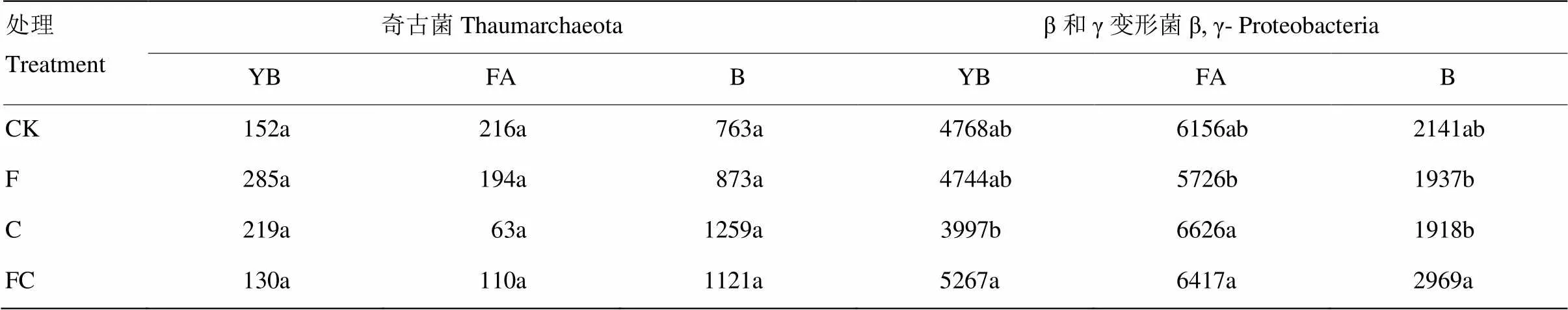
表3 氨氧化微生物OTU豐度
為進一步了解土壤中氨氧化微生物豐度的變化趨勢,針對古菌中的奇古菌和細菌中的β變形菌和γ變形菌的豐度變化進行了分析(圖3)。結果顯示,在黃棕壤氨氧化古菌豐度變化上,奇古菌門在單施化肥和單施生物炭后分別提升了約81.8%和45.6%,但在生物炭與化肥同施時,其豐度下降了約15.0%(圖3-a)。在氨氧化細菌豐度變化上,主要以β變形菌為主,約占92.3%。β和γ變形菌之和以生物炭與化肥同施處理最高,與對照相比提高了14.8%,而單施生物炭卻降低了18.0%(圖3-b)。在潮土中,所有處理對土壤奇古菌門的豐度均存在降低作用,其中施炭處理(F和FC)的降低趨勢最明顯,分別降低了70.5%和48.7%(圖3-c)。另外,潮土中氨氧化細菌主要以β變形菌為主(圖3-d)。與潮土不同的是,黑土中所有處理對奇古菌門的豐度都存在提升趨勢,其中施炭處理(F和FC)提升最明顯,分別提高了66.7%和48.1%(圖3-e)。在氨氧化細菌方面,雖然黑土也以β變形菌為主,但是γ變形菌的豐度比例遠高于其余潮土和黃棕壤。另外,在炭肥同施時黑土中氨氧化細菌的豐度也出現較大幅度的升高(圖3-f)。
2.4 生物炭對不同土壤細菌、古菌群落結構的作用
通過主成分分析細菌和古菌的β多樣性,進一步探究各處理間群落結構的差異(圖4)。在黃棕壤中,單施化肥樣本點與對照樣本點分離程度較低,表明單施化肥對土壤的細菌和古菌的群落結構影響較小。施炭處理(C和FC)與對照在X軸(40.4%)上存在明顯分離,另外單施炭和炭肥同施在Y軸(19.5%)上也存在明顯的分離(圖4-a)。在潮土中,施炭處理(C和FC)樣本點皆分布在第四象限,與對照處理在X軸(42.3%)和Y軸(21.3%)上都存在明顯分離(圖4-b)。在黑土中,對照、單施化肥以及炭肥同施三者之間沒有出現明顯的分離,但是單施化肥樣本點與對照樣本點間距離相對較遠,說明在黑土中單施化肥對土壤細菌和真菌群落結構的影響相對較大(圖4-c)。
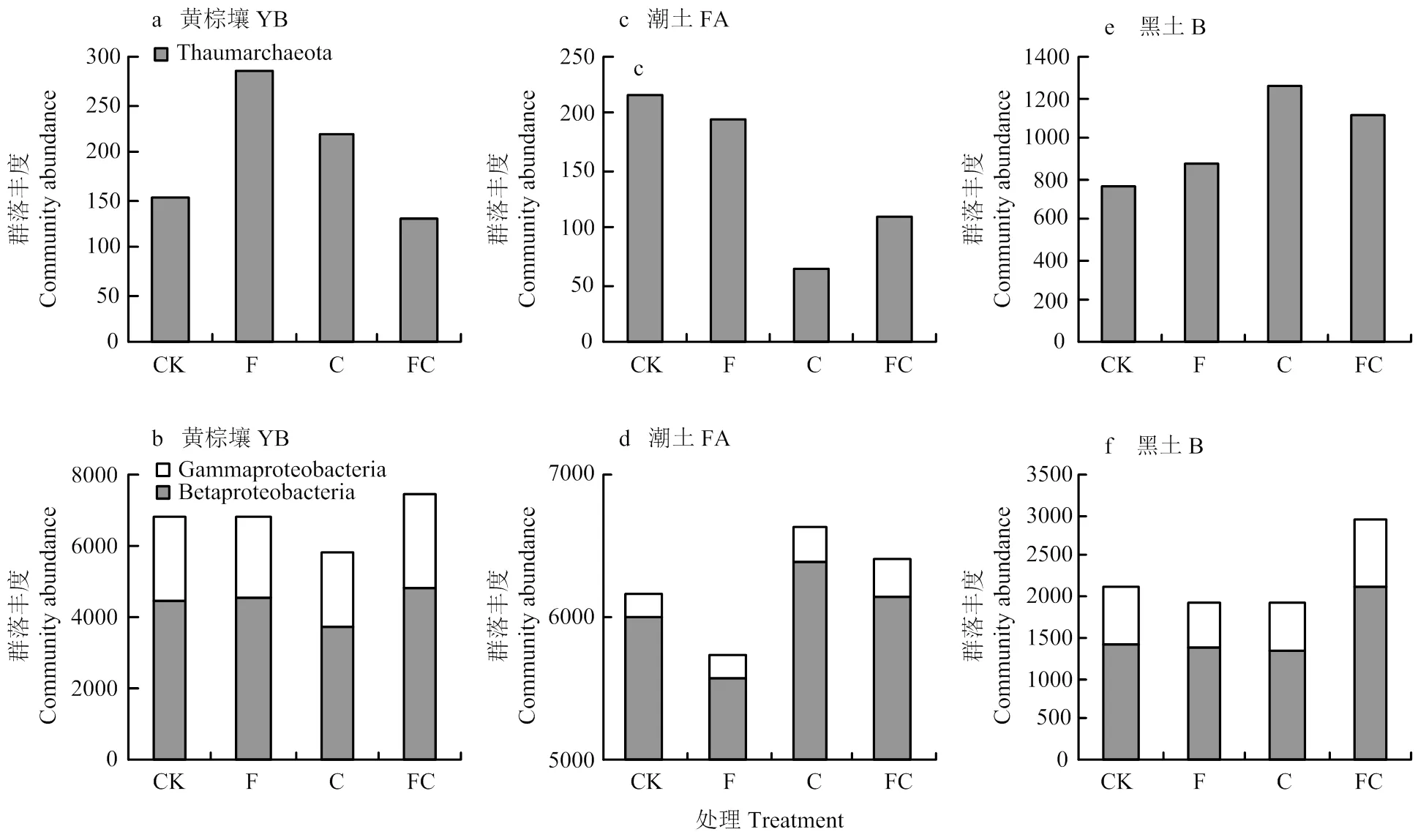
圖3 不同土壤各處理間奇古菌,β變形菌和γ變形菌的豐度變化柱狀圖

圖4 不同土壤各處理間主成分分析
2.5 生物炭對土壤氨合成相關酶和氨氧化作用相關酶基因表達量的影響
土壤中氮素循環過程中需要通過各個支路中各種各樣的酶相互協調完成(圖5,數據網址:http://www. genome.jp/kegg/pathway.html)。根據氮素代謝通路豐度表可以發現,黃棕壤和黑土經化肥或生物炭處理后氮素代謝通路豐度并未發生顯著性改變,但在潮土中添加生物炭后氮素代謝通路豐度出現顯著性降低(表4)。
圖5 KEGG氮素代謝通路
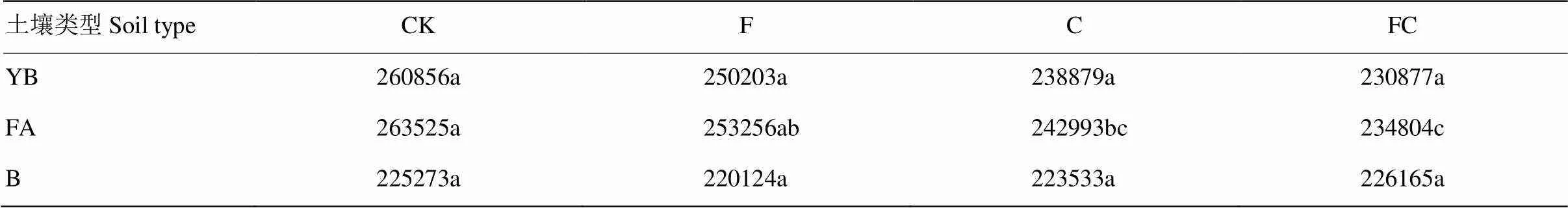
表4 不同土壤各處理的氮代謝通路豐度
根據氮素代謝通路圖可以得到與氮素代謝相關酶和基因的對應關系,并通過比對數據庫得到一些與氨合成和氨氧化作用相關酶的相關表達(表5)。分析氮素代謝通路中相關酶基因表達量,研究在不同土壤不同處理中相關酶的變化情況,發現檢測到的酶在黑土中出現變化的較少,只有甲酰胺酶(1.7.2.1)和腈水解酶(3.5.1.49)在處理間存在顯著差異。然而在黃棕壤和潮土中存在顯著差異的酶數量明顯多于黑土,且不同土壤間經化肥或生物炭處理后出現顯著性差異的酶的種類也存在明顯區別。
黃棕壤中,經化肥或生物炭處理后,與對照相比,氨合成和氨氧化作用相關酶的基因表達量有不同程度的改變,但均未達到顯著差異。在潮土中,生物炭的施用(F、FC)顯著降低了谷氨酸脫氫酶(2.7.2.2),谷氨酸脫氫酶(NAD(P)+)(1.4.1.2),谷氨酸脫氫酶(NADP+)(1.4.1.3)的表達量,另外,單施化肥也顯著降低了谷氨酸脫氫酶(NADP+)(1.4.1.3)的表達量,但會顯著提升亞硝酸還原酶(不分解)(1.4.1.4)的基因表達量。在黑土中經不同處理后基因表達量出現顯著性變化的酶種類較少,甲酰胺酶(1.7.2.1)在炭肥同施時表達量顯著提升,而氰酸裂合酶(3.5.5.1)在單施生物炭時表達量顯著下降。
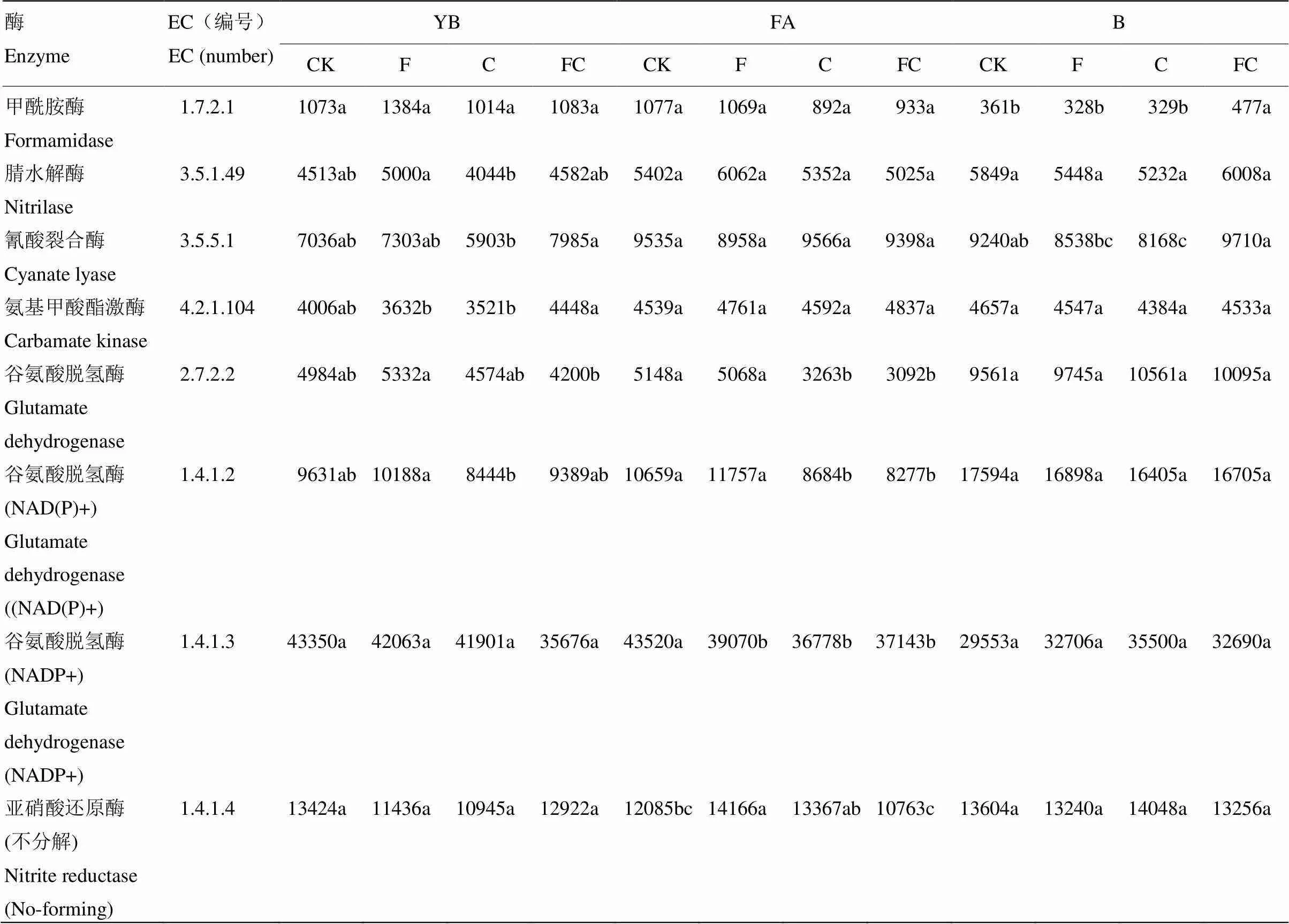
表5 土壤氨合成相關酶和氨氧化作用相關酶基因表達量
3 討論
在本研究中酸性土壤施用生物炭后pH顯著提高了0.6—1.0個單位,但酸性土壤的氨氧化作用不僅未發現顯著提高,還出現了下降的趨勢,黃棕壤氮代謝通路豐度約降低了8.4%,而潮土中奇古菌的豐度約降低了70.5%,氮代謝通路豐度也顯著降低了7.8%,其中在潮土中呈現顯著下降的趨勢,這或許是因為本試驗培養時間較短。另外,土壤pH是影響氨氧化過程相關氨氧化微生物組成及群落結構的重要因素[32],在本研究中,這3種土壤中測得β變形菌和γ變形菌數量遠高于奇古菌數量,表明細菌在這三種土壤的氨氧化作用中占主導地位。很多研究都表明大多數酸性土壤中,氨氧化古菌的數量要高于氨氧化細菌,因為氨氧化古菌對低pH有更強的適應能力[33-36]。本試驗采用的3種土壤分別為酸性,弱酸性以及堿性土壤,單施化肥對土壤pH的影響比生物炭弱,生物炭的添加顯著提升了酸性土壤的pH,但是土壤依舊呈酸性,而黑土在施用生物炭后顯著降低了pH,但土壤也仍呈堿性,在本研究中并未發現酸性土壤中奇古菌占優勢。這可能與515F和806R作為測序引物有關,該引物可以用于鑒定細菌和古菌,但是更偏向于細菌鑒定[37],或許在古菌的鑒定上存在一定偏差。
ABUJABHAH等[25]認為熱解溫度為650—750℃的桉樹生物炭對土壤微生物群落和氮循環細菌的影響主要取決于土壤類型,其中對施用于紅壤時作用明顯高于棕壤。LIU等[26]施用了0—40 t·hm-2的稻殼生物炭(400℃)于紅壤、棕壤和鹽漬土中,結果發現生物炭對紅壤細菌群落改變最顯著。通過我們的研究也發現,花生殼生物炭對黃棕壤和潮土的細菌群落結構影響更明顯,這表明生物炭對偏酸性土壤微生物群落結構存在更顯著的作用,主要原因是生物炭顯著提高了酸性土壤的pH,從而導致細菌群落發生顯著改變。很多生物炭研究圍繞不同土壤氨氧化微生物的改變得到了不同的結果。HE等[38]發現熱解溫度為500℃的稻殼生物炭不會對堿性土壤產生顯著影響,但會改變酸性土壤的氨氧化微生物豐度。李雙雙等[39]在黃棕壤中施用熱解溫度為500℃的小麥秸稈炭發現單獨施用生物炭顯著降低了氨氧化細菌的豐度。也有相應研究發現在復墾土壤中施用400—500℃熱解成的小麥秸稈生物炭會提高土壤氨氧化細菌和古菌的豐度,并且氨氧化細菌的豐度還會隨著生物炭用量的增加而增加[40]。我們的研究結果與之不同,我們發現生物炭的施用主要降低酸性土壤中氨氧化細菌的豐度,研究結果間的差異主要與土壤類型有關。BI等[41]在砂壤土中僅施用在600℃下熱解得到的稻草炭后發現并未顯著影響土壤氨氧化微生物,WU等[42]也在砂壤土上進行了玉米芯生物炭的試驗,結果也發現僅施用生物炭并未顯著改變氨氧化微生物的組成。結合前人的研究和本試驗的結果可以發現,生物炭對土壤微生物的影響,因炭而異,因土而異,在使用生物炭的時候應考慮生物炭類型和土壤類型。同時也有研究者發現長期添加生物炭和短期施用生物炭的土壤中微生物群落存在明顯差異[43-44]。本研究周期相對較短,與長期試驗結果是否一致有待進一步探討。
有研究認為土壤微生物群落對化肥的投入以及土壤營養條件的改變十分敏感[45],但在不同報道中的結果差異很大且沒有清晰的趨勢,有研究表明肥料的施用與否對細菌群落無顯著影響[46-47],但也有研究表明施肥導致了微生物群落組成的改變[48-49]。本研究中,單施化肥時并未發現黃棕壤、潮土、黑土出現顯著性差異。這與GEISSELER等[50]的研究結果相似,他發現絕大部分研究中土壤主要的微生物群落并沒有因為化肥的施用而產生明顯的改變。同樣在Ultuna 和Broadbalk 的冬小麥試驗中,化肥與不施肥處理相比較,細菌的群落組成并沒有顯著的差異[46-47,51]。
4 結論
在土壤氨氧化作用中,黃棕壤、潮土和黑土都表現為氨氧化細菌占主導地位。生物炭的添加在短期內會對黃棕壤及潮土的細菌和古菌群落結構產生顯著影響。施用生物炭后,在短期內潮土的合成氨相關酶基因表達量顯著降低,氨氧化古菌豐度也明顯降低,從而抑制了氨氧化作用;化肥和生物炭對黃棕壤和黑土的氨氧化作用也存在一定程度的影響。
[1] CANFIELD D E, GLAZER A N, FALKOWSKI P G. The evolution and future of Earth's nitrogen cycle., 2010, 330(6001): 192-196.
[2] 李霞. 微生物在氮循環中的作用. 松遼學刊(自然科學版), 1998, 10(4): 30-33.
LI X. The role of microorganisms in the nitrogen cycle., 1998, 10(4): 30-33. (in Chinese)
[3] 賀紀正, 張麗梅. 氨氧化微生物生態學與氮循環研究進展. 生態學報, 2009, 29(1): 406-415.
HE J Z, ZHANG L M. Advances in ammonia oxidation microbial ecology and nitrogen cycle., 2009, 29(1): 406-415. (in Chinese)
[4] 陳溫福, 張偉明, 孟軍, 徐正進. 生物炭應用技術研究. 中國工程科學, 2011, 13(2):83-89.
CHEN W F, ZHANG W M, MENG J, XU Z J. Biochar application technology research.2011, 13(2): 83-89. (in Chinese)
[5] 陳心想, 何緒生, 耿增超, 張雯, 高海英. 生物炭對不同土壤化學性質、小麥和糜子產量的影響. 生態學報, 2013, 33(20): 6534-6542.
CHEN X X, HE X S, GENG Z C, ZHANG W, GAO H Y. Effects of biochar on different soil chemical properties, wheat and hazelnut yield.2013, 33(20): 6534-6542. (in Chinese)
[6] 鄭瑞倫, 王寧寧, 孫國新, 謝祖彬, 龐卓, 王慶海, 武菊英. 生物炭對京郊沙化地土壤性質和苜蓿生長、養分吸收的影響. 農業環境科學學報, 2015, 34(5): 904-912.
ZHENG R L, WANG N N, SUN G X, XIE Z B, PANG Z, WANG Q H, WU J Y. Effects of biochar on soil properties, alfalfa growth and nutrient uptake in desertification areas of Beijing suburbs., 2015, 34(5): 904-912. (in Chinese)
[7] 李昌見, 屈忠義, 勾芒芒, 蘇永莉, 霍星. 生物炭對土壤水肥利用效率與番茄生長影響研究. 農業環境科學學報, 2014, 33(11): 2187-2193.
LI C J, QU Z Y, GOU M M, SU Y L, HUO X. Effects of biochar on soil water and fertilizer utilization efficiency and tomato growth., 2014, 33(11): 2187-2193. (in Chinese)
[8] 呂波, 王宇函, 夏浩, 姚子涵, 姜存倉. 不同改良劑對黃棕壤和紅壤上白菜生長及土壤肥力影響的差異. 中國農業科學, 2018, 51(22): 4306-4315.
LV B, WANG Y H, XIA H, YAO Z H, JIANG C C. Effects of Biochar and Other Amendments on the Cabbage Growth and Soil Fertility in Yellow-Brown Soil., 2018, 51(22): 4306-4315. (in Chinese)
[9] 應介官, 林慶毅, 張夢陽, 黃毅, 彭抒昂, 姜存倉. 生物炭對鋁富集酸性土壤的毒性緩解效應及潛在機制. 中國農業科學, 2016, 49(23): 4576-4583.
YING J G, LIN Q Y, ZHANG M Y, HUANG Y, PENG S A, JIANG C C. Mitigative effect of biochar on aluminum toxicity of acid soil and the potential mechanism., 2016, 49(23): 4576-4583. (in Chinese)
[10] ASADA T, ISHIHARA S, YAMANE T, TOBA A, YAMADA A. Science of bamboo charcoal: Study of carbonizing temperature of bamboo charcoal and removal capability of harmful gases., 2002, 48(6): 473-479.
[11] ASADA T, OHKUBO T, KAWATA K, OIKAWA K. Ammonia adsorption on bamboo charcoal with acid treatment., 2006, 52(5): 585-589.
[12] CLOUGH T J, BERTRAM J E, RAY J L, CONDRON L M, O'CALLAGHAN M, SHERLOCK R R, WELLS N S. Unweathered wood biochar impact on nitrous oxide emissions from a bovine-urine- amended pasture soil., 2010, 74(3): 852-860.
[13] CAYUELA M L, SáNCHEZ-MONEDERO M A, ROIG A, HANLEY K, ENDERS A, LEHMANN J. Biochar and denitrification in soils: when, how much and why does biochar reduce N2O emissions?, 2013, 3: 1732.
[14] VERHOEVEN E, SIX J. Biochar does not mitigate field-scale N2O emissions in a Northern California vineyard: an assessment across twoyears., 2014, 191(15): 27-38.
[15] PURKHOLD U, POMMERENINGR?SER A, JURETSCHKO S, SCHMID M C, KOOPS H P, WAGNER M. Phylogeny of all recognized species of ammonia oxidizers based on comparative 16S rRNA and amoA sequence analysis: implications for molecular diversity surveys., 2000, 66(12): 5368-5382.
[16] MONTEIRO M, SéNECA J, MAGALH?ES C. The history of aerobic ammonia oxidizers: from the first discoveries to today., 2014, 52(7): 537-547.
[17] TREUSCH A, LEININGER S, KLETZIN A, SCHUSTER S, KLENK H, SCHLEPER C. Novel genes for nitrite reductase and Amo-related proteins indicate a role of uncultivated mesophilic crenarchaeota in nitrogen cycling., 2005, 7(12): 1985-1995.
[18] BROCHIERARMANET C, BOUSSAU B, GRIBALDO S, FORTERRE P. Mesophilic crenarchaeota: proposal for a third archaeal phylum, the Thaumarchaeota., 2008, 6(3): 245-252.
[19] PESTER M, SCHLEPER C, WAGNER M. The Thaumarchaeota: an emerging view of their phylogeny and ecophysiology., 2011, 14(3): 300-306.
[20] SINGH B P, HATTON B J, BALWANT S, COWIE A L, KATHURIA A. Influence of biochars on nitrous oxide emission and nitrogen leaching from two contrasting soils., 2010, 39(4): 1224-1235.
[21] STEINER C, TEIXEIRA W G, LEHMANN J, NEHLS T, DE MACêDO J L V, BLUM W E H, ZECH W. Long term effects of manure, charcoal and mineral fertilization on crop production and fertility on a highly weathered Central Amazonian upland soil., 2007, 291(1/2): 275-290.
[22] RONDON M A, LEHMANN J, RAMíREZ J, HURTADO M. Biological nitrogen fixation by common beans (L.) increases with bio-char additions., 2007, 43(6): 699-708.
[23] BALL P N, MACKENZIE M D, DELUCA T H, HOLBEN W E. Wildfire and charcoal enhance nitrification and ammonium-oxidizing bacterial abundance in dry montane forest soils., 2010, 39(4): 1243-1253.
[24] SPOKAS K A, REICOSKY D C. Impacts of sixteen different biochars on soil greenhouse gas production., 2009, 3(1): 179-193.
[25] ABUJABHAH I S, DOYLE R B, BOUND S A, BOWMAN J P. Assessment of bacterial community composition, methanotrophic and nitrogen-cycling bacteria in three soils with different biochar application rates., 2018, 18(1): 148-158.
[26] LIU S N, MENG J, JIANG L L, YANG X, LAN Y, CHENG X Y, CHEN W F. Rice husk biochar impacts soil phosphorous availability, phosphatase activities and bacterial community characteristics in three different soil types., 2017, 116: 12-22.
[27] MAGO? T, SALZBERG S L. FLASH: fast length adjustment of short reads to improve genome assemblies., 2011, 27(22): 2957-2963.
[28] EDGAR R C. UPARSE: highly accurate OTU sequences from microbial amplicon reads., 2013, 10(10): 996.
[29] WANG Q, GARRITY G M, TIEDJ J M, COLE J R. Na?ve bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy., 2007, 73(16): 5261-5267.
[30] CHAO A, BUNGE J. Estimating the number of species in a stochastic abundance model., 2002, 58(3): 531-539.
[31] LANGILLE M G I, ZANEVELD J, CAPORASO J G, McDonald D, Knights D, Reyes J A, Clemente J C, Burkepile D E, Thurber R L V, Knight R, Beiko R G, Huttenhower C. Predictive functional profiling of microbial communities using 16S rRNA marker gene sequences., 2013, 31(9): 814.
[32] 郭赟. 長期施肥對酸性及中性水稻土壤中氨氧化微生物的影響[D]. 南京: 南京師范大學, 2013.
GUO Y. Effects of long-term fertilization on ammonia-oxidizing microorganisms in acidic and neutral rice soils[D]. Nanjing: Nanjing Normal University, 2013. (in Chinese)
[33] PROSSER J I. Autotrophic nitrification in bacteria., 1989, 30(1): 125-181.
[34] LEININGER S, URICH T, SCHLOTER M, SCHWARK L, QI J, NICOL G W, PROSSER J I, SCHUSTER S C, SCHLEPER C. Archaea predominate among ammonia-oxidizing prokaryotes in soils., 2006, 442: 806-809.
[35] NICOLE G W, LEININGER S, SCHLEPER C, PROSSER J I. The influence of soil pH on the diversity, abundance and transcriptional activity of ammonia oxidizing archaea and bacteria.2010, 10(11): 2966-2978.
[36] NEJC S, GUBRYRANGIN C, ?PELA H, GRAEME W N, INES M, JAMES I P. Thaumarchaeal ammonia oxidation in an acidic forest peat soil is not influenced by ammonium amendment., 2010, 76(22): 7626.
[37] LIAO X, CHEN C, ZHANG J, DAI Y, ZHANG X, XIE S. Operational performance, biomass and microbial community structure: impacts of backwashing on drinking water biofilter.l, 2015, 22(1): 546.
[38] HE L L, BI Y C, ZHAO J, PITTELKOW C M, ZHAO X, WANG S Q, XING G X. Population and community structure shifts of ammonia oxidizers after four-year successive biochar application to agricultural acidic and alkaline soils., 2018, 619: 1105-1115.
[39] 李雙雙, 陳晨, 段鵬鵬, 許欣, 熊正琴. 生物質炭對酸性菜地土壤NO排放及相關功能基因豐度的影響. 植物營養與肥料學報, 2018, 24(2): 414-423.
LI S S, CHEN C, DUAN P P, XU X, XIONG Z Q. Effects of biochar on NO emission and related functional gene abundance in acidic vegetable soils., 2018, 24(2): 414-423. (in Chinese)
[40] 劉遠, 朱繼榮, 吳雨晨, 束良佐. 施用生物質炭對采煤塌陷區土壤氨氧化微生物豐度和群落結構的影響.應用生態學報, 2017, 28(10): 3417-3423.
LIU Y, ZHU J R, WU Y C, SHU L Z. Effects of application of biomass carbon on ammonia microbial abundance and community structure in coal mining subsidence area.2017, 28(10): 3417-3423. (in Chinese)
[41] BI Q F, CHEN Q H, YANG X R, LI H, ZHENG B X, ZHOU W W, LIU X X, DAI P B, LI K J, LIN X Y. Effects of combined application of nitrogen fertilizer and biochar on the nitrification and ammonia oxidizers in an intensive vegetable soil., 2017, 7: 108.
[42] WU H P, ZENG G M, LIANG J, CHEN J, XU J J, DAI J, LI X D, CHEN M, XU P, ZHOU Y Y, Li F, HU L, WAN J. Responses of bacterial community and functional marker genes of nitrogen cycling to biochar, compost and combined amendments in soil.2016, 100: 8583-8591.
[43] JIN H. Thesis: Characterization of microbial life colonizing biochar and biochar-amended soils[D]. Ithaca: Cornell University, 2010.
[44] KHODADAD C L M, ZIMMERMAN A R, GREEN S J, UTHANDI S, FOSTER J S. Taxa-specific changes in soil microbial community composition induced by pyrogenic carbon amendments.2011, 43(2): 385-392.
[45] ALLISON S D, MARTINY J B H. Resistance, resilience, and redundancy in microbial communities., 2008, 105(32): 11512-11519.
[46] B?RJESSON G, MENICHETTI L, KIRCHMANN H, KATTERER T. Soil microbial community structure affected by 53 years of nitrogen fertilisation and different organic amendments., 2012, 48(3): 245-257.
[47] HALLIN S, JONES C M, SCHLOTER M, PHILIPPOT L. Relationship between N-cycling communities and ecosystem functioning in a 50-year-old fertilization experiment., 2009, 3(5): 597.
[48] HARTMANN M, FLIESSBACH A, OBERHOLZER H R, WIDMER F. Ranking the magnitude of crop and farming system effects on soil microbial biomass and genetic structure of bacterial communities., 2006, 57(3): 378-388.
[49] ZHONG W H, GU T, WEI W, ZHANG B, LIN X, HUANG Q, SHEN W. The effects of mineral fertilizer and organic manure on soil microbial community and diversity., 2010, 326(1/2): 511-522.
[50] GEISSELER D, LAZICKI P A, SCOW K M. Mineral nitrogen input decreases microbial biomass in soils under grasslands but not annual crops.2016, 106: 1-10.
[51] OGILVIE L A, HIRSCH P R, JOHNSTON A W B. Bacterial diversity of the Broadbalk ‘Classical’ winter wheat experiment in relation to long-term fertilizer inputs., 2008, 56(3): 525-537.
Short-term Effect of Biochar Amendments on Total Bacteria and Ammonia Oxidizers Communities in Different Type Soils
ZHANG MengYang1, XIA Hao1, Lü Bo1, CONG Ming1, SONG WenQun2, JIANG CunCang1
(1Microelement Research Center, College of Resources and Environment, Huazhong Agricultural University, Wuhan 430070;2Xinfeng’s Agricultural Technology Promotion Station, Ganzhou 341600, Jiangxi)
【Objective】Ammonia oxidation is the first step in nitrification and the rate-limiting step in nitrification. It is a key link in the global nitrogen cycle. The purpose of this experiment was to study the effects of peanut shell biochar application on bacteria and ammonia oxidation in different type soils in China, so as to provide a theoretical basis for the promotion and use of biochar.【Method】Yellow-brown soil, fluvo-aquic soil and black soil were utilized as the tested soil. Through short-term culture experiments, 16SrRNA sequencing was used to study the effects of biochar on ammonia-oxidizing microorganisms, bacterial community structure and related enzyme gene expression in different type soils. Four treatments for each soil included CK (no fertilizer and biochar), F (single fertilization), C (single 2% peanut shell biochar), and FC (application of fertilizer + 2% peanut shell biochar).【Result】Acid soil pH increased significantly by 0.5-1.0 units after application of biochar (C, FC), but alkaline soil pH decreased significantly by 0.5-0.6 units; the microbial abundance and diversity of yellow-brown soil increased significantly caused by single application of biochar (C). The fluvo-aquic only significantly increased the microbial diversity index of the soil when it was applied to biochar alone (C). Biochar and chemical fertilizers did not significantly change soil abundance and diversity in black soil; the abundance of ammonia-oxidizing bacteria in three soils was higher than that of ammonia-oxidizing archaea. The measured OTU abundance of ammonia-oxidizing bacteria was about 8.1 times that of ammonia-oxidizing archaea. Biochar and chemical fertilizers did not significantly alter the OTU abundance in the thaumarchaeota, but had a significant effect on the OTU abundance in the beta and gamma proteobacteria. The ammonia-oxidizing bacteria of the three soils were mainly β-proteobacteria, accounting for about 60%. In addition, the application of biochar (C, FC) significantly changed the microbial community structure of yellow-brown soil on PC1 (40.4%), and significantly changed the microbial community structure of fluvo-aquic soil on both PC1 (42.3%) and PC2 (21.3%). After application of biochar (C, FC), the expression of ammonia synthesis related enzyme gene in fluvo-aquic soil decreased significantly by 14.7%-39.9% in a short period of time, and the ammoxidation archaea abundance decreased by 70.5% and 48.7% under C treatment and FC treatment, respectively.【Conclusion】After application of biochar, the microbial community structure of yellow-brown soil and fluvo-aquic soil was significantly changed, and the ammoxidation of fluvo-aquic soil was obviously inhibited in a short period of time.
biochar; chemical fertilizer; ammonia oxidation; microbial community structure; yellow-brown soil; fluvo-aquic soil; black soil
10.3864/j.issn.0578-1752.2019.07.013
2018-09-10;
2018-10-29
國家重點研發計劃(2017YFD0200800)
張夢陽,Tel:027-87287141;E-mail:zhangmengyang@webmail.hzau.edu.cn。通信作者姜存倉,Tel:027-87287141;E-mail:jcc2000@mail. hzau.edu.cn
(責任編輯 李云霞)

