扁果枸杞肌動蛋白基因片段的克隆及其表達特征分析
袁惠君,李學勇,高澤,王春梅,李虎軍
1(蘭州理工大學 生命科學與工程學院,甘肅 蘭州,730050) 2(中國農業科學院,蘭州畜牧與獸藥研究所,甘肅 蘭州,730050) 3(蘭州大學 草地農業科技學院,草地農業生態系統國家重點實驗室,甘肅 蘭州,730020)
扁果枸杞(LyciumbarbarumBianguo)是寧夏枸杞(LyciumbarbarumL.)的一個品種,其干燥果實具有極高的營養價值,枸杞多糖和還原型VC含量分別達11.18 mg/100 g和1 234.64 mg/100 g,遠高于寧杞1號、寧杞7號、寧杞0901等常規栽培品種[1-3]。同時,扁果枸杞還具有極強的抗旱耐鹽特性,在滲透脅迫下能通過體內積累適量的Na+,調控體內滲透平衡,改善細胞水分狀況,維持其正常的生長[4],是研究植物抗逆機理和挖掘抗逆基因資源用于作物遺傳育種的研究材料。
肌動蛋白(actin)ACT基因是真核生物細胞中一種普遍存在的組成型表達的看家基因,編碼的肌動蛋白是細胞骨架中微絲的主要組分,參與細胞分裂、內吞、信號傳導、頂端生長、細胞器運動等多種生命活動[5]。ACT基因表達量高且穩定,序列高度保守[6],是用于基因表達分析的理想內參基因[7-9],但有關扁果枸杞ACT基因克隆未見報道。本研究用RT-PCR法克隆扁果枸杞ACT基因核心片段,并進行一系列序列分析,為深入研究寧夏枸杞功能基因和果實品質改良奠定分子基礎。
1 材料與方法
1.1 試驗材料
扁果枸杞種子于2013年7月采自白銀市景泰縣玉杰農貿有限公司枸杞引種示范基地,以3周齡幼苗為實驗材料。
pUC18-T載體、UNIQ-10柱式Trizol總RNA抽提試劑盒、SanPrep柱式DNA膠回收試劑盒、T-載體PCR產物克隆試劑盒、4S Red Plus Nucleic Acid Strain、6×Loading Buffer、X-gal、IPTG、Amp、V(氯仿)∶V(異戊醇) =24∶1、無水乙醇等,均購自上海生工生物工程有限公司。大腸桿菌菌株DH5α、PrimeScriptTMⅡ第一鏈cDNA合成試劑盒和PCR擴增試劑盒,均購自大連TAKARA生物工程有限公司。DNA marker,購自北京天根生化科技有限公司。瓊脂糖,購自Sigma公司。其他試劑均為國產分析純,樣品測序由華大基因完成。
1.2 儀器與設備
DYY-6C型電泳儀,北京市六一儀器廠;Genesy 96T型PCR擴增儀,西安天隆科技有限公司;5424R型高速冷凍離心機,德國Eppendorf公司;Nichipet ExⅡ型移液槍,日本立洋公司;7500 Real-Time PCR System,Life Technologies Holdings Pte Ltd.;HH-S6型電熱恒溫水浴鍋,北京科偉永興儀器有限公司。
1.3 方法
1.3.1 材料培養
參考文獻方法[4],挑選籽粒飽滿的種子用體積分數2%次氯酸鈉消毒后,鋪在有濕潤濾紙的平皿里,待種子萌發后種于蛭石中,澆灌1/2 Hoagland營養液,每3 d換1次營養液,溫室的晝夜溫度分別為(24±2) ℃,(18±2) ℃,光照時間16 h/d,光照強度約600 μmol/(m2·s),相對濕度約為50%。挑選生長健壯的3周齡幼苗用于實驗。
1.3.2 總RNA的提取和cDNA的合成
取3周齡幼苗的根、莖和葉80~100 mg,置于液氮中速凍并研磨后,按照RNA抽提試劑盒說明提取總RNA。將提取到的總RNA在使用和保存之前取2 μL 用核酸定量儀檢測總RNA純度和濃度,取A260/A280的值在1.8~2.0的RNA樣本根據測定出的RNA濃度計算下一步合成cDNA所需模板的用量。cDNA第一鏈合成按照試劑盒說明書進行。
1.3.3 引物設計與合成
從NCBI數據庫下載番茄、馬鈴薯、煙草等茄科植物已知ACT基因的序列,進行同源性比較后篩選高度保守的區段,利用DNAMAN 6.0和Primer 5.0生物軟件設計一對引物P1、P2。用該引物擴增扁果枸杞ACT基因片段,預測所得片段長度為598bp。引物由上海生工合成。P1:5’- GTGGTCGTACAACAGGTATTGTG -3’;P2:5’- GAACCTCCAATCCAGACACTG -3’。
1.3.4 RT-PCR擴增
以扁果枸杞葉反轉錄得到的cDNA為模板,進行PCR擴增,25 μL反應體系包含2 μL cDNA、引物P1、P2各1 μL、0.5 μL dNTP(10 mmol/L)、2.5 μL緩沖液、0.2 μLTaq酶,加17.8 μL ddH2O補足體系。PCR擴增程序為94 ℃預變性3 min;94 ℃變性30 s,56.5 ℃退火30 s,72 ℃延伸1 min,30個循環;72 ℃延伸10 min。 PCR產物經12 g/L瓊脂糖凝膠電泳檢測后切下目的條帶,用SanPrep柱式DNA膠回收試劑盒回收片段。根據T-載體PCR產物克隆試劑盒說明,將回收片段重組入pMD18-T載體,再用熱激法將連接產物轉化DH5α感受態細胞,并接種到含有X-gal、IPTG、Amp的Luria-Bertanil(LB)固體培養基上,37 ℃ 培養過夜,隨機挑取白色菌斑接入1 mL含有100 μg/mL Amp的LB液體培養基中,37 ℃振蕩培養8~12 h后離心并收集菌體,用菌液PCR的方法篩選出陽性克隆,送至華大基因北京測序部進一步測序鑒定。
1.3.5 序列分析
從NCBI數據庫下載其他植物ACT蛋白的氨基酸序列,用DNAMAN生物分析軟件進行多重比對,并用MEGA 5.1 軟件進行系統發育分析和進化樹構建,用Neighbor joining法構建進化樹,自展次數為1 000 次。
1.3.6 鹽處理下LbACT表達特性分析
鹽處理如下,用含有0(對照)、50、100、150、200 mmol/L NaCl的1/2 Hoagland營養液處理3周齡扁果枸杞幼苗24 h后,分別取根、莖、葉提取總RNA。每個處理3個重復,每個重復包括2~3株幼苗。
根據已經得到的LbACT基因片段的序列設計LbACT實時定量引物QA1:5’-CTATGAGTTGCCAGATGGACAG-3’;QA2:5’-TGGCTGGAAAAGGACTTCTG-3’。參照TAKARAPrimeScriptTMeRT reagent Kit with gDNA Eraser (perfect real time)反轉錄試劑盒說明書,合成第一鏈cDNA,并根據SYBR?Premix Ex TaqTMⅡ(Tli RNaseH Plus)試劑盒說明書以第一鏈cDNA為模板,建立20 μL實時定量PCR反應體系:10.0 μL的SYBR Premix Ex Taq Ⅱ(Tli RNaseH Plus)(2×)、引物QA1和QA2各0.8 μL、0.4 μL 的ROX Reference Dye(50×)、2.0 μL的cDNA模板及6.0 μL滅菌水。由7500 Real-Time PCR系統進行PCR反應后,用SPSS 17.0和Microsoft Excel 2013軟件對儀器自動得出各樣品Ct值進行統計分析和作圖。
2 結果與分析
2.1 總RNA的提取及檢測
以扁果枸杞根、莖和葉為材料提取的總RNA,經過瓊脂糖凝膠電泳檢測,結果表明,28S rRNA和18S rRNA條帶清晰(圖1),前者亮度約是后者的2倍,說明提取的RNA完整性較好,可用于RT-PCR擴增。
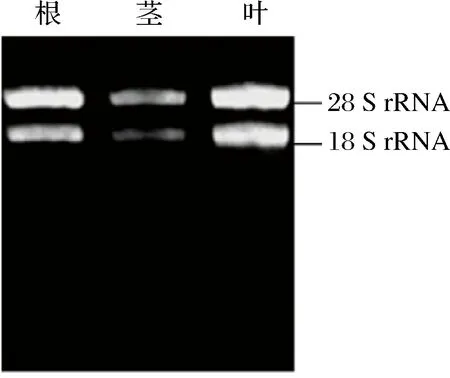
圖1 扁果枸杞根、莖和葉總RNA提取Fig.1 Electrophoresis of total RNA fromroot, stem and leaf in L. barbarum Bianguo
2.2 RT-PCR擴增及陽性克隆的鑒定
以扁果枸杞葉總RNA反轉錄所得到的第一鏈cDNA為模板,用引物P1和P2進行PCR擴增,得到的產物經瓊脂糖凝膠電泳(圖2),在500 bp~750 bp有一條亮帶,且上下無雜帶,與預測的目的片段大小一致,表明該條帶可能是目的基因片段,有待進一步測序鑒定。
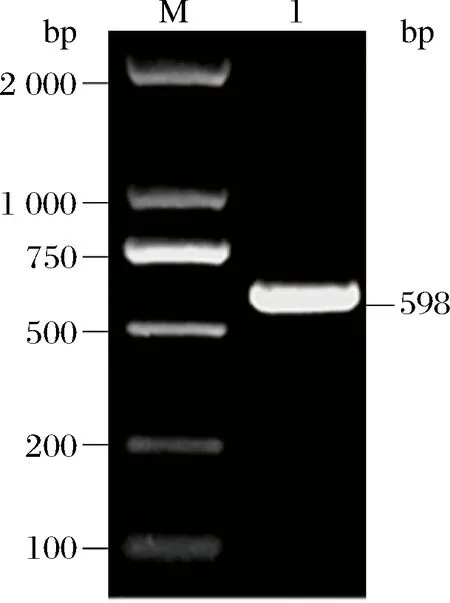
M-DNA Marker; 1-PCR擴增產物圖2 扁果枸杞LbACT基因片段的PCR產物凝膠電泳Fig.2 Electrophoresis of the fragments of LbACT gene by PCR
目的片段經回收、連接到pMD18-T克隆載體,并轉化大腸桿菌DH5α。從轉化平板上隨機挑取8個菌斑培養后,用菌液PCR的方法擴增目的片段,并經瓊脂糖凝膠電泳檢測,選擇在500~750 bp出現一條亮帶(圖3),與預測目的片段大小一致的菌斑初步確定為陽性克隆。
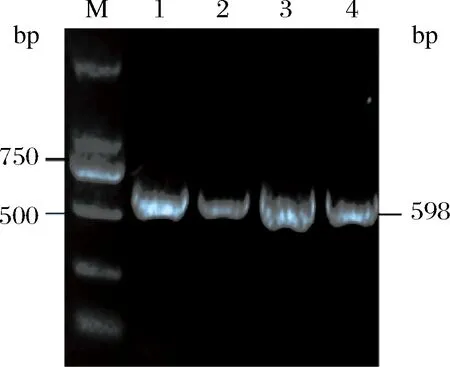
M-DNA Marker;1~4-PCR擴增產物圖3 扁果枸杞LbACT基因片段PCR產物陽性克隆凝膠電泳Fig.3 Electrophoresis of positive clones of LbACT gene by PCR
2.3 序列分析
隨機挑取陽性克隆培養后進行測序和分析,得到一段長度為598 bp的序列,編碼198個氨基酸(圖4)。

圖4 扁果枸杞LbACT基因片段的核苷酸序列及其推測的氨基酸序列Fig.4 Nucleic acid sequence and deduced amino acid sequence of actin gene fragment fromleaf in L. barbarum Bianguo
Blast比對結果表明,該片段與其他100種植物ACT基因核苷酸序列的相似性在87%~97%,其中與枸杞(Lyciumchinense)核苷酸序列的同源性達到100%。將預測的扁果枸杞氨基酸序列片段和其他11種植物肌動蛋白基因的氨基酸序列進行多重比較,發現其保守氨基酸多達167個,而非保守氨基酸僅有31個(圖5)。



圖5 扁果枸杞LbACT氨基酸序列與其他植物Actin氨基酸序列多重比較Fig.5 Multiple comparison in amino acid sequence of actin between leaves of L. barbarum Bianguo and other plants
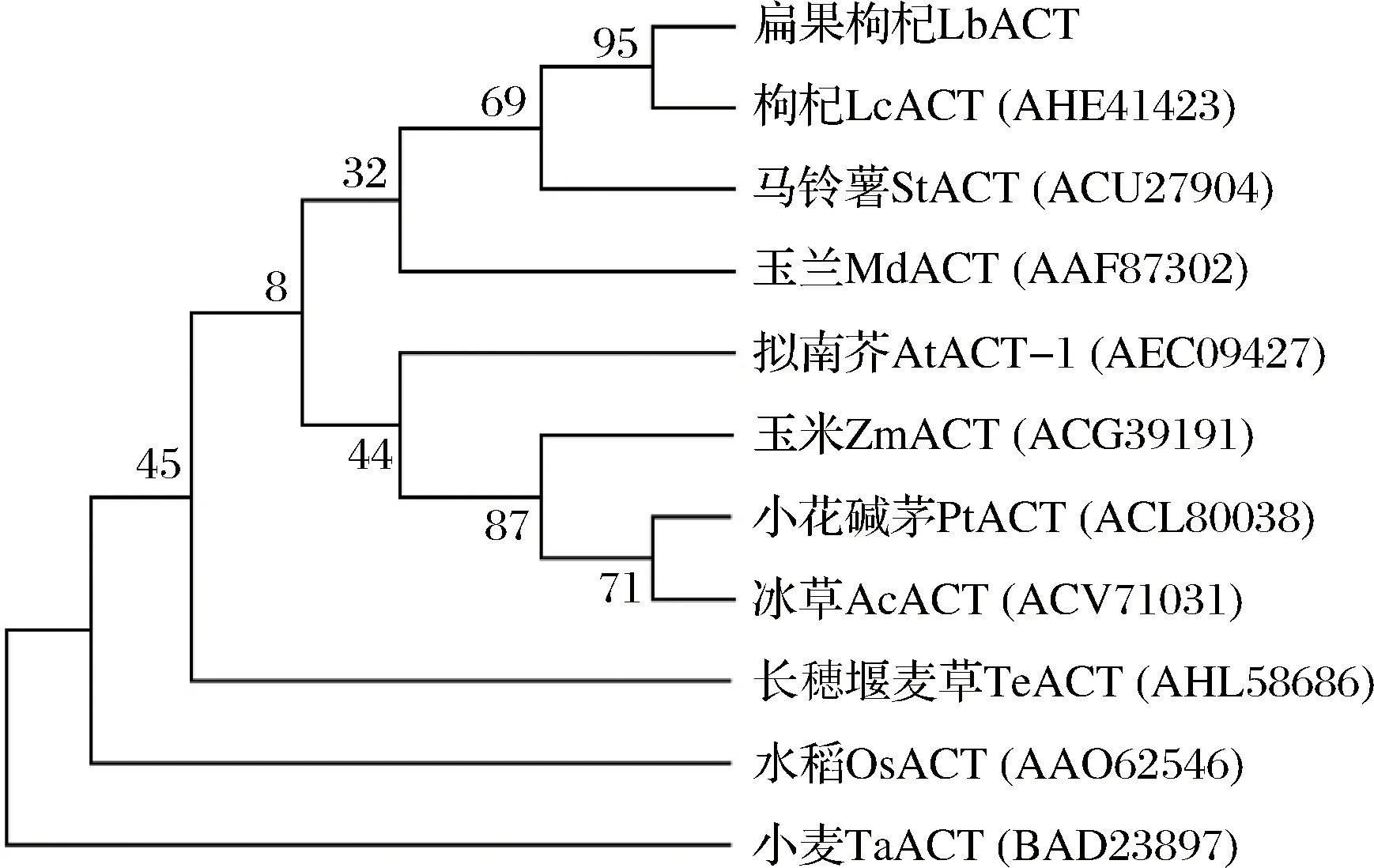
圖6 Neighbor joining法構建LbACT氨基酸序列進化樹Fig.6 Phylogenetic tree of Actin amino acid sequence of LbACT by Neighbor joining method
Neighbor joining法構建進化樹也表明,該氨基酸序列與枸杞LcACT同源性達95%,但與其他植物進化較遠(圖6)。這些結果表明克隆的基因片段為扁果枸杞肌動蛋白基因片段,命名為LbACT。根據其核苷酸序列預測的氨基酸序列是扁果枸杞肌動蛋白的高度保守區域。
通過BlastP對LbACT基因編碼的蛋白進行保守區預測表明,LbACT屬于NBD sugarkinase HSP70 actin superfamily家族(圖7)。
2.4 鹽處理下LbACT基因的表達特征分析
如圖8所示,不同濃度NaCl處理24 h后,在0、100和150 mmol/L NaCl處理時葉、莖、根的LbACT的Ct平均值差異不顯著;在50 mmol/L NaCl處理時,根的Ct值高于莖和葉,在200 mmol/L NaCl處理時,莖的Ct值低于根;頻數分布特征為,Ct平均值是19.85,變異系數為2.22,峰度系數為1.68,屬于尖峰分布,表明整體Ct值集中,波動范圍小。
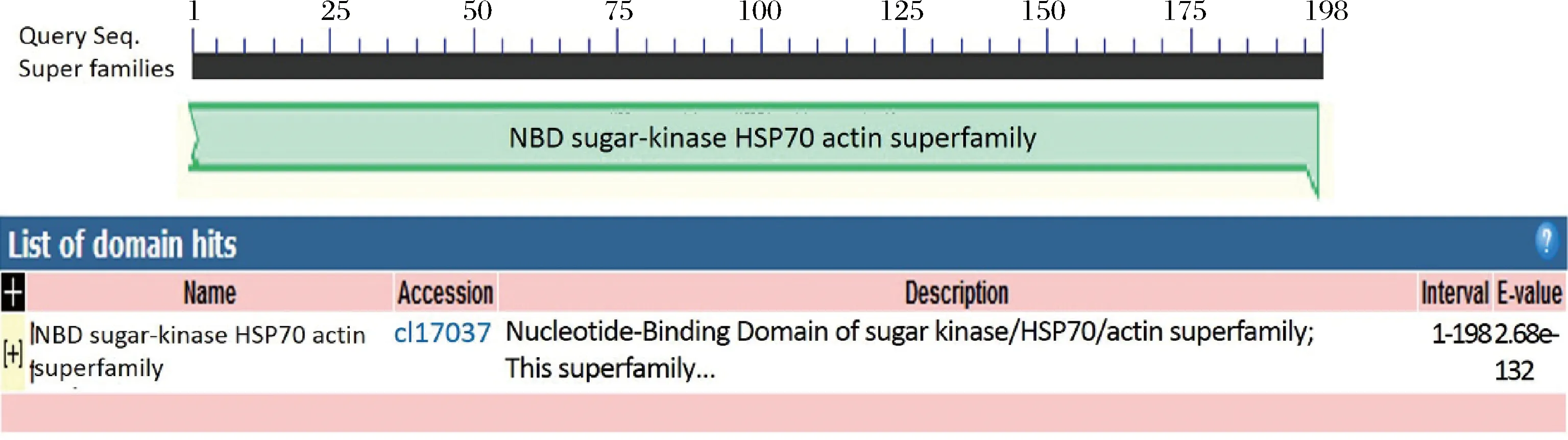
圖7 扁果枸杞LbACT保守區結構域預測Fig.7 Conserved domains of LbACT protein from L. barbarum Bianguo
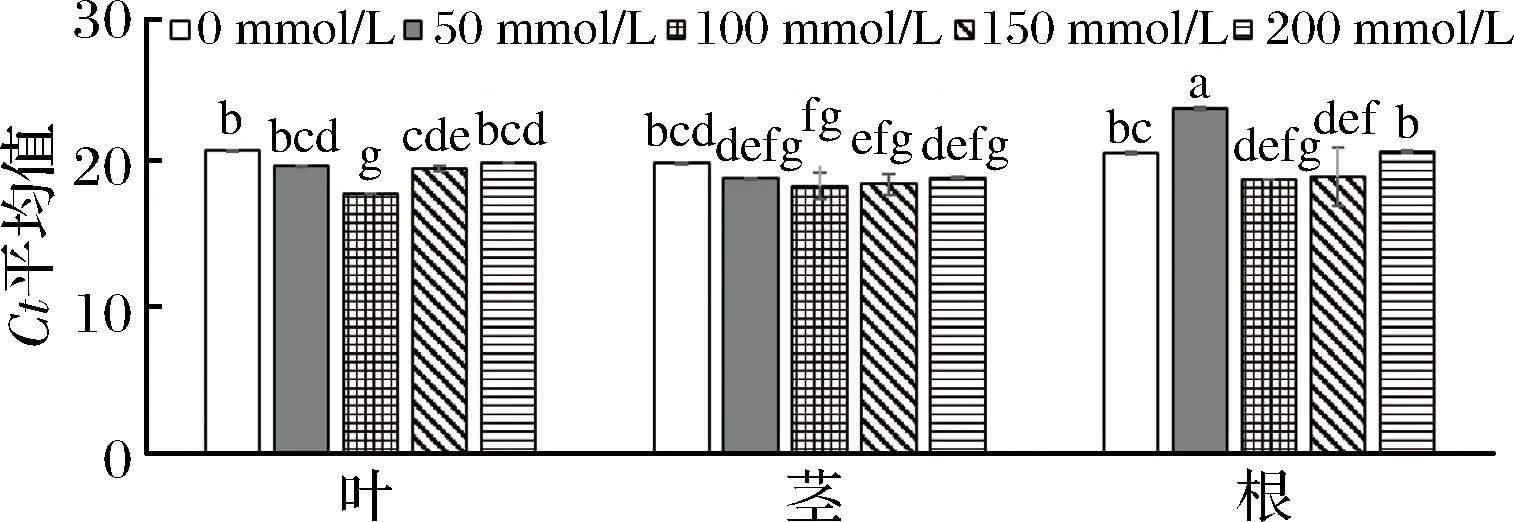
圖8 qRT-PCR分析扁果枸杞LbACT的表達特征Fig.8 Expression characters of LbACT gene by qRT-PCR analysis注:不同小寫字母表示不同器官各NaCl處理間的差異顯著性(P<0.05)。
相關性分析表明,在葉和莖中,不同濃度NaCl處理0、12、24、72 h下,Ct值與NaCl濃度無關;在根中,僅在不同濃度NaCl處理12 h時影響Ct值(表1)。上述結果均表明,鹽處理下LbACT基因在各器官中的Ct值穩定。
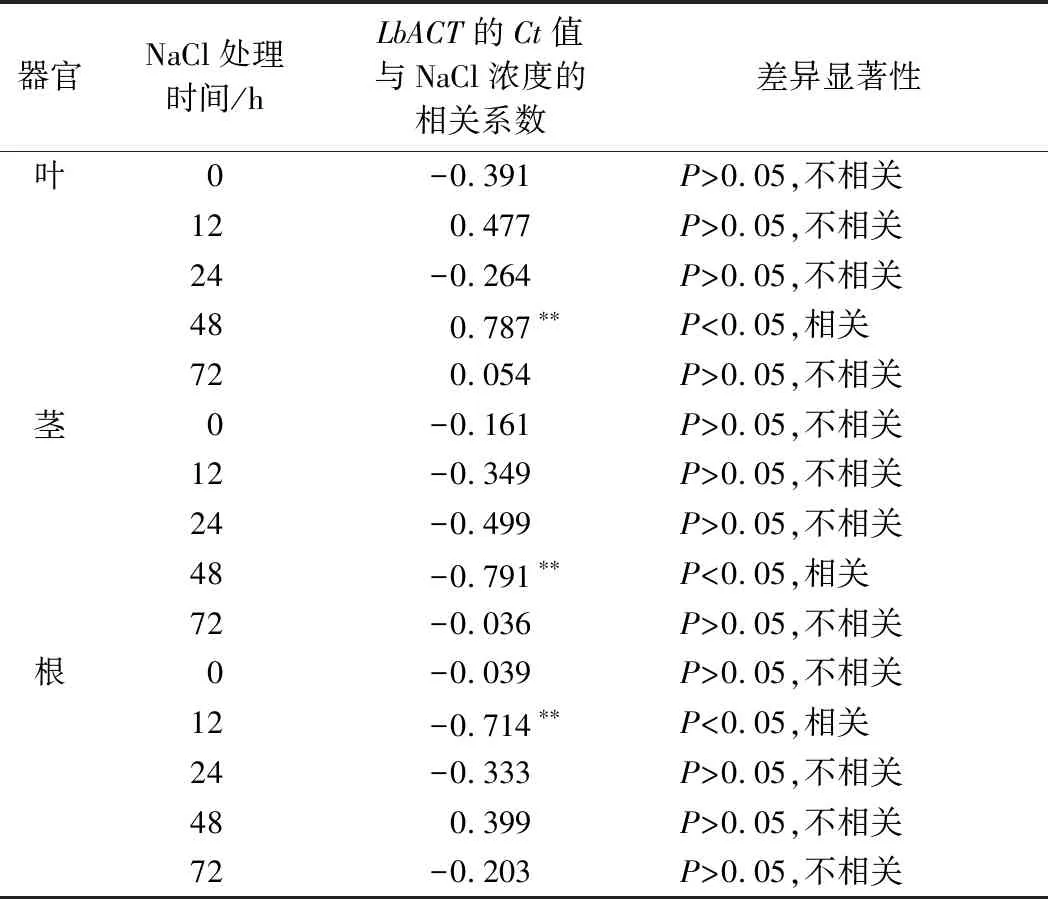
表1 扁果枸杞LbACT的Ct值與不同濃度NaCl處理的相關性分析Table 1 Correlation analysis betweenthe Ct value of LbACT and the concentration of NaCl treatments
注:“*”表示差異顯著(P<0.05),“**”表示差異極顯著(P<0.01)。
3 討論
高等真核生物肌動蛋白參與多種重要的生命活動,其基因也是由肌動蛋白多基因家族編碼,因而形成了多種肌動蛋白異型體[10],已知茄科植物中的馬鈴薯至少有5個編碼肌動蛋白的基因[11],茄有10個[12]。植物肌動蛋白異型體的表達雖然具有組織和器官特異性,但在一級結構上有很高的同源性[13-15],具備作為內參基因的良好條件。寧夏枸杞根、葉、果實均可入藥或食用[16-18],是甘肅、寧夏、內蒙古、青海等西北半干旱地區重要的經濟植物[16,19]。但是,不同地區、品種的寧夏枸杞在抗逆性、營養成分含量上存在顯著差異[4,16,20],目前對其分子機理知之甚少,克隆內參基因并驗證其表達穩定性是分析基因表達豐度和模式,進一步解析植物基因功能、探索植物復雜代謝網絡必不可少的工作。本文克隆了寧夏枸杞一個抗逆品種——扁果枸杞的肌動蛋白基因片段,該片段長598 bp,滿足半定量PCR和實時熒光定量PCR分析基因表達的引物設計需要;同時,其核苷酸序列與其他植物的相似度達87%~97%,具有極高的保守性;不同濃度鹽處理下,LbACT基因在各器官中的Ct值穩定。這些特征都表明,LbACT基因是研究扁果枸杞功能基因的表達模式分析的良好內參基因,將為進一步開展寧夏枸杞代謝網絡研究和品質改良奠定基礎。

