對大腸桿菌生物膜具有高抑制能力的乳酸菌的篩選
姚沛琳,王劍,張新劍,黃悅
(宿州學院 生物與食品工程學院,安徽 宿州,234000)
細菌生物膜是附著于物體表面被細菌胞外大分子包裹的有組織的細菌群體,與浮游狀態的細菌相比,對抗生素和宿主免疫防御系統具有較強的抗逆性[1-2]。細菌生物膜具有群體感應,以“團隊作戰能力”使整個種群更好地存活下來[3-4]。現已證明,很多久治不愈的慢性細菌性感染與生物膜有關[5],如肺囊性纖維化,彌漫性泛細支氣管炎,牙周炎,腸道感染,心瓣膜性心內膜炎等[6]。
大腸桿菌是引起泌尿系統、呼吸系統、消化道系統感染的常見病原菌,也是研究容易形成生物膜的模式病原菌[7]。抗生素法是目前臨床上治療致病菌生物膜感染最常用的方法,宋雅山等[8]的研究表明,米諾環素對大腸桿菌生物膜有抑制作用,可以緩解透析相關腹膜炎。陳盛等[9]的研究表明,巰乙磺酸鈉可顯著減少大腸桿菌的黏附及產EPS的能力。中草藥法抑菌取得了一定的研究進展[10],李斌等[11]研究表明,黑木耳提取物對大腸桿菌生物膜形成有抑制作用。喻華英等[12]研究表明,黃連、苦豆子、金銀花和連翹可以抑制大腸桿菌生物膜的形成。抗生素由于引起細菌抗藥性的問題,世界范圍內正在呼吁減少抗生素的使用[13]。中草藥法雖然比較溫和,但是由于其本身味道的限制,在實際應用上有很大的局限性[14]。因此以益生菌為主的細菌替代療法越來越受到關注,其中乳酸菌是目前最常見的一類益生菌。
乳酸菌具有多種益生功能[15-16]。在乳酸菌抑制變異鏈球菌(引起齲齒的主要病原菌)生物膜的研究中取得了一定的研究進展。KHAN等[17]發現來源于印度藏茴香種子的提取物能夠降低變異鏈球菌生物膜的活性,抑制變異鏈球菌對唾液包被羥基磷灰石的黏附和水不溶性葡聚糖的合成。KANG等[18]發現來源于兒童唾液的2株食寇魏斯氏菌CMS1和CMS3能夠顯著抑制變異鏈球菌生物膜的形成,并且它們合成的水溶性葡聚糖也能夠抑制變異鏈球菌生物膜的形成。乳酸菌對致病菌的抑制作用機理,除了產生抑菌物質對致病菌有殺傷作用外,與致病菌對營養物質或者黏附位點的爭奪也密切相關[19]。而目前在該領域的研究,多是研究乳酸菌代謝產物對游離大腸桿菌的抑制作用,很少涉及到乳酸菌的代謝產物或乳酸菌菌體對大腸桿菌生物膜的抑制作用。
乳酸菌具有中草藥無法比擬的優點,如味道上可以被絕大多數人群接受,乳酸菌的攝入可以增加體內有益菌的數量,再加上益生菌概念深入人心,為乳酸菌的應用提供了可行性。乳酸菌對大腸桿菌生物膜的研究還未見報道,所以此領域具有較大的研究價值。因此,本實驗主要通過體外生物膜的方法研究乳酸菌對大腸桿菌生物膜形成的影響。
1 材料與方法
1.1 實驗菌株
乳酸菌來源:從皖南、皖北地區采集的家庭自制腌制菜、市售酸奶、自制葡萄酒等。
大腸桿菌ATCC25922,由本實驗室保存。
1.2 設備及試劑
1-15PK離心機,湖南湘儀實驗室儀器開發有限公司;Multiskan GO酶標儀,美國Thermo公司;722型可見光分光光度計,上海儀電分析儀器有限公司;SHP-250型電熱恒溫培養箱,上海三發科學儀器有限公司;OLYMPUS IX71熒光倒置顯微鏡,廣州市明美科技有限公司。
MRS培養基、LB培養基均購于青島海博生物技術有限公司。
主要試劑:細菌基因組提取試劑盒、PCR試劑盒、溶菌酶、PI染料、CFSE染料等,均購于上海生物工程有限公司;甲醇、結晶紫、乙醇、NaH2PO4、Na2HPO4、牛膽鹽、NaCl等化學試劑,均購于國藥集團。
1.3 實驗方法
1.3.1 乳酸菌的分離與純化
從皖南、皖北地區采集的家庭自制腌制菜的汁液中分離乳酸菌菌株。無菌操作取1 mL的樣品,用無菌生理鹽水進行10倍梯度稀釋,直至稀釋到10-5。取10-3、10-4、10-5這3個梯度的稀釋液各0.1 mL分別涂布于MRS固體培養基上,37 ℃厭氧培養48 h。采用平板劃線法,挑取典型菌落,多次劃線后得到純菌株。經菌落形態觀察、革蘭氏染色鏡檢、接觸酶實驗,將革蘭氏染色陽性、接觸酶實驗陰性的菌株接種到MRS液體培養基中,過夜培養,-80 ℃甘油保藏[20]。
1.3.2 體外抑菌實驗
本實驗采用牛津杯瓊脂擴散法[21]。將活化3代的乳酸菌接種到MRS液體培養基中,37 ℃培養20 h,在4 ℃和12 000 r/min下離心30 min,用0.22 μm微孔濾膜將離心后的菌液進行過濾,得到乳酸菌無細胞發酵上清液。將活化3代的大腸桿菌接種到LB培養基,37 ℃搖床過夜培養12 h,調節OD至0.3,大腸桿菌的菌落數控制在1×108CFU/mL左右。LB固體培養基與大腸桿菌菌液混合凝固后,用鑷子將無菌的牛津杯(內徑為6 mm)輕輕地、均勻地放置在培養皿上。往每一個牛津杯里加入200 μL乳酸菌無細胞發酵上清液,將此平板正面靜置于37 ℃培養48 h,測量抑菌圈大小。
1.3.3 乳酸菌對大腸桿菌生物膜形成的影響
1.3.3.1 微孔板法
(1)乳酸菌發酵上清液對大腸桿菌生物膜形成的影響
參考O’TOOLE等[22]的方法進行。大腸桿菌過夜培養,調節菌濃度為OD=0.1,每孔加入此濃度的大腸桿菌菌懸液150 μL,再加入150 μL乳酸菌發酵上清液,37 ℃培養24 h。棄去孔內的液體,用PBS緩沖液洗滌3次,用甲醇[11]固定15 min,倒掉液體吹干。用結晶紫染色15 min,清除染液后,用去離子水洗滌3次,吹干。加200 μL 95%(體積分數)乙醇,置于搖床緩慢搖擺30 min,酶標儀600 nm。測定吸光度。各實驗組每次做5個平行,重復3次。分別用水和甲醇作陰性和陽性對照。
(2)乳酸菌菌體對大腸桿菌生物膜形成的影響
在實驗(1)的基礎上做了如下改動,每孔加入150 μL濃度為OD=0.01的大腸桿菌菌懸液和150 μL濃度為OD=0.01的乳酸菌菌懸液,37 ℃培養24 h。其他條件同實驗(1)。
1.3.3.2 熒光顯微鏡法
(1)乳酸菌發酵上清液對大腸桿菌生物膜形成的影響
大腸桿菌過夜培養,調節菌濃度為OD=0.1±0.05。 將活化3代的乳酸菌接種到MRS液體培養基中,37 ℃培養20 h,離心取發酵上清液。在直徑6 cm的玻璃培養皿中放入18 mm×18 mm規格的無菌蓋玻片,加入1 mL大腸桿菌菌懸液和3 mL乳酸菌發酵上清液,37 ℃培養24 h,取出玻璃片,PBS沖洗3次,去除表面浮游細菌,立即于室溫避光條件下用熒光染料CFSE和PI分別對活菌和死菌進行染色。30 min后,取出蓋玻片,沖洗染液,在熒光顯微鏡下觀察成膜情況[23]。
(2)乳酸菌菌體對大腸桿菌生物膜形成的影響
在實驗(1)的基礎上做如下改動,培養皿中加入1 mL菌濃度為OD=0.01大腸桿菌菌懸液和3 mL菌濃度為OD=0.01乳酸菌菌懸液。37 ℃培養24 h。其他條件同實驗(1)。
1.3.4 菌株的耐酸性測定
將純化活化后的菌株按體積分數1%接種到MRS液體培養基中,37 ℃下靜置培養24 h后,按1% 接種量分別接入pH為2.0、3.0、4.0、5.0、6.0和7.0的MRS液體培養基中,37 ℃厭氧,測定600 nm下的吸光值(OD600),并記錄結果[24]。
1.3.5 菌株的耐膽鹽性測定
菌株接種于MRS液體培養基中,37 ℃條件下靜置培養18 h,再按2%的接種量分別接種于含0、0.1%、 0.2%、0.3%、0.5%(質量分數)牛膽鹽的MRS-THIO培養基(MRS培養基中添加質量分數為0.2%巰基乙酸鈉),37 ℃靜置培養24 h,以未接種的MRS-THIO培養基為對照,分別測定上述不同質量濃度培養基在600 nm下的吸光度,按照公式(1)計算乳酸菌對膽鹽的耐受力[25]。

(1)
1.3.6 統計學分析
本研究采用SPSS Statistics 17.0單因素方差對實驗結果進行顯著性分析(One-Way,ANOVA)。顯著性水平設置為0.05,其中P<0.05代表差異顯著。采用Excel 2013對數據進行作圖和分析。
2 結果與討論
2.1 乳酸菌對大腸桿菌的抑菌性分析
從不同來源的傳統發酵食品中分離出了90株乳酸菌,采用牛津杯瓊脂擴散法測定這90株乳酸菌的發酵上清液對大腸桿菌的生長抑制作用。結果顯示,大多數乳酸菌對大腸桿菌都有不同程度的抑制作用。牛津杯法測定的抑菌效果是在大腸桿菌非生物膜狀態下進行的研究,而相關的研究成果表明[23],乳酸菌的抑菌性與抑制生物膜能力不是呈正相關。因此,為了篩選出對大腸桿菌生物膜具有較強抑制能力的乳酸菌,根據前期研究中的抑菌實驗結果,分別從好、中、差3個水平中隨機選取10株乳酸菌(即2-1、3-1、15-2、7-1、A-1、7-2、10-1、1-1、11-3、13-1)研究其發酵上清液和菌體對大腸桿菌生物膜形成的抑制情況,這10株乳酸菌的牛津杯法抑菌實驗結果如圖1所示。

圖1 10株乳酸菌的抑制大腸桿菌的效果Fig.1 The inhibited effect of 10 species of LAB on E.coli
2.2 乳酸菌發酵上清液對大腸桿菌生物膜形成量的影響
乳酸菌發酵上清液對生物膜形成量的影響結果見圖2。由圖2可知,各實驗組與對照組(陰性組為無菌水,陽性組為甲醇)均有顯著性差異(P<0.05),其中7-1和11-3表現出了非常好的抑制效果,對生物膜的抑制率分別達到84.59%和85.19%,抑制效果其次的是2-1、3-1、7-2、10-1、13-1。同時由圖1和圖2的比較可知,乳酸菌的抑菌性與其對大腸桿菌生物膜形成的抑制效果之間并不存在規律性。

圖2 乳酸菌發酵上清液對大腸桿菌生物膜形成量的影響Fig.2 The effect of the culture supernatant of LAB on E.coli biofilm formed quantity
2.3 乳酸菌菌體對大腸桿菌生物膜形成量的影響
乳酸菌菌體對生物膜形成量的影響結果見圖3。由圖3可知,在3-1、7-1和15-2的作用下,不僅不會抑制大腸桿菌生物膜的形成,反而會促進其生物膜的形成。2-1、7-2、11-3與陰性對照組無顯著性差異(P<0.05), 因此無抑制效果。1-1與甲醇的作用效果相當。A-1、10-1、13-1表現出較好的抑制效果,抑制率分別達到65.20%、70.09%和64.59%。

圖3 乳酸菌菌體對大腸桿菌生物膜形成量的影響Fig.3 The effect of LAB on E.coli biofilm formed quantity
綜合圖2和圖3的結果可知,乳酸菌發酵上清液和乳酸菌菌體對大腸桿菌生物膜形成的抑制效果差別較大,兩者無相關性。乳酸菌發酵上清液對大腸桿菌生物膜的形成均表現出較好的抑制效果,但是乳酸菌菌體的作用效果較為復雜,有的表現出較好的抑制效果,而有的卻表現出促進效果。綜合來看,10-1、 13-1這2株乳酸菌的發酵上清液和菌體均表現出較好的抑制大腸桿菌生物膜形成的效果。
2.4 熒光顯微鏡實驗
通過聚苯乙烯材質的96平底孔板作為體外生物膜模型對生物膜進行定量是一種傳統方法[26]。因此,為了驗證實驗結果,本實驗對乳酸菌發酵上清液實驗中抑制效果較好的2株乳酸菌,即7-1和11-3,以及乳酸菌菌體實驗中抑制效果較好的3株乳酸菌,即10-1、13-1和A-1,采用熒光顯微鏡法,觀察所形成的生物膜的構造,結果分別如圖4和圖5所示。
由圖4可知,在相同的熒光強度下,未用任何試劑處理的常態生物膜(圖4-A和圖4-B),活菌占主導地位,菌體成團塊蘑菇狀緊密地連接在一起,有孔狀通道,呈現出典型的生物膜結構。而添加了7-1和11-3的發酵上清液的處理組,即圖4-C和圖4-D以及圖4-E和圖4-F,生物膜結構完全遭到破壞,菌體基本上以散點形式分布,細菌總量明顯下降,并且死菌占主導地位,這一結果與用96平板測得的生物膜量的結果相同。
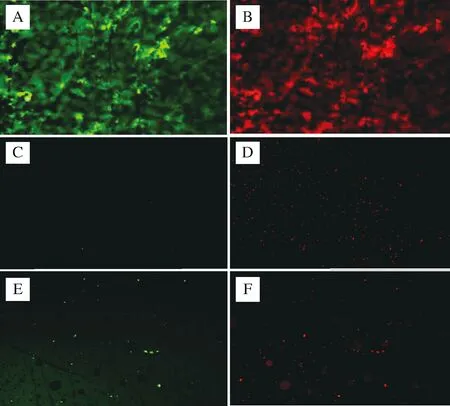
A、B-未添加任何試劑;C、D-添加菌株7-1的發酵上清液;E、F-添加菌株11-3的發酵上清液圖4 乳酸菌發酵上清液對大腸桿菌生物膜結構的影響(×200)Fig.4 Effect of the culture supernatant of LAB on E.coli biofilm structure(×200)注:圖A、C、E代表活菌,圖B、D、F代表死菌。
由圖5可知,在相同的熒光強度下,未用任何試劑處理的常態生物膜(圖5-A和圖5-B),活菌占主導地位,菌體成團塊蘑菇狀緊密地連接在一起,有孔狀通道,具有完整的生物膜結構。而添加了10-1、13-1、A-1菌體的處理組,即圖5-C和圖5-D、圖5-E和圖5-F 以及圖5-G和圖5-H,生物膜結構完全遭到破壞,菌體基本上以散點形式分布,管道結構和團塊狀結構不復存在,細菌總量明顯下降,但是活菌和死菌總量基本相當。與用乳酸菌發酵上清液的處理結果相比較,雖然生物膜結構與前者一樣,均完全被破壞,但是細菌總量沒有前者減少幅度大,這一結果也與用96平板測得的生物膜量的結果相同。

A、B-未添加任何試劑;C、D-添加10-1菌體;E、F-添加13-1菌體;G、H-添加A-1菌體圖5 乳酸菌菌體對大腸桿菌生物膜結構的影響(×200)Fig.5 Effect of LAB on E.coli biofilm structure(×200)注:圖A、C、E、G代表活菌,圖B、D、F、H代表為死菌。
2.5 耐酸性試驗結果
由表1可知,當pH>4.0時,各菌株均生長良好。隨著pH的降低,各菌株的生長均受到顯著抑制。在pH=2.0時,菌株A-1的耐強酸性能最好,OD600可達0.289,與其他菌株有顯著性差異(P<0.05),最差的是菌株7-1,其他3個菌株的耐酸性能均在同一水平。在pH=3.0時,菌株A-1的耐酸性能最好,OD600可達0.518,與其他菌株有顯著性差異(P<0.05),最差的是菌株10-1,其他3個菌株的耐酸性能均在同一水平。綜合以上結果,這5株乳酸菌,耐酸性能最好的是菌株A-1,其次是菌株11-3和13-1。
2.6 耐膽鹽試驗結果
由表2可知,隨著膽鹽質量分數的增加,菌株的存活率顯著降低。當膽鹽質量分數為0.3%和0.5%時,菌株A-1均表現出較強的存活率,存活率分別為60.60%和37.51%,與其他菌株有顯著性差異(P<0.05),最差的是菌株7-1,其他3個菌株的耐酸性能均在同一水平。綜合以上結果,這5株乳酸菌,耐膽鹽性能最好的是菌株A-1,其次是菌株10-1、11-3和13-1。

表1 耐酸性實驗結果Table 1 Acid proof test result
注:表中不同小寫字母代表差異顯著,P<0.05。下同。

表2 耐膽鹽實驗結果Table 2 The results of the test for biliary salt
3 結論
大腸桿菌在人體腸道內屬于正常的共生菌,但是如果以生物膜形式大量存在于泌尿系統、消化道、呼吸系統等處,就會造成感染。人體內強調的是一個菌群平衡的概念,雖然大腸桿菌是正常菌群,但是如果在某處以生物膜這種抗逆性強的形式存在,就會對人體有傷害。因此,本文從安徽不同區域采集的傳統發酵食品中共分離得到90株乳酸菌,研究其對大腸桿菌的抑制作用。結果表明,大多數乳酸菌對大腸桿菌有抑制作用,但是結果差異較大。而乳酸菌的抑制作用與抑制大腸桿菌生物膜形成能力之間并不存在一定的規律性。從乳酸菌的無細胞發酵上清液和菌體兩方面研究其對大腸桿菌生物膜形成的抑制作用,分別篩選出效果較好的不同乳酸菌。兩者均可以顯著減少生物膜的形成量,完全破壞生物膜的典型結構,使菌體在生物膜中呈零散狀分布。但是乳酸菌的無細胞發酵上清液的作用效果要優于乳酸菌菌體,不僅可以顯著減少細菌總量,還可以使生物膜活性顯著降低。因此,根據實驗結果,菌株7-1的無細胞發酵上清液具有潛在的應用價值。人體胃液的pH值為2~3, 人體小腸的膽鹽濃度一般為0.03%~0.3%,可以在細胞外產生高滲透壓,對菌體細胞造成影響。攝入到體內的乳酸菌,需要經受人體極端的酸性條件和高膽鹽環境的考驗,才能在人體真正發揮益生作用。在體外有較好益生作用的乳酸菌,必須能夠對胃液極端的酸性環境具有耐受性,才能在體內發揮益生作用。根據實驗結果,菌株A-1(Lactobacillusacidophilus)具有較好的耐酸耐膽鹽性能。在研究乳酸菌菌體對大腸桿菌生物膜形成的影響時,所用到的菌株濃度為OD600=0.01,菌株A-1對大腸桿菌生物膜就表現出較強的抑制作用。經過強酸、強膽鹽的處理后,菌株A-1的濃度遠遠高于體外抑制實驗的濃度,故在體內具有應用價值。乳酸菌作為目前使用較多的益生菌,具有巨大的研究價值和廣闊的市場前景,是細菌替代療法的熱門研究對象,該結果為今后預防由大腸桿菌引起的感染提供了理論依據。

