溶菌酶分子印跡聚合物膜的制備及其吸附性能
李園園, 張 鑫, 陳煒杰, 劉紅陽, 孫立權, 羅愛芹
(北京理工大學, 北京 100081)
分子印跡技術(molecularly imprinting technique, MIT)起源于“抗原-抗體”學說,其識別機理與“鎖鑰原理”相似[1]。分子印跡聚合物(molecularly imprinted polymers, MIPs)的制備過程是,模板分子與功能單體先通過共價鍵、氫鍵、分子間作用力等作用力形成“模板-功能單體復合物”,再在交聯劑的作用下聚合成空間三維結構,最后將模板分子去除,在聚合物內形成與模板分子形狀、大小、官能團互補的印跡空穴[2-4]。制備得到的分子印跡聚合物具有較好的穩定性、便捷性,并且具有特異的識別能力[5]。因此,分子印跡技術已經廣泛應用到分離、催化、生物醫藥等領域[6-8]。
膜分離技術是指借助膜的選擇滲透作用,在能量或化學位差的推動下對混合物中溶質和溶劑進行分離、分級、提純和富集[9]。分子印跡膜技術是將分子印跡技術和膜分離技術相結合,因此,分子印跡聚合物膜(molecularly imprinted polymers membranes, MIMs)兼具了二者易于分離、能耗低的優勢,其制備方法與傳統的印跡方法相比,可避免研磨、篩分等繁瑣程序[10-14]。現已有大量文獻報道了分子印跡膜在生物分離、分析方面的良好應用。例如,丘秀珍等[15]以多巴胺為模板,多孔陽極氧化鋁膜為反應載體,合成了分子印跡聚合物膜,其吸附平衡時間為60 min,最大吸附容量為82.1 μmol/g,對模板分子的印跡因子為2.1,該方法簡便、快速、選擇性高,適用于檢測人體尿液中的兒茶酚胺類藥物的含量。呂春暉等[16]以恩諾沙星分子為模板制備了印跡聚合物膜,其高親和位點的最大吸附量為12.98 μg/mL,吸附平衡時間為60 min,可分析檢測恩諾沙星在食品中的殘留。Jahanshahi等[17]以2,4-二氯苯氧乙酸為模板分子制備了分子印跡聚合物膜,對模板分子選擇性因子為12.96,吸附平衡時間為60 min,吸附量為34.57 mg/g,可用于選擇性識別和分離水溶液中的2,4-二氯苯氧乙酸。Kong等[18]以雙酚A為模板分子制備了印跡聚合物膜,其吸附平衡時間為30 min,對模板分子具有特異識別能力,可用于雙酚A的痕量檢測。
目前分子印跡聚合物膜存在結合位點少、吸附平衡時間長、吸附量小等問題。本文結合分子印跡技術和膜分離技術,以溶菌酶為模板蛋白質,利用原位聚合法在硅烷化的基質玻片上成功制備了溶菌酶分子印跡聚合物膜,解決了印跡聚合物膜結合位點少的問題,制備的印跡聚合物膜對溶菌酶具有較快的吸附速率、較高的吸附效率、良好的識別能力。
1 實驗部分
1.1 儀器、試劑與材料
紫外分光光度計(UV-1800,日本島津公司,日本);臺式恒溫振蕩器(TIIZ-D,太倉市實驗設備廠);電熱恒溫鼓風干燥箱(DH101-1BS,天津市中環實驗電爐有限公司);超聲波清洗器(KQ5200,昆山市超聲儀器有限公司)。
溶菌酶(Lyz,Mr1.44 kDa, pI 11.2,生物技術級)、卵清蛋白(OVA,Mr4.5 kDa, pI 4.7,純度98%)、人血清白蛋白(HSA,Mr6.6 kDa, pI 4.6,純度99.5%)均購自原葉生物有限公司;丙烯酰胺(AAm,分析純)購自天津化學試劑研究所;N,N′-亞甲基雙丙烯酰胺(MBA,分析純)、過硫酸銨(APS,分析純)均購自北京化學試劑公司;γ-甲基丙烯酰氧基丙基三甲氧基硅烷偶聯劑(KH570,化學純)購自曲阜晨光化工有限公司;四甲基乙二胺(TEMED,純度>99%)購自北京夢怡美生物科技有限公司;十二烷基磺酸鈉(SDS,化學純)購自西隴化工股份有限公司;乙酸(AA,分析純)購自北京市通廣精細化工公司;十二水磷酸氫二鈉(分析純)、二水磷酸二氫鈉(分析純)、甲苯(分析純)、三乙胺(分析純)均購自北京化工廠;聚對苯二甲酸乙二酯板片(PET薄膜)購自廣州鈺新材料有限公司;雞蛋購自北京理工大學菜市場。
1.2 溶菌酶印跡聚合物膜的制備
1.2.1基質材料的準備
基質材料處理過程如下:將載玻片制成1.0 cm×1.5 cm大小,用去離子水和無水乙醇反復清洗,氮氣吹干;用濃硫酸-過氧化氫水溶液(85∶15, v/v)的混合溶液浸泡3 h后,用去離子水和無水乙醇反復清洗,氮氣吹干;最后,將上述基質玻片浸入4 mL KH570、0.4 mL三乙胺和100 mL甲苯的混合溶液中反應12 h,獲得的玻片用甲苯反復沖洗后氮氣吹干,室溫下密封保存備用。
1.2.2溶菌酶分子印跡聚合物膜的制備
溶菌酶分子印跡聚合物膜的制備過程如下:首先,精準稱取10 mg Lyz、550 mg AAm于4 mL磷酸緩沖溶液(pH=6.0, 40 mmoL,下同)中,超聲溶解后加入10 mg交聯劑MBA,反應30 min,再加入4 mg APS、10 μL TEMED,完全溶解后得到預聚合溶液;其次,將60 μL的預聚合溶液小心滴加于硅烷化的基質玻片上,待到溶液均勻鋪平后,用PET膜覆蓋,在室溫下聚合24 h后,去除PET膜片,獲得溶菌酶印跡聚合物膜(MIP);最后,將MIP浸入體積分數為10%的AA與質量分數為1%的SDS混合水溶液中,振蕩洗脫去除模板蛋白質,用去離子水振蕩洗滌多次,直至洗滌水pH呈中性。為了進一步研究印跡過程對Lyz吸附的影響,實驗還制備了非印跡聚合物膜(non-imprinted polymer, NIP)作為對照,NIP的制備除不加入模板蛋白質Lyz之外,其余步驟同上。
1.3 吸附動力學實驗
在室溫條件下,分別將MIP、NIP放入Lyz標準溶液中進行孵育,每隔一段時間測定溶液的紫外吸光度,記錄并計算MIP、NIP在不同時間對Lyz的吸附量。
用磷酸緩沖溶液配制質量濃度為200 μg/mL的Lyz標準溶液,然后分別將MIP、NIP置于其中孵育,每隔一段時間測定溶液的紫外吸光度,記錄并計算MIP、NIP在不同時間對Lyz的吸附量。
1.4 吸附等溫線實驗
用磷酸緩沖溶液分別配制質量濃度范圍在0到700 μg/mL的Lyz標準溶液(0、50、100、200、300、400、500、600、700 μg/mL),然后分別將MIP、NIP置于溶液中孵育,使用紫外分光光度計記錄不同溶液的紫外吸光值,計算在不同溶液中MIP對Lyz的最大吸附量。Lyz吸附量使用公式(1)計算:
Q=(A0-A)·V/(k·M)
(1)
式中,Q是聚合物對模板蛋白質的吸附容量(mg/g),A0是標準溶液初始吸光度,A是標準溶液用聚合物吸附后的吸光度,V是吸附溶液的體積(mL),k是模板蛋白質標準曲線的斜率(mL/μg),M是聚合物的質量(g)。
1.5 吸附選擇性實驗
用磷酸緩沖溶液分別配制一系列不同質量濃度的Lyz、HSA、OVA標準溶液。分別將MIP、NIP置入不同濃度的蛋白質標準溶液中孵育。利用紫外分光光度計測定溶液的紫外吸光度,計算MIP、NIP對Lyz、HSA、OVA的最大吸附量。采用印跡因子(IF)評價聚合物膜的識別特異性:
(2)
式中,QMIP和QNIP分別為MIP、NIP對蛋白質的吸附容量(mg/g)。
1.6 溶菌酶分子印跡聚合物膜的重復使用性測定
將MIP放入質量濃度為200 μg/mL的Lyz標準溶液中吸附5 min,使用紫外分光光度計檢測Lyz吸光值。然后用1.2.2節中的洗脫方法將Lyz洗脫后再次進行吸附,重復此步驟5次。
1.7 聚合物膜用于實際樣品
選用雞蛋清作為蛋白質源來考察聚合物膜在實際樣品中對目標蛋白質的吸附能力。首先取雞蛋清上清液,稀釋200倍,對其進行全波段掃描后,將MIP、NIP置于樣品溶液中進行吸附實驗。吸附平衡后,對樣品溶液再次進行全波段掃描,觀察樣品溶液中Lyz特征吸收峰的變化,根據公式(1)計算吸附量。
2 結果與討論
2.1 分子印跡聚合物膜的制備
MIP的制備過程如圖1所示。具體如下:用濃硫酸和過氧化氫水溶液處理載玻片,既可除去雜質,又可使其表面羥基化;經KH570、三乙胺和甲苯的混合溶液反應后,羥基化的玻片表面進一步接枝雙鍵,有利于聚合物膜固定以及模板蛋白的結合。在此基礎上,以Lyz為模板蛋白質,AAm為功能單體,MBA為交聯劑制備MIP。

圖 1 溶菌酶印跡聚合物膜的制備過程Fig. 1 Preparation of lysozyme-imprinted polymer membrane KH570: silane coupler; Lyz: lysozyme; AAm: acrylamide; MBA: N,N′-methylene bisacrylamide.
2.2 印跡體系的優化
2.2.1功能單體
功能單體的用量是影響印跡聚合物吸附性能的重要因素。本實驗考察了AAm的用量對MIP吸附性能的影響,所得結果如圖2所示:隨著AAm用量的增加,制備的MIP對Lyz的吸附量增大,當AAm的用量為550 mg時,其吸附量最大,以后隨著AAm的增加其吸附量反而有所降低,這表明功能單體AAm的最優用量為550 mg。
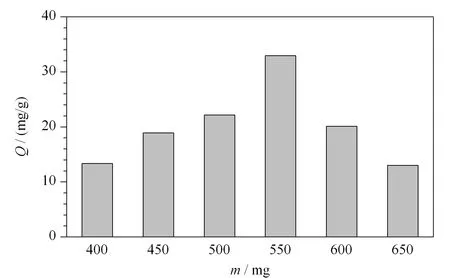
圖 2 功能單體用量對溶菌酶印跡聚合物吸附量的影響Fig. 2 Effect of the amount of functional monomer on the adsorption capacity of lysozyme-imprinted polymer membrane

圖 3 交聯劑用量對溶菌酶印跡聚合物吸附量的影響Fig. 3 Effect of the amount of crosslinking agent on the adsorption capacity of lysozyme-imprinted polymer membrane
2.2.2交聯劑
交聯劑的基本作用是固定客體的鍵合點,使之處于牢固的三維結構中。在本實驗中,固定AAm的用量為550 mg,考察了不同用量的交聯劑對MIP吸附性能的影響。由圖3可知,隨著交聯劑用量的增加,MIP對模板分子的吸附量呈現先增大后減小的趨勢,當交聯劑的用量為10 mg時,其吸附量達到最大值。這是因為當交聯劑用量過少時,所形成的MIP過低,從而導致吸附量降低;但當交聯劑用量過多時,形成的MIP過大,導致Lyz分子識別位點減少,MIP吸附效果較差。
2.3 吸附動力學曲線的測定
實驗對制備的聚合物膜的吸附平衡時間進行了考察。如圖4所示,在Lyz質量濃度為200 μg/mL時,MIP的吸附量隨著時間增加,在起初的5 min內,吸附量快速增加,5 min之后,吸附達到平衡,吸附量為23 mg/g; NIP對模板蛋白質的吸附平衡時間較長,在11 min時達到吸附平衡,吸附量為8 mg/g,與MIP相差較大。相對NIP, MIP達到吸附平衡所用的時間更短,吸附速率更快。這主要是因為在MIP上具有能特異結合Lyz的印跡位點,所以結合速率更快,吸附量更大。
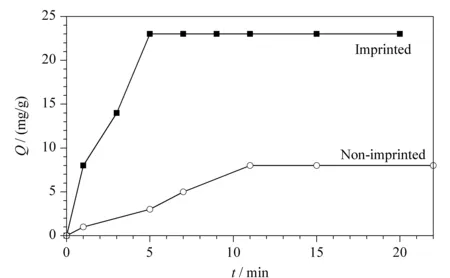
圖 4 溶菌酶質量濃度為200 μg/mL時聚合物膜的吸附動力學Fig. 4 Absorption kinetic curve of polymer membrane at lysozyme concentration of 200 μg/mL
2.4 吸附等溫線的測定
實驗進一步考察MIP對Lyz的吸附能力。Lyz的質量濃度在0到700 μg/mL的范圍內,測定了MIP、NIP的吸附等溫線。一般來說,對吸附能力進行評價時,最常用的模型是Langmuir吸附方程和Freundlich吸附方程[19,20],將實驗數據分別對兩種方程進行擬合。結果表明,MIP更符合Langmuir吸附方程,公式如下:
(3)
式中,Q和Qmax分別是聚合物對模板蛋白質的實驗吸附容量(mg/g)和最大理論吸附容量(mg/g),Ce為吸附平衡后溶液中蛋白質的質量濃度(mg/mL),K為聚合物對模板蛋白質吸附的Langmuir吸附平衡常數(mL/mg)。
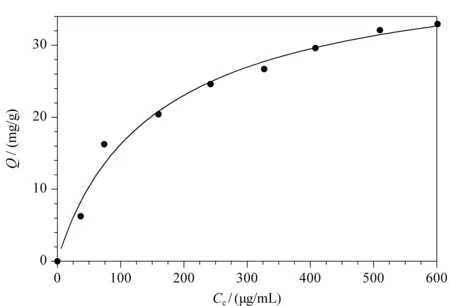
圖 5 溶菌酶印跡聚合物膜的吸附等溫線Fig. 5 Adsorption isotherms of lysozyme-imprinted polymer membrane
以Q對Ce作圖得到MIP的吸附等溫線,如圖5所示。采用Langmuir吸附模型進行數據擬合,得到的擬合曲線具有較好的擬合度(R2=0.9665)。由擬合結果可知,MIP對Lyz的理論最大吸附量是42.5 mg/g。
2.5 吸附選擇性的考察
為了評價MIP對Lyz的特異性識別能力,選用HSA、OVA作為參照蛋白質,分別考察了MIP、NIP對3種蛋白質的吸附情況。由圖6可知,MIP對Lyz最大吸附量是32.9 mg/g,遠高于其對HSA(10 mg/g)、OVA(9 mg/g)的吸附量。NIP對Lyz、HSA、OVA的吸附量均不高。MIP對模板分子的印跡因子為3.0,明顯高于對HSA、OVA的印跡因子,這是由于HSA、OVA與Lyz的結構、等電點不同,與MIP的印跡位點不匹配,所以MIP對這兩種參照蛋白的結合量少,而對Lyz表現出了高選擇性。而NIP不存在特異性空穴,所以對3種蛋白質的吸附量相差不大。
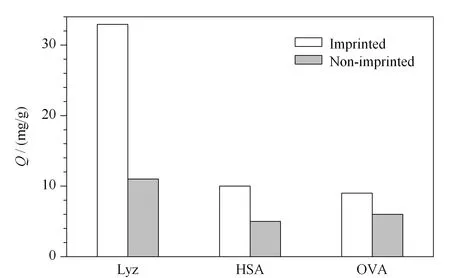
圖 6 溶菌酶印跡聚合物膜的選擇性吸附Fig. 6 Selective adsorption of lysozyme-imprinted polymer membraneHSA: human serum albumin; OVA: ovalbumin.

圖 7 溶菌酶印跡聚合物膜的重復使用性Fig. 7 Reusability of the lysozyme-imprinted polymer membrane
2.6 重復性實驗
為了考察MIP的重復使用能力,對其進行批次吸附實驗,結果如圖7所示。隨著使用次數的增多,MIP對Lyz的吸附量略有降低,使用5次之后,吸附量由32.9 mg/g降到31.2 mg/g,下降了5%。這說明MIP表面具有均勻、穩定的剛性結構,其在反復振蕩、洗脫過程中,吸附位點損失較少。總體看來,MIP具有良好的重復使用性。
2.7 聚合物膜用于分離實際樣品中的模板蛋白質
實驗選用雞蛋清為樣品,對制備的聚合物膜的實際應用能力進行了考察。由圖8可觀察到,用MIP、NIP對實際樣品進行吸附實驗后,Lyz的特征吸收峰峰值由0.618分別降低到0.595和0.609,根據公式(1)分別計算出MIP、NIP對Lyz的吸附量為30和12 mg/g。結果表明,相對NIP, MIP在實際樣品中有良好的吸附效果,可用于實際樣品中目標蛋白質的分離。
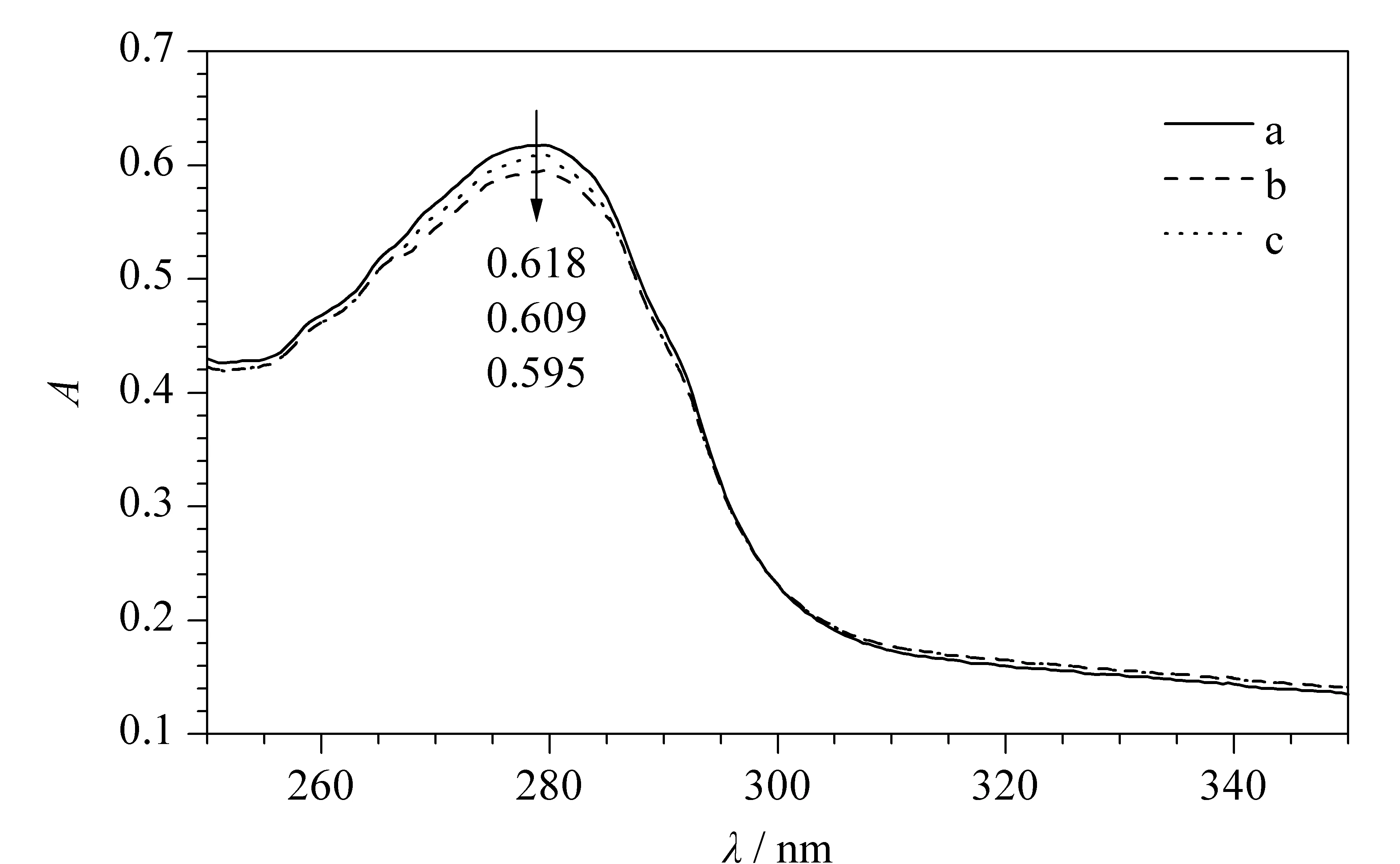
圖 8 聚合物膜吸附雞蛋清樣品中溶菌酶的光譜圖Fig. 8 Spectrum of lysozyme adsorption by polymer membrane from egg white a. the egg white before adsorption; b. the egg white after adsorption by non-imprinted polymer; c. the egg white after adsorption by imprinted polymer.
3 結論
本文以溶菌酶為模板蛋白質,丙烯酰胺為功能單體,N,N′-亞甲基雙丙烯酰胺為交聯劑,制備了溶菌酶分子印跡聚合物膜。結果表明,制備的印跡聚合物膜的吸附特征符合Langmuir吸附方程,實際最大吸附量為32.9 mg/g,吸附平衡時間為5 min,印跡因子為3.0。本實驗采用的原位聚合法增強了聚合物的柔韌性及力學性能。因此,本實驗制備的蛋白質分子印跡膜還可以進一步推廣應用于生物樣品中其他蛋白質的高效分離。

