擬南芥隱花色素CRY2調控因子PRP8基因的功能分析
郭亞蓉, 王艷艷, 劉 軍*, 裴雁曦*
1.山西大學生命科學學院, 太原 030006;2.中國農業科學院作物科學研究所, 北京 100081
在自然界中,植物體能感受四季變化和晝夜交替,并通過調控自身基因表達的變化來適應周圍環境中光照、溫度等的改變。光受體是植物體感受外界光信號的主要物質。在模式植物擬南芥中,CRY1和CRY2作為主要的藍光受體,在調控植物依賴藍光的光形態建成和長日照下促進開花的過程起作用[1~4]。cry2突變體在高強度藍光(50 μmol/m2·s)下胚軸表型不明顯,而在低強度藍光(0.6 μmol/m2·s)下表現出明顯的下胚軸伸長表型[5]。CRY2通過與下游信號分子CIBs(cryptochrome interacting basic helix-loop-helixes)或COP1/SPA1(constitutive photomorphogenic 1/suppressor of phyA-105) 互作來實現藍光特異的對下游基因的調控作用[6~10]。作為開花的正調控因子,CRY2通過與CIB1互作直接激活下游FT基因的表達,從而促進開花[7,11,12]。CRY2還可以通過與COP1/SPA1直接互作,抑制COP1/SPA1對CO的降解,從而促進開花[13,14]。藍光照射后,CRY2蛋白會發生磷酸化,轉化成活性形式,并發生依賴藍光的降解現象[5,15~17]。但目前,直接或間接通過影響CRYs磷酸化或降解作用來調控CRYs功能的作用因子在擬南芥中知之甚少。Blue-light inhibitors of cryptochromes 1 and 2(BIC1 and BIC2)是擬南芥中已發現的兩個CRY2的抑制因子,它們可以通過抑制CRY2二聚化、磷酸化及CRY2的降解過程抑制CRY2的功能[18]。
在人和酵母基因組中,PRP8編碼一個前體mRNA剪接因子,是mRNA剪接小體中分子量最大、序列最保守的核心蛋白[19]。在擬南芥中,有兩個PRP8同源基因,At1g80070(SUS2/PRP8)和At4g38780,PRP8的表達量高于At4g38780百倍以上,因此,有報道指出At4g38780在基因組剪接方面可能沒有關鍵作用。PRP8功能完全缺失的突變體會導致胚胎致死[20]。PRP8基因突變后擬南芥基因組的整體剪接效率降低,出現部分內含子保留現象[21]。PRP8在開花植物合子發育前期,對胚柄的正常發育起關鍵作用,其功能缺失會導致嚴重的胚胎發育異常及子葉發育不全現象[22]。PRP8還參與到了自主成花途徑中,PRP8突變體降低了FLOWERINGLOCUSC(FLC)反義轉錄物COOLAIR的剪接效率和對多聚腺苷酸位點的利用效率從而增加FLC基因編碼區H3K4me2的甲基化,導致FLC自身表達量升高,從而抑制植物體開花[20]。
為了獲得更多能夠影響擬南芥CRY2降解的作用因子,本研究對35S:LUC-CRY2的穩定轉基因株系進行EMS誘變和篩選,發現了新的PRP8等位基因突變體,該突變導致CRY2蛋白過量積累,并造成了下胚軸伸長和開花變早的表型。
1 材料與方法
1.1 材料
1.1.1實驗材料 本實驗選用野生型Col-4,35S:LUC-CRY2,prp8-11擬南芥材料,均由實驗室保存。擬南芥生長條件為:光照時間為長日照(16 h光照,8 h黑暗),生長溫度為22℃左右。
1.1.2實驗試劑 高保真酶KOD FX購自TOYOBO公司;In-fusion酶購自全式金公司;2×TaqPCRMix購自康為公司;DNA限制性內切酶購自 Thermo Fisher Scientific公司; TRIzol Reagent、質粒小提中量試劑盒購自天根公司;AxyPrepDNA膠回收及質粒小提試劑盒購自Axygen公司;TransScript?Ⅱ One-Step gDNA Removal and cDNA Synthesis SuperMix反轉錄試劑盒購自全式金公司;TB GreenTMPremix ExTaqTM購自TaKaRa公司。
1.1.3實驗器材 DYY-6C電泳儀、Bio-Rad穩壓穩流電泳儀、Roche Light Cycler 96型Real-time PCR system、Eppendorf centrifuge 5424R/5417R/5810R離心機、Bio-rad GelDoc XR凝膠成像系統、Nanodrop2000C。
1.2 方法
1.2.1LUC發光檢測 在22℃,長日照溫室中種植擬南芥35S:LUC-CRY2和prp8-11植株,生長7 d,利用高分辨率化學發光檢測成像系統(型號:1024EB)進行LUC發光檢測。發射波長為520 nm,激發波長為480 nm,首先在明場曝光1 s,放置好樣品的位置;在樣品上均勻噴上Luciferase底物,黑暗靜置5 min,在暗箱平臺曝光10 min后,顯示出LUC的發光情況。經過對LUC發光強度的檢測,進一步檢測出CRY2在蛋白質水平上的表達情況。
1.2.2PRP8基因敲除載體的構建 從TAIR 數據庫 (http://www.arabidopsis.org)下載擬南芥PRP8基因的序列,利用在線網站CRISPRdirect(http://crispr.dbcls.jp/)設計兩個sgRNA序列(表1)。使用KOD FX 擴增目的片段,限制性內切酶StuⅠ酶切載體JRH0645,凝膠回收目的片段和線性化載體。In-fusion連接且轉化大腸桿菌,篩選陽性克隆,保存菌株,并由北京六合華大基因科技有限公司測序。
1.2.3擬南芥遺傳轉化 在22℃,長日照溫室中種植擬南芥Col-4,待大部分植株形成頂端花序后,去除已經結莢的部分。配制花序轉化液(含5%的蔗糖,0.03% 的Silwet-77),用花序轉化液懸浮農桿菌,將擬南芥的花序浸入轉化液中,30 s左右。完成轉化以后將擬南芥側放,黑暗放置12~24 h后,轉入正常條件培養,至種子成熟。
1.2.4擬南芥下胚軸長度的測定 野生型Col-4、突變體prp8-11種子春化3 d后,22℃左右,放置在黑暗、藍光(20 μmol/m2·s)、紅光(2.5 μmol/m2·s)、遠紅光(0.5 μmol/m2·s)的不同生長條件下培養,生長3 d左右,觀察下胚軸表型并拍照,用Image J進行下胚軸長度的測量。
1.2.5擬南芥開花統計 用5%的NaClO消毒種子10 min左右,之后用滅過菌的蒸餾水沖洗3次,在1/2 MS培養基上點種。4℃春化3 d,在長日照(16 h光照,8 h黑暗)、22℃左右的生長條件下培養7 d,移至營養土繼續培養。花期是指從春化后的種子放到培養室起至抽苔1 cm的時間,蓮座葉的統計主要統計在抽苔時擬南芥初生蓮座葉的數目。統計突變體蓮座葉從植株生長開始每隔一周數一次,并用簽字筆做標記,下次統計沒有標記的葉片,直至抽苔完成為止,所有數值的總和即為抽苔時蓮座葉總數目。
1.2.6Western Blot檢測CRY2的蛋白質表達量
擬南芥植株春化3 d后,在持續光照,22℃條件下培養7 d,黑暗下生長24 h,再轉到紅光(5 μmol/m2·s),藍光(5 μmol/m2·s)條件下,分別在0 min、5 min、10 min、20 min、30 min時刻取樣并進行蛋白質提取。將等量的蛋白質提取物在10%的SDS-PAGE凝膠上以90 V恒壓進行電泳操作2 h;使用半干轉的方法將蛋白質印跡轉到硝酸纖維素膜上,以20 V恒壓轉膜50 min;用5%脫脂奶粉在水平搖床封閉1 h左右,一抗CRY2(1∶1 000)室溫下孵育1~2 h,PBST洗膜3次;二抗(1∶3 000)室溫下孵育1~2 h,PBST洗膜3次;加顯色底物進行曝光顯影,保存圖片并分析。
1.2.7qRT-PCR檢測CRYs基因的表達量 擬南芥生長條件及取樣方式同1.2.5,取樣以后利用Trizol法進行總RNA的提取,參照TransGen Biotech反轉錄試劑盒(TransScript?Ⅱ One-Step gDNA Removal and cDNA Synthesis SuperMix)的操作說明獲取cDNA。從TAIR數據庫(http://www.arabidopsis.org)下載擬南芥CRY1、CRY2基因的序列,用Primer 3.0(http://primer3.ut.ee/)設計引物(表1),并由北京六合華大基因科技有限公司合成。以反轉錄獲得的cDNA為模板,用熒光特異引物,參照TaKaRa的TB GreenTMPremix ExTaqTM的操作方法,在Roche Light Cycler 96型實時熒光定量PCR儀進行。qRT-PCR反應體系為(20 μL):SYBR Premix ExTaq10 μL,Primer F 0.4 μL,Primer R 0.4 μL,模板cDNA 2 μL,ddH2O 7.2 μL。每份樣品重復3次,并設置陰性對照。qRT-PCR反應程序為:95℃ 30 s,95℃ 5 s,60℃ 20 s,50個循環。

表1 實驗所用引物Table 1 Primers used in the experiment.
2 結果與分析
2.1 mac1突變體的獲得
為了篩選影響CRY2蛋白降解的作用因子,本研究以LUC蛋白為篩選標記,對35S:LUC-CRY2穩定轉基因株系的EMS誘變庫進行了LUC發光檢測,獲得了一個LUC發光強度高于35S:LUC-CRY2植株的突變體mac1/LUC-CRY2(圖1A)。
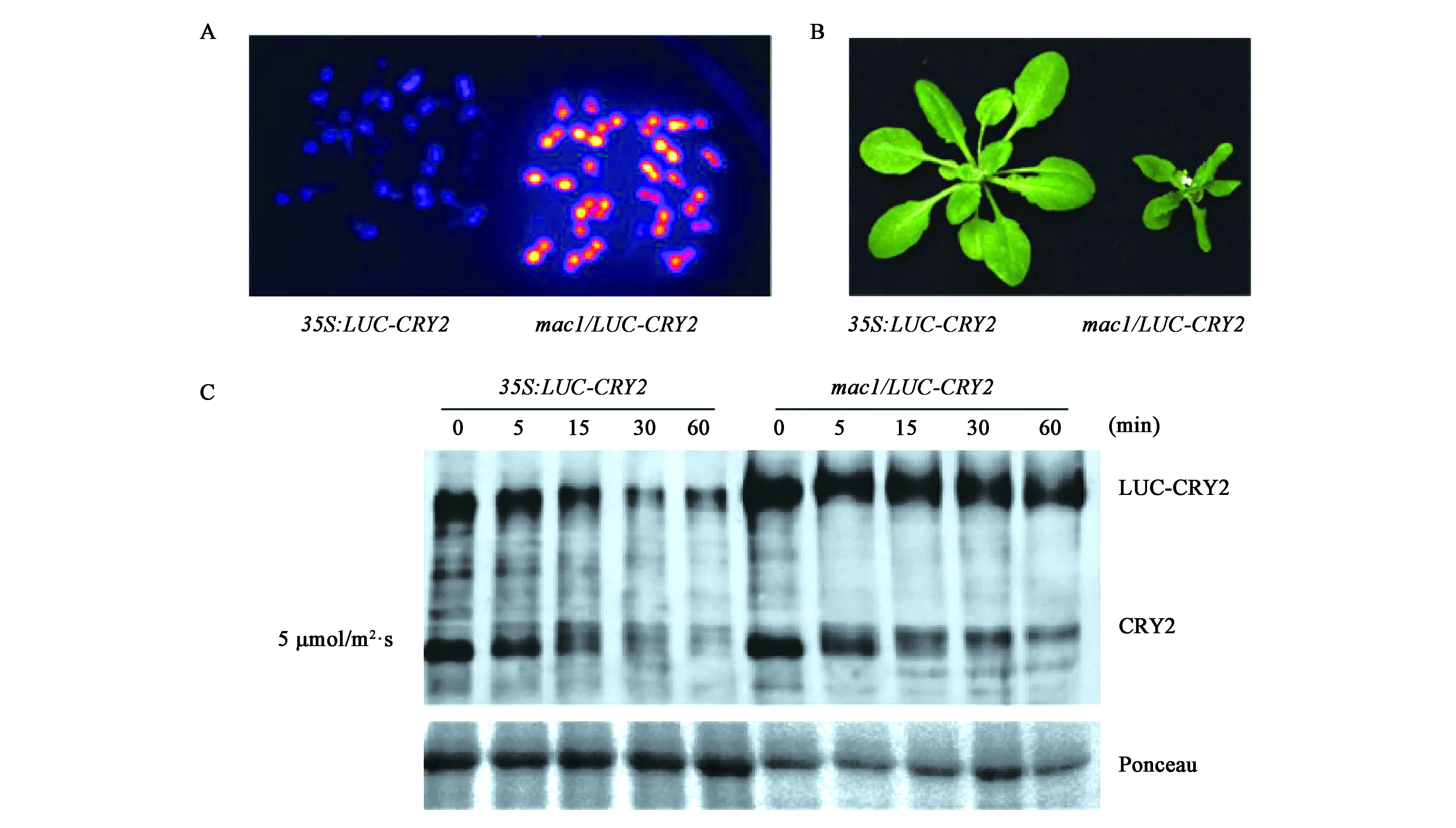
圖1 擬南芥mac1突變體的篩選與表型分析Fig.1 Screening and phenotype analysis of Arabidopsis mac1 mutant.
與35S:LUC-CRY2相比,mac1/LUC-CRY2突變體表現出明顯的表型缺陷,包括植株矮小、葉片卷曲、早花等(圖1B)。利用已有的CRY2多克隆抗體,對mac1/LUC-CRY2突變體中CRY2蛋白水平檢測,Western Blot顯示,在較低強度藍光(5 μmol/m2·s)下,外源LUC-CRY2蛋白在0 min、5 min、15 min、30 min、60 min時的表達量都明顯高于35S:LUC-CRY2中相應時間的CRY2蛋白表達量;而內源CRY2蛋白在30 min和60 min時的CRY2蛋白表達量明顯高于對應35S:LUC-CRY2中相應時間的CRY2蛋白表達量(圖1C)。這些結果初步顯示mac1突變導致外源轉基因LUC-CRY2蛋白的大量積累和內源CRY2蛋白的降解變慢。
2.2 mac1是SUS2/PRP8基因的等位突變體
為了確定mac1突變位點是否與mac1表型連鎖,將mac1/LUC-CRY2突變體與野生型Col-4進行回交,對回交后第二代F2進行表型觀察和分離比計算,發現F2代中只有野生型和mac1突變體兩種表型,并且具有mac1/LUC-CRY2突變體表型的植株占統計植株總數的1/4,因此確定mac1突變位點與表型連鎖并且該突變類型為隱性單基因突變。我們進一步從F2代中挑選具有mac1表型但是不含有35S:LUC-CRY2外源轉基因的株系,用該株系繼續與Col-4進行回交,以消除基因組中其余可能的突變位點,回交4代后,從回交后代收集種子進行后續實驗。
將mac1突變體與另一個擬南芥生態型Ler進行雜交,在雜交后的F2群體中挑選具有mac1突變體表型的植株構建圖位克隆群體,進行mac1基因定位。最終將mac1突變位點定位在1號染色體末端F18B13 BAC內,通過測序,發現突變位點位于基因At1g80070的第六個外顯子上,1個鳥嘌呤核苷酸(G)突變成腺嘌呤核苷酸(A),造成了甘氨酸轉到精氨酸的突變(圖2A)。At1g80070編碼前體mRNA剪接體中的核心剪接因子PRP8,在植物體生長發育各個時期都有表達,在胚柄發育中起主要作用,根據已有的prp8突變體編號,我們將該突變體重命名為prp8-11,以下實驗中都使用該名稱。
為了進一步確定prp8-11的突變體表型是PRP8基因突變造成的,利用CRISPR/Cas9技術,對野生型Col-4植株進行基因定點敲除實驗。獲得的多個后代株系prp8-cr都表現植株矮小、葉片卷曲和早花等類似prp8-11突變體的表型(圖2C、D)。基因測序結果表明,表型顯著的株系均在設計的sgRNA靶標位點發生雜合突變(圖2B)。然而由于該基因突變純合致死,未能鑒定到純合prp8-11突變體植株。上述結果表明CRISPR/Cas9雜合突變體(prp8-cr)的表型是由于PRP8基因突變造成的。
2.3 prp8-11基因突變導致內源CRY2蛋白降解變慢
CRY2蛋白在高強度藍光和低強度藍光下都可以發生降解反應,低藍光下降解速度較慢;CRY1不發生依賴于藍光的降解反應。利用已有的CRY1和CRY2蛋白抗體,在低藍光下檢測prp8-11突變對CRY2蛋白降解的影響,Western Blot顯示,與野生型Col-4相比,prp8-11突變體在轉入藍光下0 min、5 min、10 min時CRY2蛋白明顯積累,在20 min、30 min時蛋白發生降解。CRY1蛋白的表達量在轉入藍光后與野生型相比沒有發生明顯變化(圖3A);將野生型與prp8-11突變體從黑暗轉入紅光下,CRY2和CRY1蛋白表達量與野生型相比沒有發生明顯變化(圖3B)。這些結果表明PRP8對CRY2蛋白降解有促進作用,prp8-11突變后CRY2蛋白降解變慢,prp8-11突變沒有完全抑制CRY2蛋白的降解。prp8-11突變對CRY1蛋白的表達量沒有影響。
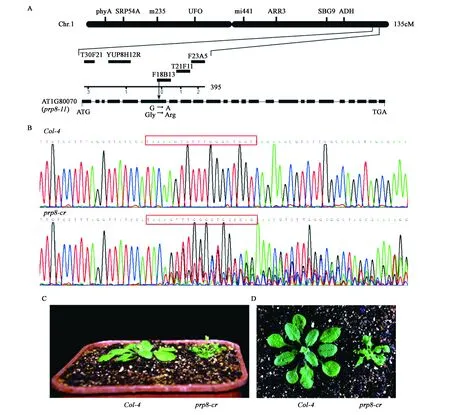
圖2 MAC1基因的圖位克隆與開花表型驗證Fig.2 Map-based cloning and flower phenotype identification of MAC1 gene.
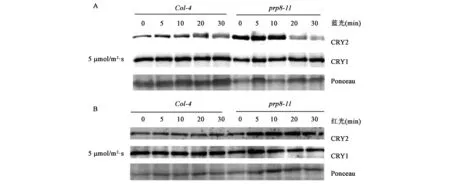
圖3 在不同光照條件下prp8-11中的CRY2蛋白質累積Fig.3 CRY2 protein accumulation in prp8-11 mutant under different light.
已有的研究表明, CRY2蛋白依賴于藍光的降解反應發生在轉錄后水平,磷酸化后的CRY2蛋白依賴于26 S蛋白酶體途徑發生降解。為了鑒別PRP8對CRY2降解的促進作用發生在轉錄水平還是轉錄后水平,本研究將野生型和prp8-11突變體分別由黑暗轉到藍光和紅光條件下,檢測不同時間點Col-4和prp8-11突變體中CRY1、CRY2基因的表達情況,Real-time PCR顯示,在低藍光下,prp8-11突變體中CRY1和CRY2的表達量均低于野生型 (圖4A、B)。轉入紅光條件下后,prp8-11突變體中的CRY1和CRY2表達也同樣低于野生型(圖4C、D)。這些結果表明,在prp8-11突變體中,CRY2蛋白降解變慢不是由于基因在轉錄水平表達升高引起的,PRP8對CRY2蛋白降解過程的影響發生在轉錄后水平。
2.4 prp8-11突變體表現早花表型
CRY2在擬南芥中主要負責在長日照(LD)下促進開花。prp8-11突變體中CRY2蛋白降解變慢,推測可能會因為CRY2蛋白的積累而影響擬南芥的開花時間。通過對prp8-11突變體在LD下開花時間進行統計,發現與野生型相比,prp8-11突變體開花時間明顯提前(圖5A、B)。在35S:LUC-CRY2轉基因株系中,CRY2蛋白過量表達,植株也同樣表現出較早的開花表型(圖5A)。這些結果表明,PRP8基因在LD下抑制擬南芥開花,這種作用很可能是通過促進CRY2蛋白降解,從而影響CRY2參與調控的開花途徑實現的。
2.5 prp8-11突變體表現下胚軸變短表型
CRY1在擬南芥中主要負責藍光下抑制下胚軸的伸長, CRY2在低藍光下對下胚軸的伸長有抑制作用。由于prp8-11在低藍光下對CRY2蛋白降解有抑制作用,推測PRP8可能參與到CRY2調控的下胚軸伸長的抑制過程中。通過分析prp8-11突變體在不同光照條件下的下胚軸長度,發現在黑暗、藍光(20 μmol/m2·s)、紅光(2.5 μmol/m2·s)和遠紅光(0.5 μmol/m2·s)條件下,prp8-11突變體的下胚軸明顯短于野生型Col-4(圖6)。這些結果證明PRP8有促進下胚軸伸長的功能,這個過程可以不依賴于光照而獨立存在。PRP8也參與到了其他光照相關的下胚軸長度的調控過程中。
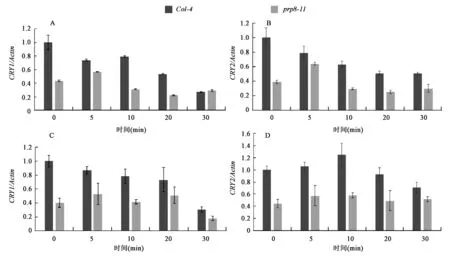
圖4 不同光照下CRY1與CRY2基因mRNA表達量分析Fig.4 Gene expression analysis of CRY1 and CRY2 under blue or red light conditions.
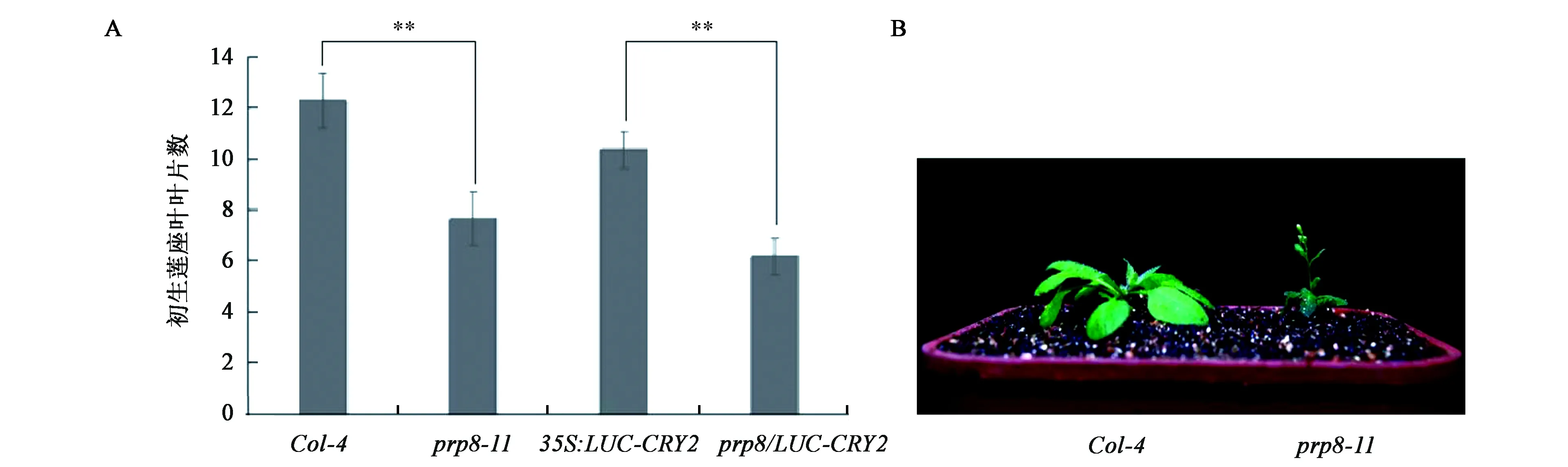
圖5 prp8-11在長日照條件下表現出早花的表型Fig.5 prp8-11 shows early flowering phenotype in long day.
3 討論
本研究首次揭示了PRP8基因有促進 CRY2降解和下胚軸伸長的新功能,并且證明PRP8對擬南芥開花有抑制作用。到目前為止,在擬南芥中除已經證實的BIC1和BIC2外,已知的能夠影響CRY2降解的作用因子知之甚少[18]。因此本研究彌補了該方面的研究空白,為進一步了解CRY2的降解過程及其作用機理提供了依據。
根據本研究結果,PRP8促進CRY2蛋白降解,但其作用機制還不清楚。我們推測,PRP8作為前體mRNA剪接因子,可能通過影響CRY2前體 mRNA的剪接,改變了CRY2蛋白的結構,最終影響了CRY2蛋白的降解。已有的研究結果表明,PRP8基因突變后植物基因組會發生內含子保留現象[21],如果有內含子保留在CRY2 mRNA中并成功翻譯成蛋白質,導致CRY2蛋白結構發生改變,后續的降解過程很可能因此受到影響。此外,PRP8功能完全喪失的突變體導致胚胎致死,因此本研究獲得的是功能不完全缺失的突變體,在表型觀察時,也可能導致對CRY2蛋白降解的影響不明顯,而實際上PRP8對CYR2蛋白降解的影響可能會更顯著。
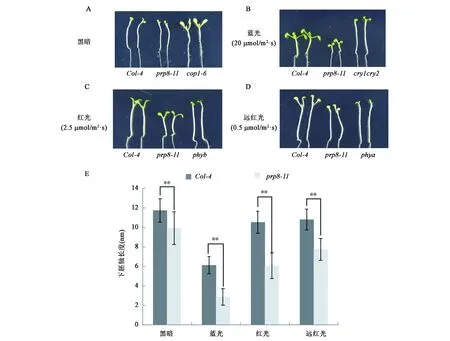
圖6 prp8-11在不同光照條件下下胚軸表型Fig.6 Hypocotyl phenotype of prp8-11 in different light conditions.
在擬南芥中,CRY2和PRP8都具有促進開花的功能。在自主成花途徑中,PRP8基因突變導致FLC基因表達上調,從而抑制植物開花。本研究中,prp8-11突變體表現出早花表型,因此推測,PRP8在自主成花途徑之外,還參與其他開花相關途徑。CRY2通過CIBs或COP1/SPAs途徑調控擬南芥開花,那么PRP8可能通過參與CRY2相關的開花調控途徑。如果PRP8參與CIBs相關途徑,那么prp8-11突變后,可能通過抑制CRY2降解,積累更多的CRY2蛋白與CIBs轉錄因子互作,從而促進下游FT基因的表達;如果PRP8參與COP1/SPAs途徑,那么在prp8-11突變體中,CRY2蛋白過多積累導致下游CO蛋白積累,從而促進擬南芥開花。但目前還不知道PRP8具體參與了哪條CRY2相關途徑調控開花,這需要實驗來進一步確定。
CRY1和CRY2具有藍光特異的下胚軸調控功能,但從本實驗的結果來看,CRY1的蛋白表達并沒有受到prp8-11突變的影響,PRP8基因可能不是通過CRY1來調控下胚軸的長度,但prp8-11在藍光下有明顯的下胚軸變短表型,這可能是由于prp8-11屬于功能不完全喪失的弱突變體,對CRY1蛋白的影響沒有被明顯檢測到。CRY2在低藍光下可以抑制下胚軸的伸長,在prp8-11突變體中,CRY2蛋白積累會造成下胚軸明顯變短,推測PRP8可能通過CRY2依賴的途徑來調控下胚軸的長度。在紅光和遠紅光條件下prp8-11突變體也表現出下胚軸變短表型,所以不排除PRP8通過其他光受體相關途徑調控下胚軸長度。PRP8與光信號互作的分子機制還不清楚,所有這些問題都需要進一步研究才能找到答案,這些問題的答案將為進一步了解CRYs及PRP8的作用機制作出貢獻。

