蒺藜苜蓿赤霉素氧化酶基因MtGA20ox的功能解析
馬青霞, 殷鵬程, 林 浩, 金竹萍, 王歡慶, 楊江平, 裴雁曦*, 牛麗芳*
1.山西大學生命科學學院, 太原 030006;2.中國農業科學院生物技術研究所, 北京 100081;3.克拉瑪依綠成農業開發有限責任公司, 新疆維吾爾自治區 克拉瑪依 834000
紫花苜蓿(MedicagosativaL.)作為一種優質牧草在世界范圍內被廣泛種植,由于其含有黃酮類化合物、優質膳食纖維、食用蛋白等成分,且具有優異的消化率和較低的生產成本,故而被稱為“牧草之王”[1,2]。紫花苜蓿在中國已有2 000多年栽培歷史,是我國種植歷史最久、經濟價值最高的豆科牧草,所以苜蓿產量的提高可極大促進牧草產量的增加。
對近年來苜蓿產量的分析表明,我國苜蓿產業遠遠落后于美國,以2017年為例,2017年我國國內苜蓿總產量為250萬t,而美國苜蓿總產量已超過1 000萬t,隨著今后我國對苜蓿需求量的不斷增加,苜蓿將呈現供不應求的狀態,依然需要通過進口途徑大量獲得[3]。已有研究表明,苜蓿的產量受到多重因素的共同影響,包括莖葉比、生長速度、鮮干比、株高和單枝重等,其中株高是呈現苜蓿生長狀態、衡量其產量的重要指標,株高與苜蓿產量呈顯著正相關[4]。同時,株高也受到多個因素的影響,其中,植物激素赤霉素(gibberellic acid,GA)對株高的調控作用至關重要,早在20世紀60年代已有研究證實赤霉素的調控會對植物株高產生影響[5,6]。
GA作為五大植物激素之一,參與調控植物生命周期的多個過程,包括植物的開花、種子的萌發、果實的發育、葉的伸展以及莖的伸長等。迄今為止,在植物中發現的GA已達136種,且按時間順序將它們命名為GA1~GA136,其中只有少量GA具有生物活性(即對植物生長發育的調節具有生物效應),包括GA1、GA3、GA4和GA7等[7,8]。GA水平受到多種途徑的共同調控,其中GA合成途徑是調控GA水平必不可少的過程。GA是一種由四環骨架衍生而得的雙萜類化合物,GA合成的過程可分為3個階段,在此期間參與GA合成的酶主要有古巴焦磷酸合成酶、內根-貝殼杉烯氧化酶、GA20-氧化酶(GA20-oxidase,GA20ox)、GA2-氧化酶(GA2-oxidase,GA2ox)以及GA3-氧化酶(GA3-oxidase,GA3ox)等[9]。GA20ox、GA2ox以及GA3ox是GA生物合成過程中的關鍵酶,其中,GA20ox是一種雙加氧酶,其可將GA合成途徑中無生物活性的GA53和GA12氧化成有生物活性的GA20和GA9[10]。GA20ox作為GA生物合成階段的限速酶,在GA生物合成過程中起關鍵作用。
已有研究表明,在水稻、擬南芥和玉米等多個物種中,GA20-氧化酶基因的缺失會導致植株矮化,如水稻Os20ox2基因的缺失導致sd-1突變體植株出現半矮化的表型;擬南芥AtGA20ox1、AtGA20ox2和AtGA20ox3基因的缺失導致突變體植株出現不同程度的矮化性狀等[9,11,12],值得注意的是,擬南芥AtGA20ox1、AtGA20ox2、AtGA20ox3和AtGA20ox4均具有完整的GA20-氧化酶活性,而GA20ox5不能將無生物活性的GA氧化生成有生物活性的GA。同時,在多個物種中的研究發現GA20-氧化酶基因的過表達植株呈現株高增加的表型[10,13,14]。
紫花苜蓿由于轉化效率低、基因組較大且為同源四倍體等特征不易開展基因功能解析研究,而紫花苜蓿的的近源種蒺藜苜蓿(Medicagotruncatula)由于生長周期較短、基因組較小、遺傳轉化效率較高和自花授粉等特點成為豆科模式植物,蒺藜苜蓿和紫花苜蓿在遺傳上具有相似性,因此在蒺藜苜蓿中獲取的信息也可用于紫花苜蓿。目前已有研究表明,在蒺藜苜蓿中GA20ox基因的變化與體細胞胚發生過程相關[15],但是在蒺藜苜蓿中該基因對株高的調控尚不清楚,由于該基因功能與植株矮化的性狀密切相關,而植株矮化和半矮化的表型有利于植物抗倒伏,進而可促進農業的發展[16],因此,本研究以蒺藜苜蓿為實驗材料,通過反向遺傳學的方法對蒺藜苜蓿GA20ox基因進行初步研究,并對其對株高的調控作用進行深入解析,以期為進一步研究苜蓿中GA20ox的基因功能提供一定的參考依據。
1 材料與方法
1.1 實驗材料
1.1.1植物材料 蒺藜苜蓿野生型R108由本實驗室保存,突變體mtga20ox7-1、mtga20ox7-2以及mtga20ox8-1從美國諾貝爾研究所(Noble Research Institute)獲得。煙草種子由本實驗室保存。
蒺藜苜蓿種子處理:選擇健康飽滿且生長狀態均勻的種子,在砂紙上將種子種皮磨破后浸泡于清水中直至種子吸水膨脹,將吸水后的種子鋪在有雙層濕濾紙的培養皿中進行萌發。實驗材料在生長條件為溫度24℃、濕度70%、光照強度380 μmol/m2·s、光周期16 h(光)/8 h(暗)的溫室培養生長。
1.1.2實驗試劑 TRIzol、焦炭酸二乙酯(DEPC)、Gateway LR Clonase II Enzyme mix和Gateway BP Clonase II Enzyme mix均購自美國Invitrogen公司;反轉錄試劑盒(TransScript-Uni One-Step gDNA Removal and cDNA Synthesis SuperMix)購自北京全式金生物技術(TransGen Biotech)有限公司;高保真酶KOD FX購自日本東洋紡公司;DNA凝膠回收試劑盒和質粒提取試劑盒購自天根生化科技(北京)有限公司;各種限制性內切酶均購自美國NEB公司。
1.2 實驗器材
5424R/5702R/5430R離心機(德國Eppendorf公司),PCR擴增儀(杭州博日科技有限公司),D7100照相機(日本尼康公司),LSM700激光共聚焦顯微鏡(德國卡爾·蔡司公司),電泳系統(美國Bio-Rad公司),凝膠成像系統1600(上海天能科技有限公司)。引物合成和樣品測序由生工生物工程(上海)股份有限公司完成。
1.3 GA20ox系統進化樹的構建及蛋白質序列分析
從TAIR(www.arabidopsis.org)網站下載5個擬南芥AtGA20ox的蛋白質序列,在MedicagotruncatulaGenome Database(http://blast.jcvi.org/Medicago-Blast/)中通過BLASTP找到與擬南芥AtGA20ox同源的MtGA20ox的蛋白質序列,將它們進行序列同源性比對并采用MEGA5.0軟件構建系統進化樹。在NCBI protein數據庫(https://www.ncbi.nlm.nih.gov/)中分析GA20ox蛋白的保守結構域,通過BioEdit的ClustalW Multiple alignment軟件對MtGA20ox與AtGA20ox蛋白進行序列比對分析。
1.4 RT-PCR檢測MtGA20ox基因的組織表達特性
提取野生型R108不同組織的總RNA,包括生長28 d植株的根,生長40 d植株的莖,生長50 d植株的未展開的復葉、花苞,開花后10 d植株的種子以及營養生長時期的莖尖。反轉錄過程參照反轉錄試劑盒的操作說明進行,以反轉錄后的cDNA為模板,利用各自基因特異性引物通過RT-PCR方法進行基因表達量分析(引物見表1)。RT-PCR反應體系(20 μL):2×PCR Buffer for KOD FX 10 μL,dNTPS(150 mmol/L)2 μL,KOD FX 0.4 μL,模板cDNA 0.5 μL,上、下游引物(10 μmol/L)各1 μL,ddH2O 5.1 μL。RT-PCR反應程序:98℃ 2 min;98℃ 20 s,58℃ 20 s,68℃ 1 min;68℃ 2 min;24℃ 1 min。以MtActin為內參,檢測基因在不同組織中的相對表達量,其中MtActin基因擴增25個循環,MtGA20ox基因擴增30個循環。每個實驗進行3次生物學重復。
1.5 MtGA20ox蛋白的亞細胞定位
通過Gateway系統,分別構建了含有融合綠色熒光蛋白(green fluorescent protein,GFP)標簽的過表達載體pMDC83-35S∷MtGA20ox1-GFP、pMDC83-35S∷MtGA20ox7-GFP和pMDC83-35S∷MtGA20ox8-GFP。再通過EHA105農桿菌介導的煙草瞬時轉化的方法將3個載體分別轉入生長3~4周齡的煙草葉片中,對侵染后的煙草進行3 d黑暗處理后在激光共聚焦掃描顯微鏡下觀察MtGA20ox蛋白的亞細胞定位。

表1 實驗所用引物Table 1 Primers used in the experiment.
1.6 突變體表型觀察及數據統計
分別取3個50 d突變體植株進行表型觀察和數據統計,統計所有突變體主莖的長度,每個突變體至少統計15個植株。
2 結果與分析
2.1 MtGA20ox蛋白的系統進化樹
為了分析蒺藜苜蓿MtGA20ox與擬南芥AtGA20ox的親緣關系,通過MEGA軟件對擬南芥和蒺藜苜蓿的GA20ox蛋白進行分子系統進化分析并構建系統進化樹。如圖1所示,發現在蒺藜苜蓿中有8個擬南芥AtGA20ox的近緣蛋白,這與Igielski等[15]的研究結果一致。其中,與參與有活性GA合成的AtGA20ox1~4親緣關系較近的為MtGA20ox1、MtGA20ox7和MtGA20ox8。同時,系統進化樹表明,其他5個MtGA20ox均與GA20ox蛋白聚在1個分支。
2.2 MtGA20ox蛋白的氨基酸序列比對
通過BioEdit軟件將MtGA20ox與擬南芥AtGA20ox的氨基酸序列進行比對,結果如圖2所示,發現MtGA20ox1、MtGA20ox7以及MtGA20ox8與擬南芥AtGA20ox蛋白的氨基酸序列高度同源,且所有的氨基酸序列均含有1個保守的2OG-FeⅡ_Oxy結構域[17,18]。
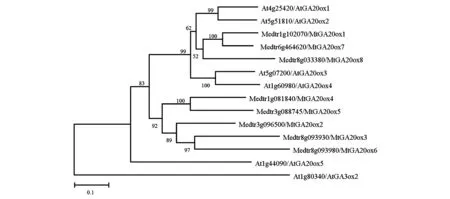
圖1 擬南芥AtGA20ox與蒺藜苜蓿MtGA20ox蛋白的系統進化樹Fig.1 Phylogenetic tree of AtGA20ox and MtGA20ox.
2.3 MtGA20ox基因的表達模式分析
為了進一步分析MtGA20ox1、MtGA20ox7和MtGA20ox8在不同組織器官中的表達情況,本實驗通過RT-PCR分別檢測了3個基因在蒺藜苜蓿各組織中的表達量。如圖3所示,MtGA20ox1在蒺藜苜蓿的根、莖、花、種子和莖尖中均有表達,在葉中表達量較低;MtGA20ox7在蒺藜苜蓿的根、葉、花、種子和莖尖中均有表達,在莖中表達量較低;而MtGA20ox8在蒺藜苜蓿的莖和種子中有表達,在根、葉、花以及莖尖中表達量較低。其中,MtGA20ox1、MtGA20ox7、MtGA20ox8分別在花、葉、種子中表達量最高,且它們分別與其他組織中表達量相比差異明顯,表明MtGA20ox1、MtGA20ox7以及MtGA20ox8的表達具有組織特異性[19],可能與它們參與不同的組織發育相關。
2.4 MtGA20ox蛋白亞細胞定位
蛋白質是生命活動體現者,亞細胞定位對分析其功能及作用極其重要[20],為了確定MtGA20ox蛋白在植物亞細胞結構中的分布情況,將MtGA20ox1、MtGA20ox7和MtGA20ox8基因的編碼序列分別構建到pMDC83載體中,得到它們分別與GFP融合的表達載體,再通過注射滲透法對煙草葉片進行瞬時轉化,利用激光共聚焦顯微鏡來觀察瞬時表達的綠色熒光。結果表明,MtGA20ox1、MtGA20ox7和MtGA20ox8定位在細胞核和細胞質中[21],這與前人研究的GA20ox在許多其他物種中的定位相一致[22]。

圖2 GA20ox氨基酸序列比對Fig.2 Alignment of the amino acid sequences of GA20ox.
2.5 MtGA20ox7和MtGA20ox8的突變體鑒定
為了研究MtGA20ox1、MtGA20ox7和MtGA20ox8的基因功能,本實驗從蒺藜苜蓿Tnt1逆轉座子插入突變體庫中篩選獲得了MtGA20ox7和MtGA20ox8對應的插入突變體。如圖5A所示,MtGA20ox7篩選到2個Tnt1插入突變體,分別命名為mtga20ox7-1和mtga20ox7-2,其中mtga20ox7-1中Tnt1插入在第1個外顯子上,mtga20ox7-2中Tnt1插入在第2個外顯子上,通過RT-PCR檢測發現在mtga20ox7-1和mtga20ox7-2中均未檢測到全長MtGA20ox7基因的表達(圖5C)。如圖5B所示,MtGA20ox8篩選到Tnt1插入在第1個外顯子上的1個突變體mtga20ox8-1,通過RT-PCR檢測發現在mtga20ox8-1中未檢測到全長MtGA20ox8基因的表達(圖5D),表明這3個突變體均為基因功能缺失突變體。
2.6 突變體表型分析及主莖長度的統計
進一步對得到的3個突變體進行表型觀察和主莖長度數據統計分析。如圖6所示,mtga20ox7-1、mtga20ox7-2和mtga20ox8-1與野生型相比株高無明顯變化,上述結果表明,MtGA20ox7和MtGA20ox8的單獨突變對蒺藜苜蓿的主莖長度沒有影響。
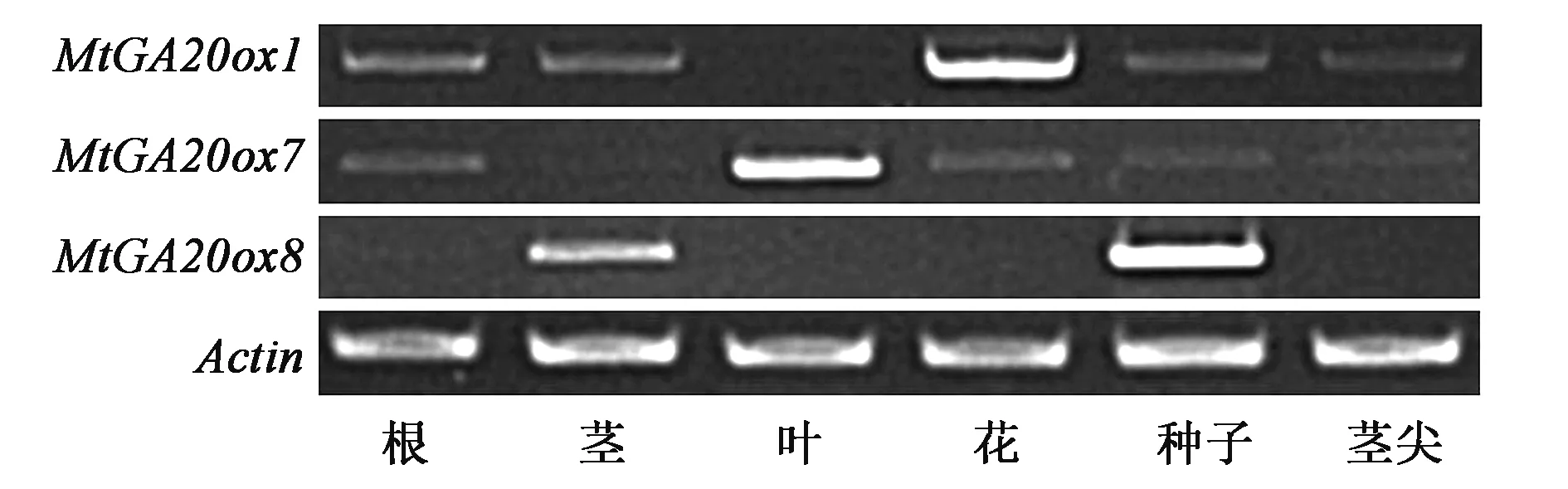
圖3 MtGA20ox1、MtGA20ox7和MtGA20ox8在蒺藜苜蓿不同組織中的表達模式Fig.3 Expression patterns of MtGA20ox1, MtGA20ox7 and MtGA20ox8 in different tissues of M. truncatula.
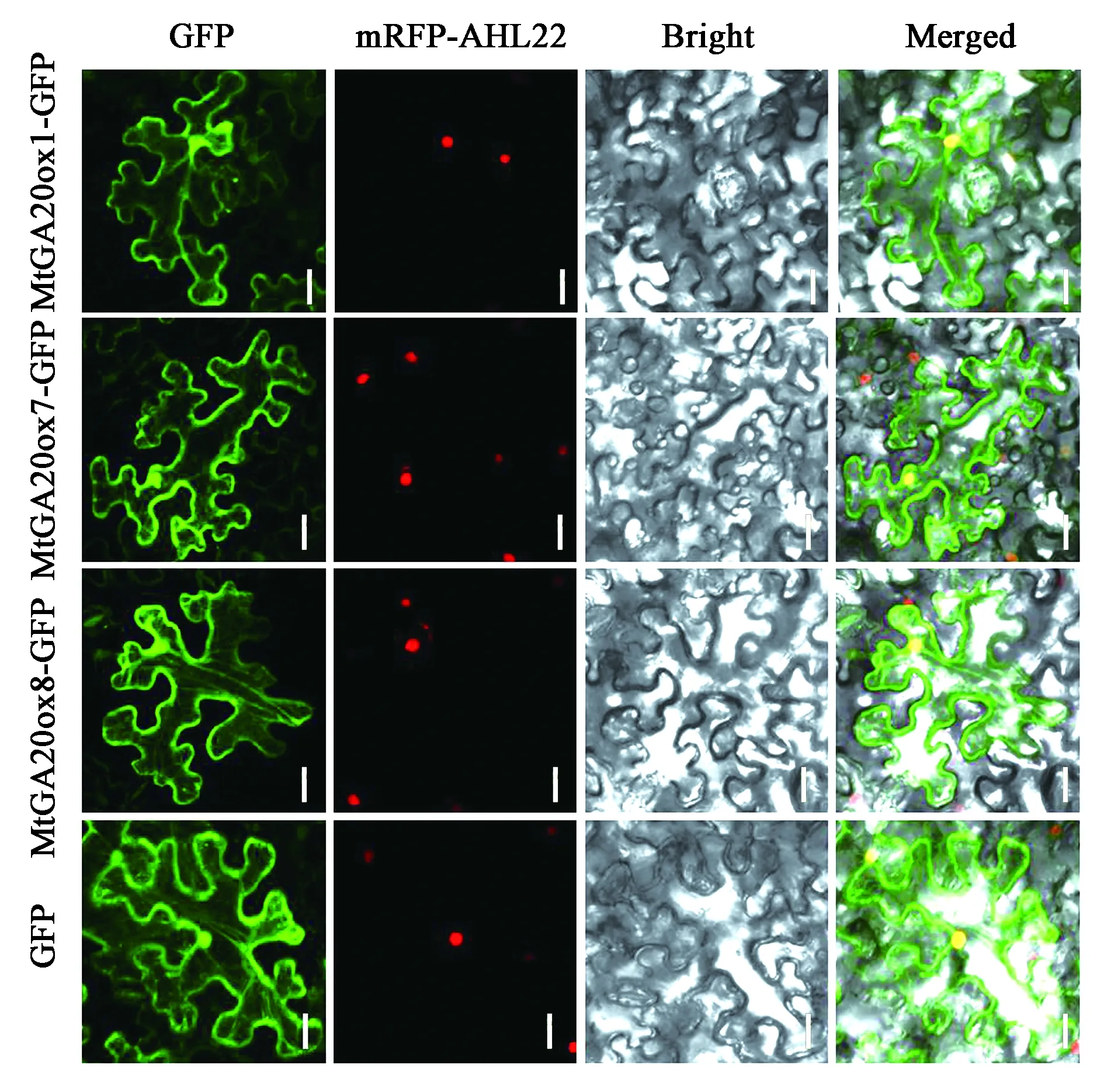
圖4 MtGA20ox1、MtGA20ox7和MtGA20ox8在煙草表皮細胞的亞細胞定位Fig.4 Subcellular localization of MtGA20ox1, MtGA20ox7 and MtGA20ox8 in tobacco epidermal cells.
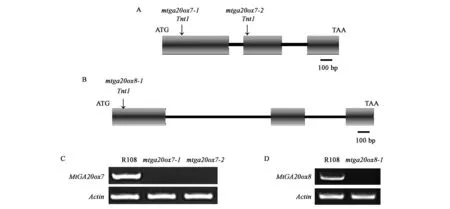
圖5 MtGA20ox的基因結構以及突變體中MtGA20ox的表達檢測Fig.5 Structures of the MtGA20ox genes and transcriptions of MtGA20ox in mutants.
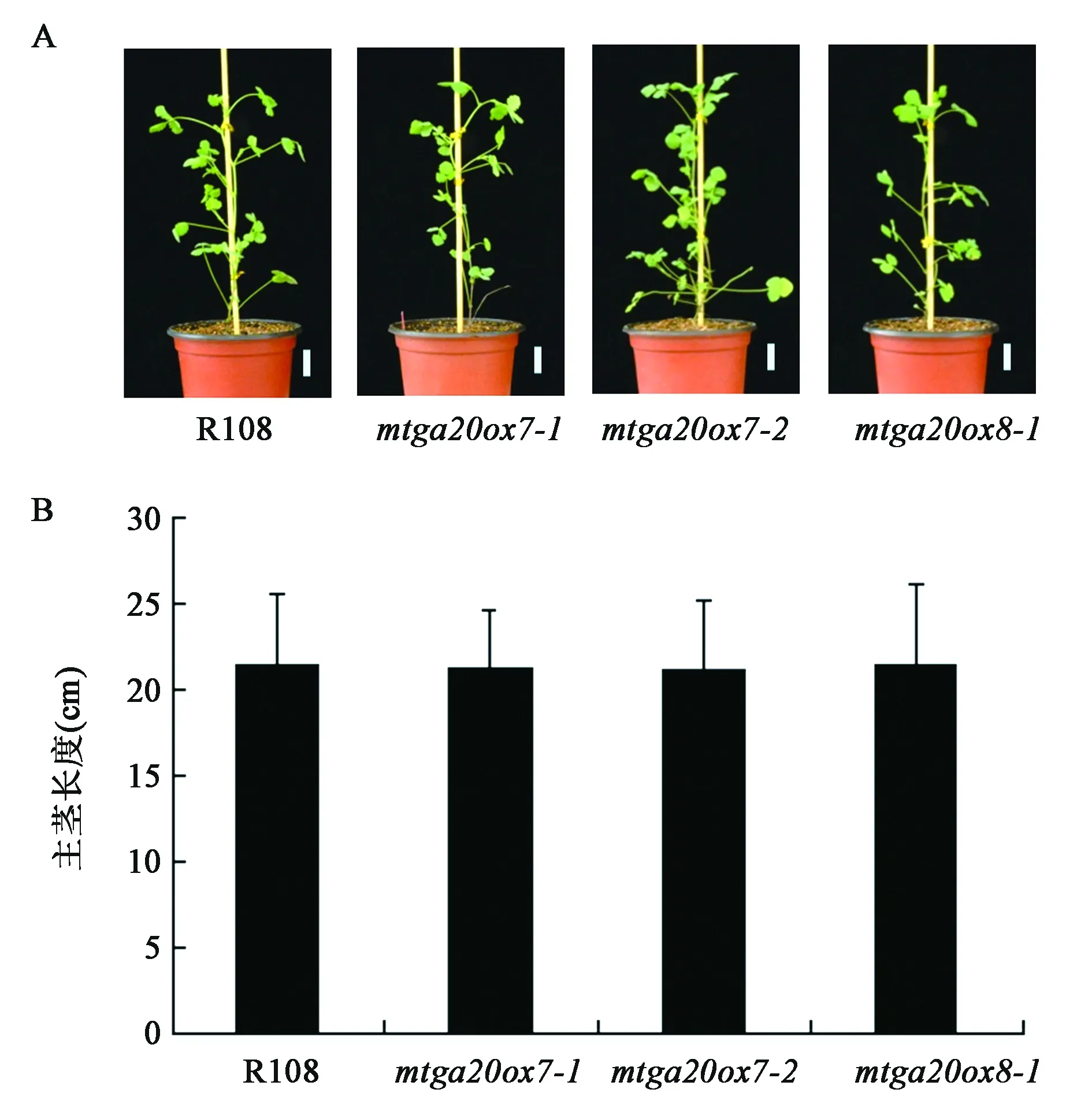
圖6 突變體株高表型分析Fig.6 The phenotypes of plant height of mutants.
3 討論
中國作為草原資源大國,天然草原面積393萬km2,約占國土總面積的41.7%,僅次于澳大利亞,居世界第2位[23]。但我國苜蓿產量仍不理想,同時隨著畜牧業的發展,我國對苜蓿的需求也逐年增加,因此,提高苜蓿產量已成為生產中亟待解決的問題。
已有研究表明,株高與作物產量和生物量密切相關。植物株高受到不同遺傳信號、環境因素和植物激素的共同調控,其中GA對株高的影響尤為重要。在水稻、玉米、擬南芥中,GA20ox基因的突變都會導致植株不同程度的矮化[10,12,24],但在苜蓿中關于GA20ox基因對株高調控的研究尚未開展。
擬南芥5個GA20ox同源蛋白中,AtGA20ox1、AtGA20ox2、AtGA20ox3和AtGA20ox4均能夠在體外將無生物活性的GA12轉化為有生物活性的GA9,而在相同的反應條件下,AtGA20ox5不能將GA12轉化為有生物活性的GA9。由此可見,在擬南芥5個同源蛋白中,AtGA20ox1、AtGA20ox2、AtGA20ox3和AtGA20ox4具有完整的GA20ox活性,而AtGA20ox5僅催化GA12轉化為GA9的前2個反應[9]。在蒺藜苜蓿中與擬南芥AtGA20ox1、AtGA20ox2、AtGA20ox3和AtGA20ox4親緣關系較近的GA20ox基因有3個,分別為MtGA20ox1、MtGA20ox7和MtGA20ox8,本實驗通過反向遺傳學的方法對MtGA20ox1、MtGA20ox7和MtGA20ox8基因的生理特性和功能進行了研究。通過氨基酸序列比對發現,MtGA20ox1、MtGA20ox7和MtGA20ox8氨基酸序列都含有2OG-FeⅡ_Oxy結構域。已有研究表明,2OG-FeⅡ_Oxy是一個2-酮戊二酸和Fe2+依賴的雙加氧酶超家族保守結構域,2-酮戊二酸和Fe2+能與底物相互作用發生反應,進而催化赤霉素生物合成過程中不同的羥基化和去飽和步驟[25,26],因此下一步實驗計劃將檢測MtGA20ox是否具有酶活。
通過對篩選得到的突變體進行表型觀察和數據統計發現mtga20ox7和mtga20ox8突變體與野生型相比株高無變化,可能由于MtGA20ox在控制株高性狀時存在功能冗余或者這2個MtGA20ox無酶活。為了深入研究MtGA20ox基因的功能,首先需要獲得MtGA20ox1基因的功能缺失突變體,同時通過人工雜交構建其兩兩之間的雙突變體和三突變體并對其進行表型觀察;其次通過轉化實驗獲得3個MtGA20ox過表達植株觀察其是否具有株高增加的表型,最后通過測定各個突變體中GA的含量以及體外酶活實驗確定其是否具有酶活性。

