發酵劑對羊肉香腸中蛋白、脂質代謝與風味物質的影響
王德寶 胡冠華 蘇日娜 王政綱 趙麗華 靳 燁
(內蒙古農業大學食品科學與工程學院, 呼和浩特 010018)
0 引言
發酵香腸是指將絞碎的瘦肉與丁狀脂肪及輔料混勻后灌入腸衣,經自然或添加外源發酵劑發酵、干燥成熟制成pH值低于5.3的一類發酵肉制品[1-2]。微生物發酵劑較高產酸和快速促使香腸水分活度(aw)下降能力有利于縮短香腸發酵成熟周期,抑制香腸中腐敗及致病微生物生長繁殖,提高香腸衛生質量,改善香腸色澤和風味組成,延長產品貨架期[1]。發酵香腸典型品質及良好風味組成源于發酵成熟期間的理化、生化及微生物的變化,而這一過程蛋白及脂質氧化分解對香腸最終品質特性起到決定性作用[2]。蛋白和脂質是發酵肉制品中營養因子和重要風味物質的主要來源,發酵成熟過程中,其被微生物酶及肉內源酶分解為游離氨基酸和脂肪酸,既可提供人體所需氨基酸和脂肪酸等營養因子,也易通過氧化、分解和Strecker反應及美拉德反應生成決定香腸品質的主要風味物質[3]。周才瓊等[4]研究表明,微生物分泌的酶類可使酸性豬肉中氨基酸和脂肪酸降解為醛、酮、醇、酸等物質,形成發酵肉制品特有風味物質,如3-甲基丁醛、二烯醛、葵酸乙酯等。JOHANSSON等[5]探究戊糖片球菌和木糖葡萄球菌對香腸中風味物質形成的結果表明,復合菌株易在成熟過程中促進風味前體物質——非蛋白氮和游離脂肪酸的生成,提高成熟后香腸中醛類、酮類、醇類及芳香烴等主要風味物質含量。徐瑋東等[6]探究清酒乳桿菌對風干豬肉香腸蛋白分解的影響,發現接種清酒乳桿菌有助于蛋白質分解。王德寶等[7]探究表明,清酒乳桿菌與木糖葡萄球菌微生物發酵劑對羊肉發酵香腸品質及安全性具有重要貢獻,可提高成熟香腸中單不飽和脂肪酸比例,降低香腸中有害生物胺及亞硝酸鹽的含量。
本文選擇清酒乳桿菌、木糖葡萄球菌為發酵劑,制作羊肉發酵香腸,探究不同復合發酵劑對羊肉發酵香腸蛋白質、脂質分解及風味物質形成的影響,以期為實際生產應用提供理論依據及數據支持。
1 材料與方法
1.1 試驗材料
原料肉:羊肉(肥瘦相間),源自內蒙古自治區巴彥淖爾市烏拉特中旗蘇尼特羊后腿及羊尾。腸衣:20~25 mm膠原蛋白腸衣。
發酵劑:清酒乳桿菌(Lactobacillussake)、木糖葡萄球菌(Staphylococcusxylosus),由內蒙古農業大學肉品微生物實驗室提供。
主要化學試劑:色譜純茚三酮、氨基酸標品、37種脂肪酸標品,購于美國Sigma-Aldrich公司;甲醇、正己烷及丙酮(色譜純),購于上海安譜實驗科技股份有限公司。
主要儀器:Master DHS型動態頂空進樣器,美國Thermo科技有限公司;GC-MS DSQ Ⅱ型單四極桿氣相色譜質譜聯用儀,美國Thermo公司;L-8900型氨基酸自動分析儀,日本日立公司。
1.2 試驗方法
1.2.1發酵香腸制作
參照ZHAO等[8]方法,試驗配方為:羊肉(羊后腿肉80%、羊尾肥膘20%)、蔗糖0.5%、食鹽2.5%、亞硝酸鈉70 mg/kg、葡萄糖0.5%、硝酸鈉100 mg/kg、抗壞血酸0.05%、發酵劑1×107cfu/g。工藝條件如表1所示。

表1 發酵香腸加工工藝條件Tab.1 Fermented sausage processing conditions
1.2.2試驗設計
通過產生物胺試驗,結果表明清酒乳桿菌有較好抑制組胺、腐胺等有害生物胺的能力;木糖葡萄球菌產脂酶能力較強,有助于增加前體為脂肪酸的特征風味物質;因此選擇清酒乳桿菌和木糖葡萄球菌為本試驗的發酵劑,在預試驗及單因素模擬試驗基礎上,獲得發酵劑清酒乳桿菌與木糖葡萄球菌最佳復配比(菌體濃度比)為1∶2。并將試驗分為3組,分別為:對照組(不加外源發酵劑)、單一組(清酒乳桿菌)和復配組(清酒乳桿菌+木糖葡萄球菌)。然后取原料肉及成熟后發酵香腸經真空包裝后保存于-80℃,備用。
1.2.3pH值、aw、色差、亞硝酸鹽殘留量、游離脂肪酸及氨基酸含量的測定
參照GB 5009.237—2016《食品pH值的測定》、GB 5009.33—2016《食品中亞硝酸鹽與硝酸鹽的測定》、GB 5009.168—2016《食品中脂肪酸的測定》、GB 5009.124—2016《食品中氨基酸的測定》測定香腸pH值、亞硝酸鹽殘留量、游離脂肪酸及氨基酸含量[9-12];使用HD-3A型智能水分活度儀、CR-410型色差計測定香腸aw、亮度(L)和紅度(a*)。
1.2.4蛋白質分解指數(PI)測定
參考HUGHES等[13]方法,將2 g樣品與18 mL蒸餾水加入50 mL離心管中,均質2 min,5℃、100 r/min離心15 min,Whatman 1號層析紙(100 111 μm)過濾上清液2次,記濾液體積(V)。15 mL濾液和15 mL 10%TCA(三氯乙酸)混合后靜置30 min,與上述同樣條件下離心,Whatman 4號層析紙(100 427 μm) 過濾上清液,取5 mL濾液測定氮質量濃度N1,通過N0(0.2VN1)計算非蛋白氮質量,總氮質量為N。蛋白水解指數PI為N0/N×100%。
1.2.5風味測定
參照羅玉龍等[14]方法略作修改,在20 mL樣品瓶中加入4 g粉碎香腸樣,將老化的萃取頭插入樣品瓶使石英纖維頭暴露于樣品上部空間,在60℃條件下吸附40 min后拔出,萃取頭在GC進樣口(250℃)下解吸附3 min。
揮發性風味成分GC-MS(氣相色譜-質譜)測定的GC條件:TR-5型毛細色譜柱(30 m×0.25 mm×0.25 μm),載氣為He,載氣流速為1.0 mL/min,傳輸線溫度250℃,不分流進樣,進樣時間1 min;升溫程序:40℃保持3 min,以4℃/min升溫到150℃,保持1 min,再以5℃/min升溫到200℃,最后以20℃/min升至230℃,保持5 min。MS條件:離子源溫度250℃,進樣口溫度250℃,質量掃描范圍30~400(質荷比)。
質譜數據經與MEANLIB、NISTDEMO和Wiley Library檢索定性,將匹配度大于 800 作為鑒定依據。
1.3 數據處理
采用Excel和SPSS 19.0統計軟件對數據進行統計處理和顯著性分析。
2 結果與分析
2.1 不同發酵劑對羊肉發酵香腸理化品質的影響
由表2可知,原料肉灌腸后經發酵成熟pH值急劇下降,接種清酒乳桿菌+木糖葡萄球菌的復配組pH值顯著低于對照組和原料肉(5.80)(P<0.05),但與單一組差異不顯著(P>0.05)。NIE等[15]研究表明,復合發酵劑有助于促進糖酵解進程和乳酸等有機酸積累,加速香腸酸化速率,快速降低香腸pH值并縮短香腸發酵周期,這與本研究結果一致。表2表明,香腸在發酵成熟過程水分活度(aw)急劇下降,復配組aw顯著低于其他兩組(P<0.05),這是由于隨著pH值下降并接近蛋白質等電點改變了肌球重鏈蛋白與水分結合能力,從而促進成熟過程水分蒸發和aw的快速降低[1]。SUN等[16]研究表明,低aw和pH值可顯著抑制香腸中產生物胺及亞硝胺的腸桿菌等有害菌生長繁殖,說明利用復合發酵劑制作香腸可提高其品質和安全性能,延長香腸貨架期。香腸亮度L與原料肉差異不顯著,而香腸紅度則顯著高于原料肉(P<0.05),3組從小到大表現為:對照組、單一組、復配組(P<0.05),這可能與低pH值促使亞硝酸鹽與肌紅蛋白結合形成亞硝基肌紅蛋白有關,而香腸紅度色澤(a*)的提高[17],使得香腸中亞硝酸鹽殘留量顯著(P<0.05)低于國家規定肉食品亞硝酸鹽殘留量標準(30 mg/kg)[18]。蛋白質水解在香腸發酵成熟過程至關重要,其分解產物寡肽及游離氨基酸是香腸重要風味前體[19]。文獻[20-21]研究表明,乳酸菌和葡萄球菌可代謝支鏈氨基酸(如亮氨酸、異亮氨酸、纈氨酸)生成對發酵香腸風味具有重要影響的2-甲基丁醛和3-甲基丁醛;相比原料肉,成熟后蛋白質分解指數(PI)顯著升高,復配組PI最高而與其他組相比差異不顯著,說明微生物發酵劑的蛋白質水解酶活性較弱,而蛋白質分解主要依賴于內源蛋白酶。這與LORENZO等[22]研究表明內源性蛋白酶和氨基酸氨肽酶是肉中蛋白質分解的主要酶類的試驗結果相一致。
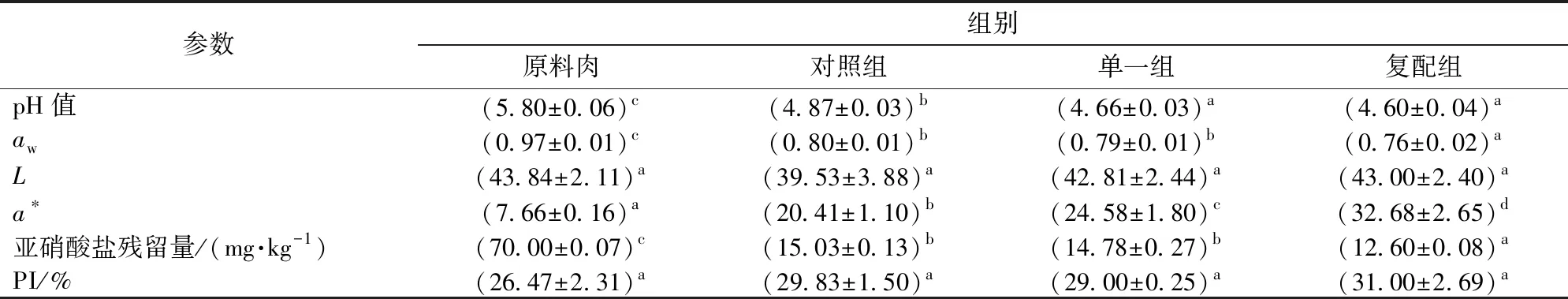
表2 不同發酵劑對成品羊肉香腸理化品質的影響Tab.2 Effect of different starter cultures on physico-chemical quality of fermented mutton sausages
注:同一行(列)不同小(大)寫字母表示差異顯著(P<0.05),相同則差異不顯著(P>0.05)。下同。
2.2 不同發酵劑對羊肉發酵香腸中游離氨基酸的影響
由表3可知,原料肉中游離氨基酸(FAA)含量與對照、單一和復配3組差異不顯著(P>0.05)。經發酵成熟后,游離氨基酸(FAA)總量從大到小依次為復配組、單一組、對照組;必需氨基酸(EAA)從大到小依次為復配組、對照組、單一組,但差異不顯著(P>0.05)。綜上表明,添加清酒乳桿菌與木糖葡萄球菌對香腸中游離氨基酸組成無顯著影響,這一結果與CASABURI等[23]研究相一致。綜合上述蛋白質分解指數測定結果,說明內源蛋白水解酶類活性遠高于微生物發酵劑。正如文獻[24-26]所報道, 谷氨酸和天冬氨酸產生鮮味,甘氨酸和丙氨酸具有甜味,而精氨酸、亮氨酸、賴氨酸、纈氨酸和苯丙氨酸等氨基酸則會給香腸造成一定苦味。部分引起苦味氨基酸可作為極具影響香腸風味的前體氨基酸,如亮氨酸、纈氨酸等,在相應轉氨酶及脫羧酶存在條件下生成2-甲基丁醛和3-甲基丁醛及3-甲基丁醇,且3-甲基丁醛與硫化合物反應可產生類似培根香味的物質[20-21],可將苦味氨基酸轉換為2-甲基丁醛、3-甲基丁醛及3-甲基丁醇等特征風味物質的發酵劑及其代謝途徑,有待于進一步研究。精氨酸還是嬰兒必需氨基酸,同時還具有多種獨特的生理和藥理作用,能提高機體免疫功能、促進機體蛋白質合成、保護腸胃黏膜,在臨床營養治療中發揮著重要作用[27]。復配組甜味及鮮味氨基酸所占百分比(11.64%、26.67%)高于單一組(11.51%、26.35%)和對照組(11.19%、26.11%),說明添加復合發酵劑有利于改善香腸滋味。
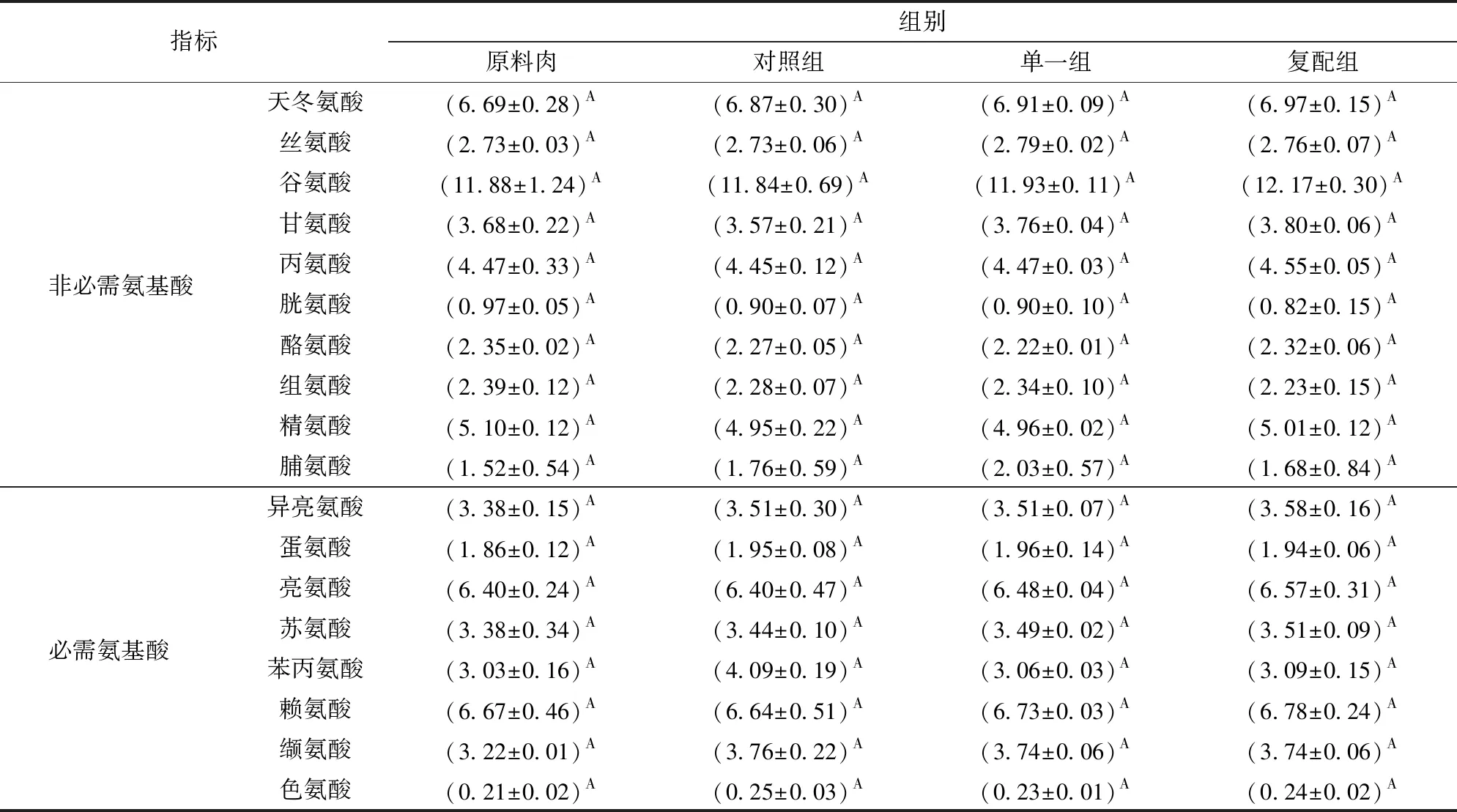
表3 不同發酵劑對羊肉香腸游離氨基酸組成的影響Tab.3 Effects of different starter cultures on composition of free amino acids in fermented mutton sausages mg/kg
2.3 不同發酵劑對羊肉發酵香腸中游離脂肪酸的影響
香腸中脂肪酸含量及組成與營養價值及風味物質形成密切相關。發酵劑與內源脂酶可將肉中中性脂肪及磷脂分解為短鏈揮發性脂肪酸、醛、酯等物質賦予發酵肉制品特有風味[5],還可促進飽和脂肪降解、加速單不飽和脂肪酸(MUFA)和多不飽和脂肪酸(PUFA)的釋放[28];攝入適量MUFA、PUFA可有效預防心腦血管疾病,因而不飽和脂肪酸(UFA)具有重要的營養保健價值[29]。由表4可知,發酵香腸檢出脂肪酸主要以肉豆蔻酸(C14:0)、硬脂酸(C18:0)、棕櫚油酸(C16:1)、油酸(C18:1)及亞油酸(C18:2n6)、亞麻酸(C18:3n3)為主;對照、單一及復配3組中該6種脂肪酸總和約占各自脂肪酸總量86.83%、85.53%、90.45%。
由表4可知,肉豆蔻酸(C14:0)和硬脂酸(C18:0)含量高于其他飽和脂肪酸(SFA),是組成飽和脂肪酸中重要脂肪酸。相比于原料肉中的SFA含量(209.59 mg/(100 g)),發酵成熟后3組香腸SFA呈現不同幅度增加,其中肉豆蔻酸(C14:0)增加幅度遠高于其他SFA,是影響香腸與原料肉中SFA存在顯著差異(P<0.05)的主要脂肪酸。此外,復配組香腸SFA(232.74 mg/(100 g))顯著低于對照組(259.03 mg/(100 g))、單一組(250.94 mg/(100 g))(P<0.05),這可能與發酵成熟過程清酒乳桿菌與木糖葡萄球菌促使飽和脂肪酸去飽和轉化為UFA或被分解有關[30]。
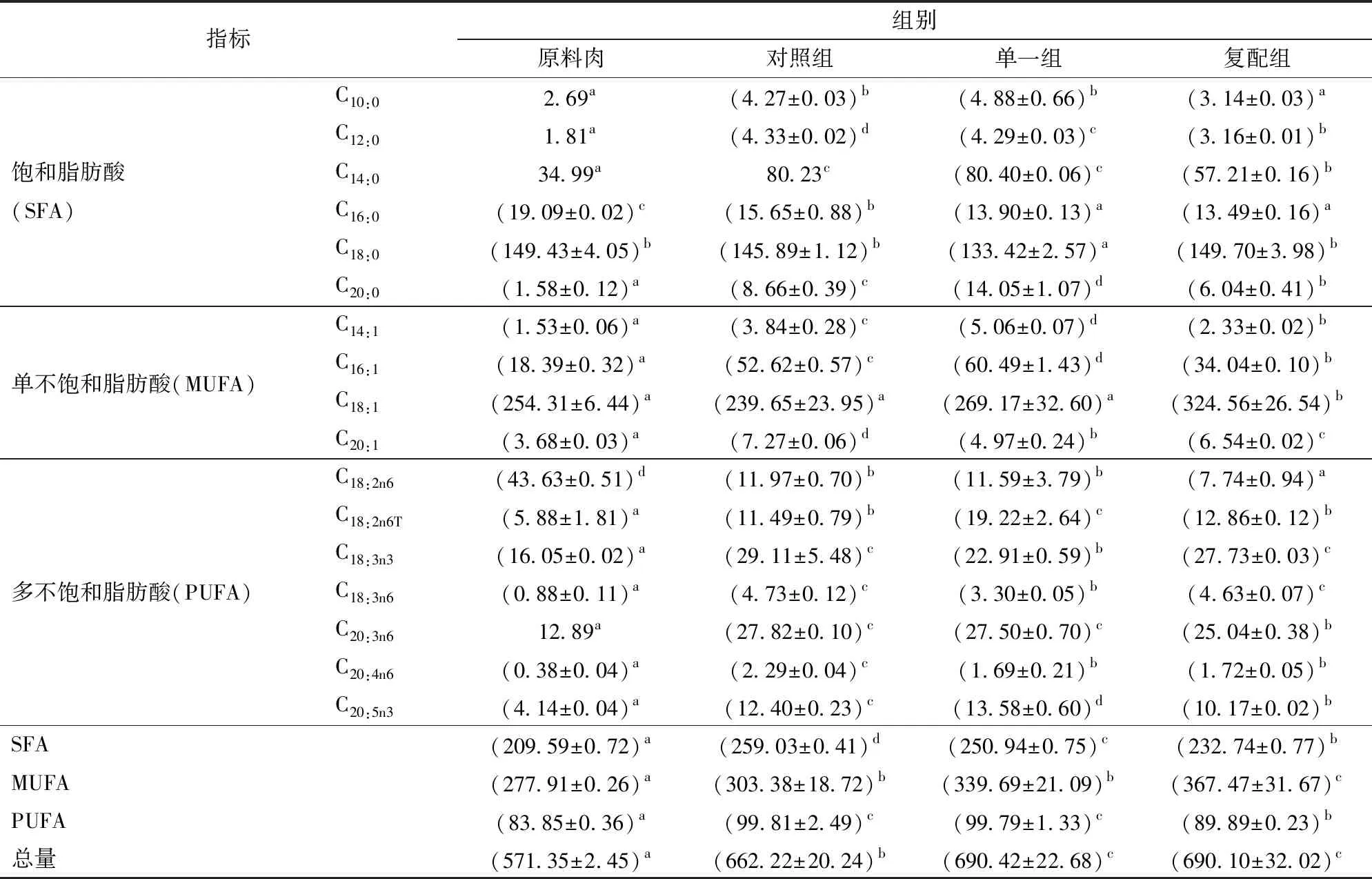
表4 不同發酵劑對羊肉香腸游離脂肪酸組成的影響Tab.4 Effects of different starter cultures on composition of free fatty acids in fermented mutton sausages mg/(100 g)
由表4可知,添加微生物發酵劑對香腸中單不飽和脂肪酸(MUFA)釋放有顯著影響;清酒乳桿菌與木糖葡萄球菌復合發酵劑對MUFA釋放貢獻最為顯著。MUFA中油酸(C18:1)約占對照、單一及復配3組單不飽和脂肪酸的78.99%、79.23%、88.32%,為影響3組香腸中MUFA組成存在顯著差異(P<0.05)的主要脂肪酸,棕櫚油酸(C16:1)次之,使得復配組MUFA含量顯著高于原料肉和對照組,這與EMANUELA等[31]研究相一致,可能與油酸主要位于甘油三酯的sn-1和sn-3位置有關,易被發酵劑所產生及內源脂肪酶水解而釋放。油酸也是香腸中風味物質重要前體,加熱過程其雙鍵易被氧化形成過氧化物,進一步分解為閾值較低的羰基類(醛、酮)風味物質,如具有烤肉香味的2-庚烯醛和油脂香味的2-癸烯醛,BENET等[32]發現該類物質在熟豬肉火腿中含量較高。此外,MOTTRAMD[33]研究表明,棕櫚油酸(C16:1)含量與肉風味顯著正相關,其氧化分解產物為具有青草香味的1-己醇。相比原料肉中PUFA,3組香腸均有不同幅度增加,差異從大到小表現為:對照組、單一組、復配組,但3組香腸中部分PUFA差異不顯著或對照組略高,說明內源脂酶對香腸中PUFA釋放起主要作用,這一結果與沈清武等[28]研究相一致。相比原料肉PUFA組成,香腸中亞油酸、亞麻酸、花生四烯酸(C20:4n6)和二十碳五烯酸(C20:5n3)均有大幅上升;且香腸中特征、低閾值風味物質主要來自于PUFA中亞油酸、亞麻酸、花生四烯酸和二十碳五烯酸,如丙至癸醛、烯醛和二烯醛及酮類等羰基類風味物質[34],這是由于不飽和脂肪酸中氧化斷裂位點較多,易降解氧化為上述風味物質。
2.4 不同發酵劑對羊肉發酵香腸中風味物質形成的影響
香腸中風味物質主要源于蛋白質及脂質氧化分解,如氨基酸Strecker降解、脂質氧化及Maillard反應構成風味物質生成主要途徑[3]。由表5可知,3組香腸與原料肉中特征風味組成存在較大差異。原料肉共檢出風味物質27種,對照組為44種;發酵劑組45種,其中醛類15種、醇類10種、酯類8種,酮、酸、烷烴類各2種,萜類及其他為6種。組間比較可知,單一清酒乳桿菌發酵劑對香腸種風味相對含量影響較小;復合發酵劑可促進蛋白質、脂質分解,提供風味物質生成的前體,提高香腸中特征風味物質含量,這一結果與上述蛋白質分解指數和脂肪酸組成變化及JOHANSSON等[5]研究相一致。
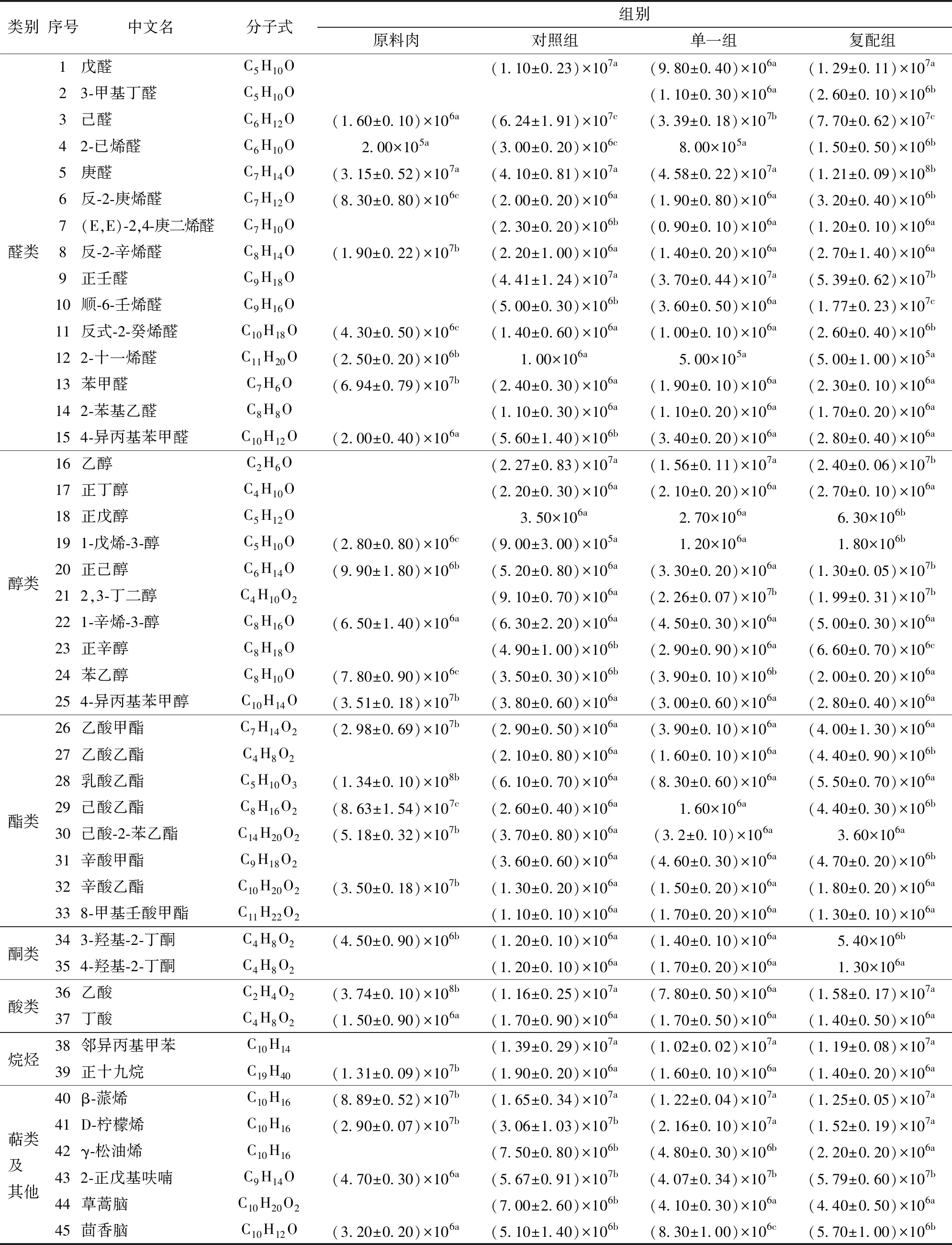
表5 不同發酵劑對發酵羊肉香腸中風味組成的影響(以單位質量吸收度表示)Tab.5 Effects of different starter cultures on flavor composition in fermented mutton sausages g-1
較低閾值和呈現良好香氣的醛類使其成為肉制品中重要揮發性風味物質[35]。香腸中含量較高的3種醛類:己醛具有青草味、庚醛和正壬醛呈現油脂香味,3種醛類的前體是亞油酸和亞麻酸[36-37],而復配組亞油酸和亞麻酸含量高于對照、單一組與原料肉,較高含量的前體底物促使復配組中己醛、庚醛、正壬醛含量高于其他3組。3-甲基丁醛是一種低閾值、具有蘋果香味、易與肉制品中硫化物形成類似培根風味的物質,是前體氨基酸形成重要風味中一種,其前體為亮氨酸、纈氨酸等支鏈氨基酸[21],結果表明3-甲基丁醛僅在發酵劑組中檢出且復配組含量高于單一組,說明清酒乳桿菌與木糖葡萄球菌有利于促進支鏈氨基酸通過Strecker降解向3-甲基丁醛的轉變。由表5可知,苯甲醛是羊肉中主要芳香醛[14],發酵香腸中含量較低,與香腸中4-異丙基苯甲醛可能均來自苯丙氨酸的Strecker降解[38]。綜上得出,添加清酒乳桿菌與木糖葡萄球菌的復合發酵劑有助于促進香腸脂質及氨基酸向特征風味物質轉變。
相比醛類,醇類風味閾值較高,原料肉中檢出5種,香腸中為10種。對風味貢獻較大的主要是1-辛烯-3-醇、1-戊烯-3-醇和苯甲醇,前兩種又稱為蘑菇醇,具有濃郁蘑菇香味,主要來源于花生四烯酸和亞油酸的脂質氧化[39]。苯甲醇是重要芳香醇之一,常以酯類形式呈現并存在于玫瑰花油及香腸中。上述醇類在羊肉中含量高于香腸,說明這些特征香味醇類主要源自原料肉。酯類通常呈甜味和水果香味,閾值較低,其存在可使發酵香腸整體風味因短鏈酸類帶來的尖刺感變得更加柔和。酯類中辛酸乙酯、己酸-2-苯乙酯等對香腸風味貢獻較大,而這些酯類可能主要源于醛類物質氧化形成酸類與醇類酯化而成[40]。相比香腸,原料肉中這些酯類含量最高。綜上表明,發酵劑對醇類及酯類影響微小。
酮類化合物由氨基酸Strecker降解、脂肪酸氧化熱降解及微生物分解代謝產生,其風味獨特、閾值低,可賦予香腸干酪水果香味、花香,隨著碳鏈增加風味愈加濃郁[41]。發酵香腸中檢出3-羥基-2-丁酮和4-羥基-2-丁酮,原料肉僅檢出3-羥基-2-丁酮。3-羥基-2-丁酮由香腸中檸檬酸代謝產生二乙酸轉化而來,賦予香腸清香奶香味[42]。復配組3-羥基-2-丁酮含量顯著高于其他兩組(P<0.05),與原料肉差異不顯著(P>0.05),說明成熟過程中木糖葡萄球菌有助于代謝檸檬酸生成二乙酸最終轉化為3-羥基-2-丁酮。
原料肉與發酵香腸檢出酸類2種,分別為乙酸和丁酸,乙酸主要賦予香腸酸醋味,丁酸則可賦予香腸奶香風味。原料肉中乙酸含量顯著高于3組香腸(P<0.05),而原料肉中丁酸與香腸間差異不顯著(P>0.05)。
烷烴類閾值較高,僅檢出鄰異丙基甲苯和正十九烷,對香腸整體風味影響較小。香腸中還檢出β-蒎烯、D-檸檬烯、γ-松油烯、2-正戊基呋喃、草蒿腦、茴香腦;原料肉中β-蒎烯顯著高于發酵香腸組,2-正戊基呋喃顯著低于發酵香腸組;而γ-松油烯和草蒿腦在原料肉中未發現。
3 結束語
探究了清酒乳桿菌與木糖葡萄球菌對羊肉發酵香腸蛋白質、脂質分解及風味物質形成的影響。添加清酒乳桿菌與木糖葡萄球菌復合發酵劑有助于快速降低香腸pH值、aw;可促進亞硝酸鹽與肌紅蛋白結合,使得香腸紅度高于單一和對照組,并降低亞硝酸鹽在香腸中殘留量,使其低于國家食品安全規定的肉制品中亞硝酸鹽最高殘留標準(30 mg/kg)。蛋白質分解為游離氨基酸主要在于內源蛋白酶的作用,發酵劑促使亮氨酸等支鏈氨基酸向3-甲基丁醛的轉變,有利于提高發酵香腸中3-甲基丁醛含量。內源酯酶對香腸中SFA和PUFA釋放起主要作用,而復合發酵劑對MUFA釋放起到關鍵作用。復合發酵劑可提高香腸中風味物質種類和特征醛類的相對含量。總之,添加復合發酵劑有助于快速降低香腸酸度和水分活度、縮短發酵周期、改善香腸色澤、降低香腸中亞硝酸鹽殘留量和提高香腸安全性;有助于提高香腸中MUFA相對含量,可促進支鏈氨基酸和多不飽和脂肪酸氧化分解為香腸中低閾值的特征風味物質——3-甲基丁醛、己醛、庚醛、正壬醛等醛類,提高香腸營養和風味感官品質。

