慢性不可預見性溫和應激致抑郁對大鼠肝臟轉運多肽mRNA和蛋白表達的影響
劉萃萃,肖志軍,陸賽花,徐 峰
(1.上海健康醫學院附屬第六人民醫院南院,上海201499;2.上海交通大學附屬第六人民醫院南院,上海 201499)
有機陰離子轉運多肽(organic anion transporting polypeptides,人類:OATPs,嚙齒類:Oatps)屬溶質載體超家族,是動物和人體內重要的跨膜轉運蛋白。OATPs/Oatps調節細胞的多種內、外源性物質的攝取和轉運,其中內源性物質包括甲狀腺激素、膽酸鹽、類前列腺素等,外源性物質包括臨床常用的他汀類降脂藥、格列奈類降糖藥以及抗腫瘤藥紫杉醇等[1]。OATPs/Oatps廣泛分布于腸道、肝臟、腎臟、腦等組織,其中人肝臟主要有OATP1B1,OATP1B3和 OATP2B1,大鼠肝臟主要有Oatp1a1,Oatp1a4,和Oatp1b2[2]。
課題組前期研究發現,與正常大鼠相比,慢性不可預見性溫和應激(chronic unpredicted mild stress,CUMS)致抑郁大鼠多種藥物藥動學水平發生變化,同時伴隨藥物代謝酶(Cyp3a、Cyp2d6和Cyp2b1/2)和藥物轉運體(Ugt1a1和Ugt2b)mRNA和蛋白表達水平的改變[3-5]。
為進一步闡明抑郁影響藥物代謝的機制,本研究擬采用SD大鼠建立CUMS大鼠抑郁模型,研究CUMS致抑郁對大鼠肝臟轉運體Oatp1a1、Oatp1a4和Oatp1b2 mRNA和蛋白表達影響。
1 材料
1.1 實驗動物
SPF級雄性SD大鼠,體重(200±20)g,購于上海杰思捷實驗動物有限公司,實驗動物許可證:SCXK (滬)2013-0006。大鼠隨機分為CUMS組和對照組,每組12只,在造模前飼養1周適應環境,室溫(25±2)℃,相對濕度40%~70%,自由進食。所有動物實驗過程均符合實驗動物倫理學要求。
1.2 儀器與試劑
動物行為軌跡分析系統(北京眾實迪創科技有限公司);皮質酮檢測試劑盒、去甲腎上腺素檢測試劑盒(CUSABIO公司);RNA抽提試劑盒、反轉錄試劑盒、SYBR定量試劑盒(Takara公司);Oatp1a4、Oatp1b2、GAPDH一抗(Santa Cruz Biotechnology公司);Oatp1a1一抗(Abcam公司);BCA蛋白定量試劑盒、5×SDS蛋白上樣緩沖液、預染蛋白質分子量標準液、二抗(碧云天生物技術有限公司)。
2 方法
2.1 建立CUMS致抑郁大鼠模型
參考文獻[5]方法并加以改進。抑郁模型組大鼠單籠飼養,連續8周給予以下隨機應激:①熱水應激(45 ℃,5 min);②冷水應激(4 ℃,5 min);③束縛1 h;④籠子傾斜(45°,24 h);⑤夾尾(距尾根1 cm,1 min);⑥噪音10 min;⑦晝夜顛倒24 h;⑧潮濕墊料24 h;⑨水平搖晃10 min。每天給予一種應激,每種應激至少被采用5次,同種應激不連續出現,使動物不可預見下一次應激的種類。應激過程中,模型組大鼠移到另一飼養間內單獨應激(兩房間環境基本一致),應激完成后送回原飼養間。對照組大鼠正常單籠飼養,不接受任何應激。造模前后稱量每只大鼠體重。
2.2 曠場實驗
曠場實驗裝置為高40 cm,長和寬均為100 cm的動物運動軌跡視頻分析系統,通過分析軟件將可運動的區域分為16宮格(25 cm×25 cm)。實驗開始前,將大鼠置于中心方格內,記錄大鼠5min內穿過的格數為水平運動得分,站立或攀附箱壁次數為垂直運動得分,測定完畢后徹底清潔敞箱再進行下一只大鼠的實驗。分別于造模前后進行曠場實驗。
2.3 糖水偏好實驗
分別于造模前后進行糖水偏好實驗:第1天給予大鼠兩瓶1%蔗糖水;第2天給予大鼠一瓶純凈水,一瓶1%蔗糖水;第3天大鼠禁食24 h;第4天給予大鼠一瓶純凈水,一瓶1%蔗糖水,測量1 h內飲用的液體量。
糖水偏好百分比(%)=糖水消耗量/(糖水消耗量+純凈水消耗量)×100%。
2.4 血漿去甲腎上腺素和皮質酮含量測定
造模前后,每只SD大鼠眼底靜脈叢采血1.0 ml,置于肝素鈉浸泡過的1.5 ml EP管中,3 000×g轉速離心5 min后取上清血漿于-80 ℃保存備用。采用酶聯免疫吸附法測定去甲腎上腺素和皮質酮含量。
2.5 RT-qPCR檢測大鼠肝臟Oatp1a1、Oatp1a4和
Oatp1b2 mRNA表達
大鼠斷頭處死后立即解剖,取出肝臟,用0.9%氯化鈉溶液洗滌。依據說明書的操作步驟,利用Trizol試劑盒提取大鼠肝臟總RNA。用紫外分光光度法在260 nm處測定RNA濃度。取1 μg總RNA,利用逆轉錄試劑盒,按說明書操作步驟,得到逆轉錄產物cDNA。以上述逆轉錄反應得到的cDNA為模板,進行RT-qPCR反應。條件為:95 ℃ 5 min,95 ℃ 15 s,60 ℃32 s,共40個循環,每組設3個復孔。mRNA表達量以甘油醛-3-磷酸脫氫酶(GAPDH)為內參,通過2-△△Ct公式計算得到。RT-qPCR引物采用軟件Primer 5設計,由上海桑尼生物科技有限公司合成,其序列見表1。
2.6 Western blotting檢測大鼠肝臟Oatp1a1、
Oatp1a4和Oatp1b2 蛋白表達
取大鼠肝臟組織,剪碎,加入RIPA 裂解液,獲得總蛋白提取物,BCA法進行蛋白定量。取50 μg蛋白上樣進行SDS-PAGE凝膠電泳,分離后轉移至PVDF膜,5%脫脂牛奶封閉2 h,加入一抗4 ℃孵育過夜,TBST洗滌后加入二抗孵育1 h,再次TBST洗滌后加入ECL發光液反應2~3 min,置于暗室曝光。
2.7 統計分析
3 結果
3.1 CUMS對大鼠體重和糖水消耗的影響
如圖1所示,造模開始時,模型組和對照組大鼠體重及糖水偏好百分比比較差異無統計學意義(P>0.05);經8周CUMS后,與對照組相比,模型組大鼠體重增長減緩,糖水偏好百分比降低,差異均有統計學意義(P<0.001)。

表1 RT-qPCR引物序列及擴增片段大小

圖1 CUMS對大鼠體重(A)和糖水偏好百分比(B)的影響 ***P<0.001,與對照組比較
3.2 CUMS對大鼠垂直和水平運動得分的影響
如圖2所示,造模開始時,模型組和對照組大鼠垂直和水平運動得分差異無統計學意義(P>0.05);經8周CUMS后,與對照組相比,模型組大鼠垂直和水平運動得分均降低,差異均有統計學意義(P<0.001)。
3.3 CUMS對大鼠血漿去甲腎上腺素及皮質酮含量的影響
如圖3所示,造模開始時,模型組和對照組大鼠血漿去甲腎上腺素及皮質酮含量差異無統計學意義(P>0.05);經8周CUMS后,與對照組相比,模型組大鼠血漿去甲腎上腺素及皮質酮含量均升高,差異均有統計學意義(P<0.01)。
3.4 CUMS對大鼠肝臟Oatp1a1、Oatp1a4和Oatp1b2 mRNA和蛋白表達的影響
經8周CUMS后,與對照組相比,模型組大鼠肝臟Oatp1a1、Oatp1a4和Oatp1b2 mRNA表達水平均顯著降低,差異均有統計學意義(P<0.05)(圖4)。Western結果表明,與對照組相比,抑郁模型組大鼠肝臟Oatp1a1、Oatp1a4和Oatp1b2 蛋白表達均減少,差異均有統計學意義(P<0.05)(圖5)。
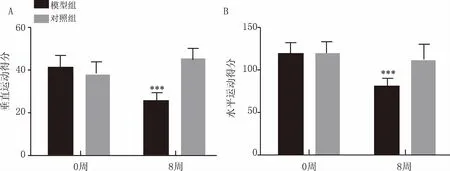
圖2 CUMS對大鼠垂直運動得分(A)和水平運動得分(B)的影響 ***P<0.001,與對照組比較
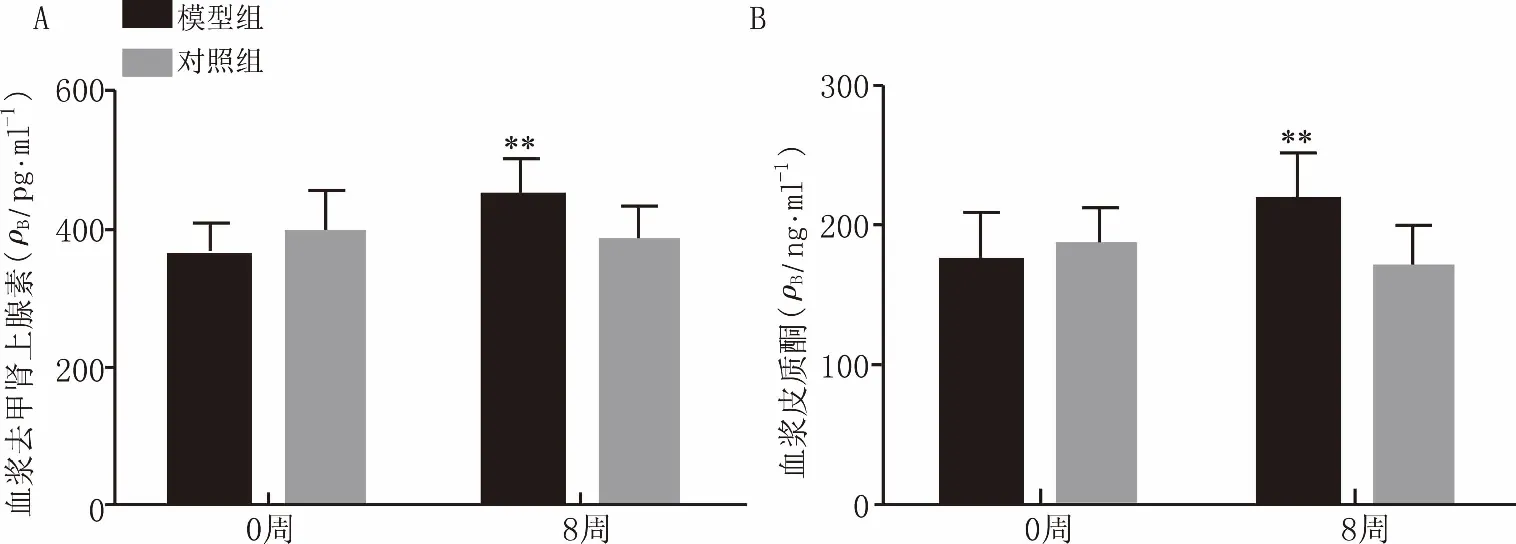
圖3 CUMS對大鼠血漿去甲腎上腺素(A)和皮質酮(B)的影響 **P<0.01,與對照組比較
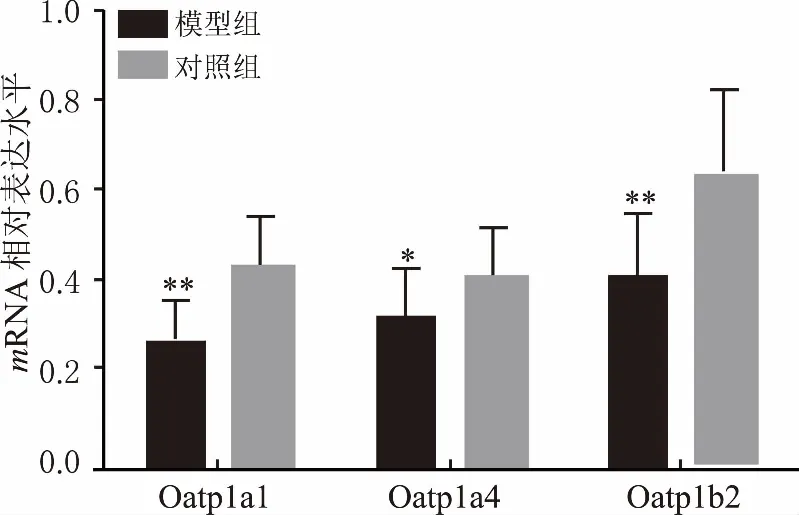
圖4 CUMS對大鼠肝臟Oatps mRNA表達的影響 *P<0.05,**P<0.01,與對照組比較
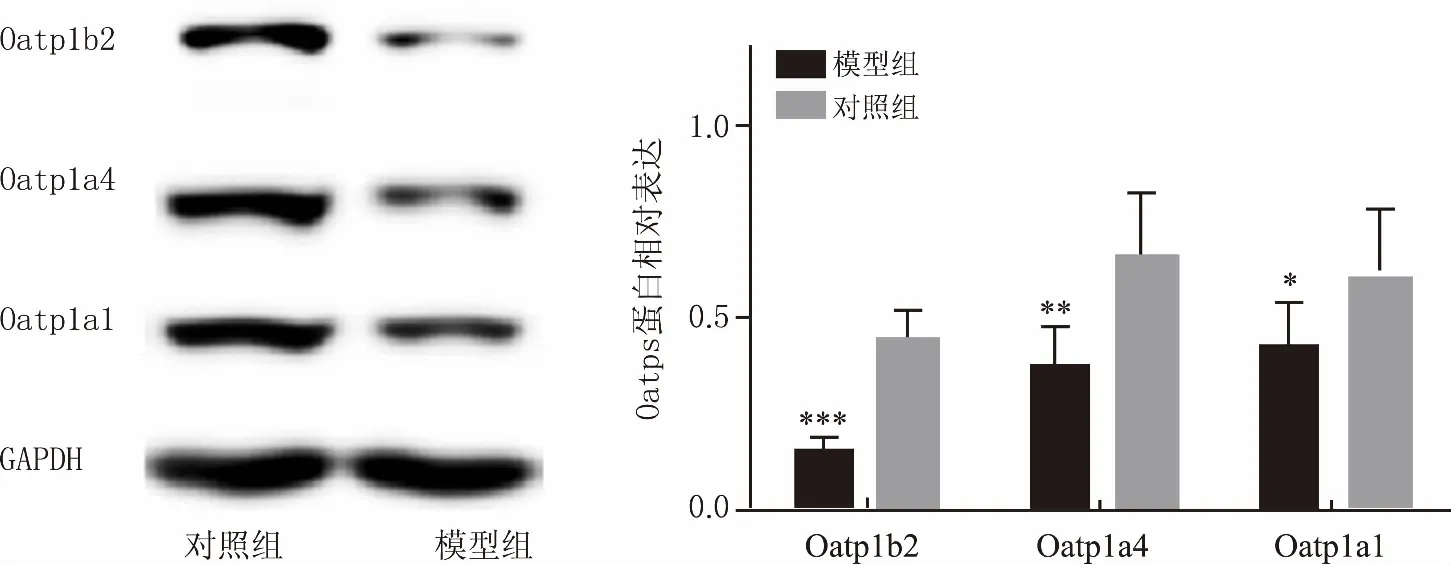
圖5 CUMS對大鼠肝臟Oatps 蛋白表達的影響 *P<0.05,**P<0.01,***P<0.001,與對照組比較
4 討論
應激是機體在各種環境、社會及心理因素刺激時發生的重要生物學反應,是目前廣泛被認同的引起抑郁的主要因素之一。通過不同方式的應激方式可誘導出模仿人類抑郁癥狀的動物模型,包括行為絕望模型、習得性無助模型、社會失敗應激模型、慢性束縛應激模型及CUMS模型等[6]。其中CUMS模型能較好的模擬人類抑郁癥的核心癥狀——快感缺失,因此常被用于抑郁癥發病機制和抗抑郁藥的作用機制研究。本研究采用CUMS建立大鼠抑郁模型,結果顯示,模型組大鼠體重及糖水偏好百分比下降,提示大鼠出現明顯的快感缺失。此外,模型組大鼠垂直運動得分和水平運動得分降低,表明大鼠自主活動和探究活動減少。
下丘腦-垂體-腎上腺軸(hypothalamic-pituitary-adrenal axis,HPA軸)是神經內分泌系統的重要組成部分,在應激過程中協調各系統的作用,使體機更好的適應環境。HPA軸功能亢進被認為是抑郁癥的發病機制之一,同時也是臨床抑郁癥患者常見的神經生物學異常表現之一。本研究中模型組大鼠經8周CUMS后,血清皮質酮含量升高,表明大鼠HPA軸亢進,與以往研究報道的結果相似[7]。此外,HPA軸應激反應與下丘腦去甲腎上腺素的釋放密切相關。研究表明,不同的應激強度和時間對大鼠NA分泌的影響有差異性[8]。本研究選擇不同溫和應激刺激大鼠,結果大鼠血清NA濃度升高,提示大鼠腎上腺能信號通路的激活,以應對應激所致機體內環境的變化。
本研究在成功建立CUMS致大鼠抑郁模型的基礎上,采用RT-qPCR和Western blotting分別檢測了大鼠肝臟Oatp1a1、Oatp1a4和Oatp1b2 mRNA和蛋白表達。結果顯示,與對照組相比,模型組大鼠肝臟Oatp1a1、Oatp1a4和Oatp1b2 mRNA和蛋白表達均降低。不同活性OAPTs能夠影響藥物療效,研究表明,人OATPs基因多態性能影響藥物吸收、分布和排泄,導致藥代動力學參數的改變,最終影響藥物的療效和毒副作用[9]。大鼠肝臟Oatps與人肝臟OATPs功能類似[10],因此,本研究結果提示抑郁患者肝臟OATPs可能表達下調,從而影響其底物藥物的吸收、分布和排泄,最終產生臨床療效的差異。
促炎性細胞因子(proinflammatory cytokines,PCs)對Oatps的表達有重要調節作用。小鼠分別注射IL-1β,IL-6,TNF-α及這3種細胞因子的混合物,結果IL-6或IL-1β能降低Oatp1a1和Oatp1a4 mRNA表達水平20%~60%,且降低水平隨細胞因子劑量的增加而提高;而TNF-α能降低Oatp1a4 mRNA表達水平[11]。此外,PCs在抑郁癥的發病過程中有重要作用。抑郁癥患者外周血中TNF-α、IL-1β和IL-6等細胞因子水平升高,重度抑郁癥患者血清IL-6水平明顯高于輕中度患者[12]。長期慢性輕度應激使大鼠外周及中樞各腦區內IL-1β、TNFα和IL-6 mRNA 水平不同程度地升高[13]。本研究的局限性在于未測定大鼠PCs水平。但基于研究結果和文獻調研,我們認為CUMS可致大鼠PCs水平升高,而PCs可下調大鼠肝臟Oatps基因和蛋白表達降低,因此CUMS下調Oatps mRNA和蛋白的表達可能經由PCs介導。在后續的研究中,我們將對抑郁- PCs -Oatps三者之間的關聯及其涉及的分子機制進行探討。
綜上所述,本研究利用CUMS建立的大鼠抑郁模型肝臟Oatp1a1、Oatp1a4和Oatp1b2 mRNA和蛋白表達均降低,提示抑郁癥患者使用的藥物為OATPs的底物時,藥代動力學可能發生變化,需密切關注臨床療效。

