干酪乳桿菌發酵液中的主要有機酸及其抑菌性
,,,,*
(1.西京學院醫學院,陜西西安 710000; 2.昆明理工大學生命科學與技術學院,云南昆明 650000; 3.長春生物制品研究所有限公司,吉林長春 130000)
乳酸菌(lactic acid bacteria,LAB)是革蘭氏陽性菌,無孢子,無鞭毛,不能運動,是發酵碳水化合物產生酸類物質的一類細菌的統稱。乳酸菌通過其產生的次級代謝產物,如有機酸、細菌素、過氧化氫等物質,抑制病原菌和腐敗菌的生長繁殖,從而達到防腐作用。乳酸、甲酸、乙酸、丙酸等是乳酸菌分泌產生的有機酸的主要成分,這些有機酸可以通過降低微生物生長環境體系的pH,達到抑制病原菌生長繁殖的目的,并由此發揮生物防腐作用[1-2]。在食品行業中,由于乳酸菌分泌的次級代謝產物具有提高食品口感、增強營養、延長保質期等優點,所以食品生物防腐方面具有至關重要的作用[3]。隨著食品安全問題的日益激化,乳酸菌的研究和應用越來越受關注,希望盡快將乳酸菌應用于生物防腐領域,使其不但能解決因食源性病原菌污染食品導致的疾病爆發,同時也能提高食品的營養價值。
干酪乳桿菌(Lactobacilluscasei)屬于乳桿菌屬(Lactobacilluas),可發酵產生有機酸、細菌素等多種抑菌物質。干酪乳桿菌能夠抑制和殺死食品中的許多腐敗菌及致病菌,可以改善食品特性,不影響食物性狀,且對食品儲藏過程中的防腐保鮮也有積極作用[4]。目前,有關于干酪乳桿菌產細菌素的分離純化和抑菌效果的研究[5-6],但缺乏對其發酵液中有機酸分離與抑菌活性的報道。本文旨在研究一種干酪乳桿菌發酵液中有機酸的有效分離方法,并研究其抑菌活性,為將干酪乳桿菌及其代謝產物開發為新型生物防腐劑提供依據。
1 材料與方法
1.1 材料與儀器
干酪乳桿菌AS02菌株 為本實驗室從云南傳統發酵豆豉中篩選得到;食源性病原菌大腸桿菌Escherichiacoli(E.coil)O157∶H7菌株、金黃色葡萄球菌Staphylococcusaureus(S.aureus)、單核細胞增生李斯特菌Listeriamonocytogenes(L.monocytogenes) 為實驗室保藏菌株;胰蛋白胨(優級純)、酵母膏(分析純)、牛肉膏(99.5%)、吐溫-80(100%) 英國OXOID;甲醇(99.9%)、乙腈(99%) 美國Merck;乳酸(99%)、苯乳酸(99%)、檸檬酸(99%)、乙酸(99%) 德國Sigma;其他化學試劑 均為國產分析純。
MRS肉湯培養基、BHI液體培養基、LB液體培養基 根據文獻[7-8]方法配制,MRS瓊脂培養基添加1.5%瓊脂,LB軟瓊脂培養基和BHI軟瓊脂培養基添加0.75%瓊脂。
GHP-9160恒溫培養箱 上海一恒科學儀器有限公司;SW-CJ-1B超凈工作臺 蘇凈安泰公司;ZWY-111C恒溫搖床 上海智誠分析儀器有限公司;3-18K高速離心機 SIGMA;YP1002N電子天平 上海恒平科學儀器有限公司;SX700高壓滅菌鍋 日本TOMY;Ultrospec 2100 pro紫外分光光度計 Amersham Biosciences;AS-600微量pH計 日本株式會社。
1.2 實驗方法
1.2.1 干酪乳桿菌AS02菌株生長曲線及pH動態監測 使用MRS液體培養基將干酪乳桿菌AS02活化后,按1×109CFU/mL接種于MRS培養基中,置于37 ℃靜止培養72 h,每隔2 h取一次樣,在2863×g[9]、4 ℃離心10 min,得到上清和菌體。隨后用0.9%生理鹽水對菌體進行適當稀釋,用紫外分光光度計測定其在600 nm處的吸光度,用麥氏比濁法估算其菌落數,利用pH計測定并分析培養上清液的pH變化[9]。
1.2.2 干酪乳桿菌AS02菌株發酵液的制備 將活化好的干酪乳桿菌AS02菌株按1×109CFU/mL接種于MRS液體培養基,置于37 ℃靜止培養,每隔2 h取1 mL菌液離心(2863×g,4 ℃,10 min),取樣至72 h,2863×g,4 ℃離心10 min,取其上清,然后使用0.45 μm超濾膜將其過濾滅菌,并放置于4 ℃備用[10]。
1.2.3 干酪乳桿菌AS02發酵液抑菌活性的動態監測 采用agar well diffusion(打孔)法[11],將活化的E.coliO157∶H7菌株添加至20 mL LB軟瓊脂培養基中,S.aureus和L.monocytogenes分別添加至20 mL BHI軟瓊脂培養基中,病原指示菌的接種濃度均為106CFU/mL,用直徑為7 mm的打孔器在凝固的培養基中打孔,隨后分別取300 μL AS02菌株培養上清過濾液,添加至培養基孔內,對照組為等量的MRS液體培養基,37 ℃靜置培養16 h,測定抑菌圈直徑,每個實驗組設3個平行。
1.2.4 干酪乳桿菌AS02菌株發酵液中有機酸的分離 使用MRS液體培養基將干酪乳桿菌AS02活化后,按1×109CFU/mL接種于MRS液體培養基中,置于37 ℃靜止培養48 h,于4 ℃、2863×g離心30 min,棄去菌體沉淀,得到培養上清液,取上清加入蛋白酶K(0.5 μg/mL),30 ℃溫育4 h,再通過0.45 μm超濾膜超濾,超濾后得到的上清液用等體積的乙酸乙酯萃取3次,萃取后得到上層乙酸乙酯相、中間層白色絮狀沉淀相和下層水相,對上層乙酸乙酯相在40~45 ℃,120 r/min條件下進行旋蒸濃縮,對中間層白色絮狀沉淀相在 35~40 ℃、120 r/min條件下進行旋蒸濃縮;對下層水相在60~65 ℃,120 r/min條件下進行旋蒸濃縮,以上均按照10倍體積濃縮,濃縮后得到乙酸乙酯相旋蒸相、乙酸乙酯相旋蒸余相、中間相旋蒸相、中間相旋蒸余相、水相旋蒸相和水相旋蒸余相,濃縮后的各相液體置于4 ℃保存[12]。
1.2.5 干酪乳桿菌AS02菌株發酵液各萃取相抑菌活性物質抑菌試驗 采用spot-on-lawn[13]改進法對濃縮后的各相進行抑菌試驗;spot-on-lawn改進法的優點是為其提供固相支持物,充分考慮抑菌因子分泌的細胞群體感應效應,并能更加真實地模擬發酵環境,具體步驟如下:吸取5 μL各相,分別滴加于含有106CFU/mL指示菌的25 mL且含0.75%凝膠瓊脂固體平板(E.coliO157∶H7采用LB凝膠瓊脂固體平板,S.aureus和L.monocytogenes采用BHI凝膠瓊脂固體平板)中,將平板先置于4 ℃冰箱中,使各抑菌相均勻擴散2 h后,再倒置放入30 ℃的培養箱中,培養20 h(培養基及培養溫度以指示菌而定),后觀察有無抑菌圈,并測定抑菌圈直徑。
1.2.6 干酪乳桿菌AS02菌株發酵液乙酸乙酯相旋蒸余相中有機酸組成分析 運用HPLC對干酪乳桿菌AS02菌株發酵液乙酸乙酯相旋蒸余相的有機酸組成進行分析,進樣量為300 μL,HPLC色譜分析條件為:Waters T3 C18色譜柱(4.6 mm×250 mm,5 μm);流動相:0.03 mol/L NH4H2PO4(pH2.45)∶甲醇(95∶5,v/v);進樣體積:10 μL;流速:0.8 mL/min;檢測波長:210 nm;柱溫:30 ℃。
1.2.7 抑菌物質對食源性病原菌細胞形態的影響 取干酪乳桿菌AS02菌株發酵液乙酸乙酯相旋蒸余相200 μL添加至培養3 h且已接種1×109CFU/mLE.coliO157∶H7的LB培養基和S.aureus的BHI培養基中,30 ℃,200 r/min搖床培養15 h,采用添加200 μL生理鹽水于培養3 h,且接種1×109CFU/mLE.coliO157∶H7的LB培養基和S.aureus的BHI培養基做陽性對照。4 ℃,2863×g離心10 min取沉淀,用0.75%生理鹽水洗脫菌體2次,然后用固定液將菌體固定于1.5 mL離心管中,送電鏡室掃描菌體表面結構和透射電鏡觀察病原指示菌的細胞形態與內部構造。
1.2 數據處理
本實驗做3個平行,干酪乳桿菌AS02菌株生長曲線、pH動態監測,干酪乳桿菌AS02菌株發酵液的抑菌動態監測數據使用圖進行表示,干酪乳桿菌AS02菌株發酵液各萃取相活性物質的抑菌活性數據使用表進行表示。本實驗使用Excel軟件進行作圖。
2 結果與分析
2.1 干酪乳桿菌AS02菌株生長曲線、pH動態監測
干酪乳桿菌AS02菌株在發酵6 h后進入指數生長期,26 h后進入穩定生長期,培養40 h后,菌落數開始有下降趨勢,但總體變化不大,保持穩定趨勢。該菌株發酵液的pH在培養6 h后急劇下降,在培養26 h時,pH降至最低值3.6,隨著發酵延續,pH基本保持穩定,見圖1。通過檢測干酪乳桿菌AS02菌株維持較高濃度以及較低pH的時間,為后續抑菌實驗時間提供依據。

圖1 干酪乳桿菌AS02菌株的生長與pH動態監測Fig.1 The dynamic monitoring of growth and pH of Lb. casei AS02 strain
2.2 干酪乳桿菌AS02菌株發酵液的抑菌動態監測
干酪乳桿菌AS02菌株發酵液對EscherichiacoliO157∶H7、Staphylococcusaureus和Listeriamonocytogenes具有不同的抑菌效果。該菌株在培養6 h后,能對EscherichiacoliO157∶H7發揮抑菌作用,培養28 h時,抑菌效果最強,抑菌圈直徑可高達32 mm;而該菌在培養10 h后,才開始顯示對Listeriamonocytogenes的抑制作用,培養42 h時抑菌效果最強,其抑菌圈直徑達到20 mm;在培養14 h后開始對Staphylococcusaureus起到抑制作用,培養36 h時抑菌效果最強,抑菌圈直徑達到17 mm,見圖2。由此表明,干酪乳桿菌AS02菌株發酵液對EscherichiacoliO157∶H7、Staphylococcusaureus和Listeriamonocytogenes均有較好的抑菌活性。

圖2 干酪乳桿菌AS02菌株發酵液的抗食源性病原菌的動態監測結果Fig.2 The inhibition ratio of fermentation of Lb. caseiAS02 strain against foodborne-pathogens
2.3 干酪乳桿菌AS02菌株發酵液各萃取相活性物質的抑菌活性
對用蛋白酶K處理的干酪乳桿菌AS02發酵液用乙酸乙酯萃取后濃縮,以E.coliO157∶H7,S.aureus和L.monocytogenes作為病原指示菌,利用spot-on-lawn改進法對濃縮后的各萃取相進行抑菌試驗。表1結果表明,該干酪乳桿菌的乙酸乙酯相旋蒸余相對三種食源性病原菌均呈現很好的抑菌效果,它抑制E.coliO157∶H7和L.monocytogenes的生長最為明顯,抑菌圈直徑分別達到20.00、21.67 mm。水相旋蒸余相也顯示出抑菌效果,表明該相中也含有相應的抑菌活性物質,這是因為乙酸乙酯屬于低極性有機溶劑,不同極性的抑菌物質可能不完全溶于該溶劑中。
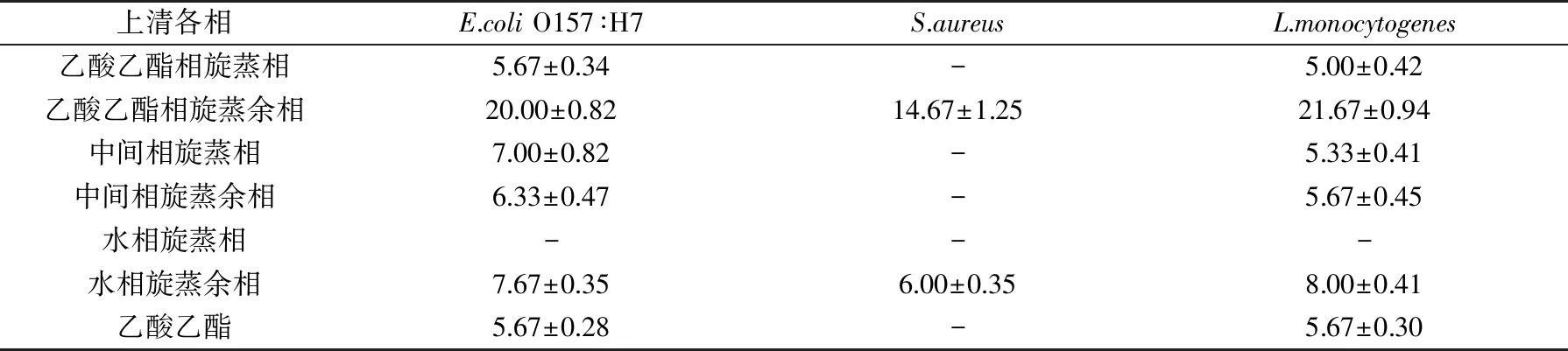
表1 干酪乳桿菌AS02萃取相對食源性病原菌的抑菌效果(mm)Table 1 The anti food-borne pathogens effect of extraction phase of Lb.casei AS02(mm)
2.4 干酪乳桿菌AS02菌株發酵液乙酸乙酯相旋蒸余相抑菌物質的組成分析
因乙酸乙酯相旋蒸余相對三種食源性病原菌均呈現很好的抑菌效果,故使用HPLC對其成分進行分析。由表2可知,乙酸乙酯相旋蒸余相中主要有機酸成分為乳酸、乙酸和苯乳酸,丙酸、蘋果酸和檸檬酸的含量較少。劉冬梅等[14]利用HPLC對Lactobacillusrhamnosus所產生的抑菌物質進行分析,發現乳酸是主要的抑菌物質。張忠華等[15]建立了LactobacillusparaplantarumAY01發酵液中抑菌物質苯乳酸高效液相色譜法快速檢測方法。另據報道,不同弱酸混合使用可強化抑菌作用,如乳酸和乙酸混合作用的抑菌能力大于等量的2種酸單獨作用[16]。李潔等[9]利用HPLC對乳酸片球菌發酵液進行抑菌物質分析,發現主要抑菌物質為有機酸,包括乳酸、蘋果酸、檸檬酸、丙酸和乙酸。

表2 干酪乳桿菌AS02菌株培養液乙酸乙酯相旋蒸余相有機酸組分含量Table 2 The content of organic acid components of ethyl acetate phase derived from Lb. casei AS02 strain
2.5 抑菌物質對食源性病原菌生長狀態的影響
通過掃描電鏡對E.coliO157∶H7與S.aureus菌體表面進行觀察發現,實驗組和對照組中病原菌菌體表面有明顯的差異性,正常生長狀態的病原菌菌體表面光滑、無空洞現象;經抑菌物質處理后的病原菌菌體表面有黏絲狀物質出現,菌體表面有褶皺并伴隨有空洞,如圖3。
通過透射電鏡對E.coliO157∶H7與S.aureus菌體細胞結構進行觀察發現,正常生長的病原菌菌體細胞膜與細胞壁結構均勻、完整;經抑菌物質處理后的病原菌菌體細胞壁向內折疊,細胞膜與細胞壁之間空間增加,滲透能力增強,內壁濃縮并擠壓細胞內溶物,致使細胞壁出現裂口,內溶物流出致死,如圖3,結果表明,有機酸對病原菌的作用機理與已報到的一致[17-18]。

圖3 電鏡分析干酪乳桿菌AS02菌株發酵液抑菌物質處理后的食源性病原菌Fig.3 Electron microscope analysis of pathogenic bacteria which were treatmented with antibacterial substances of Lb. casei AS02 注:A1:E. coli O157∶H7對照組(掃描電鏡,8000×);A2:E. coli O157∶H7實驗組(掃描電鏡,8000×);A3:E. coli O157∶H7對照組(透射電鏡,50000×);A4:E. coli O157∶H7實驗組(透射電鏡,50000×);B1:S.aureus對照組(掃描電鏡,250000×);B2:S.aureus實驗組(掃描電鏡,250000×);B3:S.aureus對照組(透射電鏡,50000×);B4:S.aureus實驗組(透射電鏡,50000×)。
3 討論與結論
本研究對干酪乳桿菌AS02菌株進行生長曲線和pH動態監測,在發酵6 h后進入指數生長期,26 h后進入穩定生長期,培養40 h后,菌落數開始有下降趨勢。該菌株發酵液的pH在培養6 h后急劇下降,在26 h時,pH降至最低值3.6,隨著發酵延續,pH基本保持穩定。該菌株在培養6 h后,能對大腸桿菌O157∶H7發揮抑菌作用,證明干酪乳桿菌AS02菌株在培養6 h后開始大量產生有機酸。徐靜等[19]研究表明,篩選的2株干酪乳桿菌在開始培養時菌體密度增加迅速,大約在14 h左右達到最大,pH隨著培養時間的延長而逐漸降低,24 h后pH降至4左右。Rathore等[20]研究表明,植物乳桿菌NCIMB 8826在發酵6 h后生長達到穩定期,24 h后細胞濃度開始下降,pH在前4 h迅速降低,隨后降低速度減緩,24 h后,pH降至最低值3.5,達到穩定狀態。
干酪乳桿菌AS02發酵液對大腸桿菌O157∶H7、金黃色葡萄球菌和單核細胞增生李斯特菌三種食源性致病菌均呈現很好的抑菌效果。而Palacios等[6]報道的Lb.casei705的代謝產物僅對L.monocytogenes具有抑菌作用。雷霞等[5]對篩選的兩株干酪乳桿菌的發酵液進行抑菌實驗,表明兩株菌除能有效地抑制革蘭氏陽性菌枯草桿菌、單核增生李斯特菌外,還可抑制革蘭氏陰性的大腸桿菌K88,但不能抑制大腸桿菌O157。Corsetti等[21]報道的Lb.sanfranciscoCB1產生的代謝產物可抑制多種革蘭氏陰性菌和革蘭氏陽性菌。表明干酪乳桿菌AS02發酵液抑菌物質具有較廣泛的抑菌效果。
在乳酸菌代謝產物抑菌物質分離純化中,一般使用硫酸銨沉淀法[22-26]、超濾法、疏水層析、離子交換色譜、高效液相色譜和凝膠色譜法,雖然方法簡單易行,但只能分離蛋白質類細菌素。本研究首次使用乙酸乙酯法萃取發酵液中的有機酸,方法簡單。通過HPLC分析,主要的有機酸為乳酸、乙酸和苯乳酸,而丙酸、蘋果酸和檸檬酸的含量較少。對萃取液進行抑菌實驗表明,抑制E.coliO157∶H7和L.monocytogenes的生長最為明顯,抑制S.aureus較為明顯。近年來發現乳酸菌分泌產生一種新型生物防腐劑苯乳酸,能夠抑制多種引起食物腐敗的革蘭氏陽性菌和革蘭氏陰性菌[27]。Dieuleveux[28]發現G.candidum發酵液對L.monocytogenes具有很強的抑菌作用,經超濾、離心分離色譜、薄層色譜、凝膠過濾,確定苯乳酸是主要的抑菌物質。袁景環等[17]研究發現,苯乳酸能有效抑制革蘭氏陰性菌、革蘭氏陽性菌和真菌的生長,對熒光假單胞菌和金黃色葡萄球菌有殺滅作用,并具有一定的溶菌性。李潔等人[9]利用HPLC對乳酸片球菌發酵液進行抑菌物質分析,發現主要抑菌物質為有機酸,包括乳酸、蘋果酸、檸檬酸、丙酸和乙酸,對大腸桿菌O157∶H7的抑制活性高于金黃色葡萄球菌YM2-3。
用萃取的有機物分別抑制E.coliO157∶H7和S.aureus,掃描電鏡觀察發現病原菌菌體表面有黏絲狀物質出現,菌體表面有褶皺并伴隨有空洞;透射電鏡觀察發現病原菌菌體細胞壁向內折疊,細胞膜與細胞壁之間空間增加,滲透能力增強,內壁濃縮并擠壓細胞內溶物,致使細胞壁出現裂口,內溶物流出致死。袁景環等[17]研究了苯乳酸對金黃色葡萄球菌的作用機理,表明苯乳酸作用后指示菌嚴重變形,部分細胞壁破壞,細胞結構破壞,細胞質流出。Crist等[29]認為乳酸和乙酸可以酸化細胞質,引起質子動力受到阻礙,細胞新陳代謝迅速降低,使細菌生長緩慢甚至死亡。Roe等[18]研究發現,乙酸能導致細菌胞內蛋氨酸合成受阻,使細菌生長受阻。
本研究表明,對用蛋白酶K處理的干酪乳桿菌AS02發酵液用乙酸乙酯萃取,乙酸乙酯相旋蒸余相對大腸桿菌O157∶H7、金黃色葡萄球菌和單核細胞增生李斯特菌三種食源性致病菌均呈現很好的抑菌效果,抑制E.coliO157∶H7和L.monocytogenes的生長最為明顯,分別達到20.00、21.67 mm。對乙酸乙酯相旋蒸余相使用HPLC進行分析表明,主要有機酸成分為乳酸、乙酸和苯乳酸,丙酸、蘋果酸和檸檬酸的含量較少。乙酸乙酯萃取法簡單高效,為研究乳酸菌抑菌物質提供了一種新手段。乳酸菌在生物防腐中起著重要作用,隨著食品安全問題日益受重視,希望通過生物工程技術,將其早日應用于生物防腐領域。

