圍術期長期血糖控制對糖尿病SD大鼠術后傷口愈合的對比研究
向川,蔡龍,梁智勇,李帥杰
(山西醫(yī)科大學第二醫(yī)院骨科,山西 太原 030001)
糖尿病(Diabetes mellitus,DM)是一種因胰島素分泌相對或絕對不足或靶細胞對胰島素敏感性降低引起的以糖代謝紊亂為主,嚴重威脅人類健康的代謝障礙性疾病。據(jù)統(tǒng)計,目前全球約有2.85億DM患者,預計2030年將達到4.39億人[1]。在DM的諸多并發(fā)癥中,傷口愈合能力受損是其中的一個典型并發(fā)癥。如果傷口愈合不良或遷延不愈,則可能會出現(xiàn)致殘,嚴重影響患者的生活質量[2]。目前臨床中針對DM患者傷口不愈合的治療方法有很多,且獲得了較好的療效。但臨床工作中發(fā)現(xiàn)DM患者圍手術期圍術期內控制血糖水平后,術后仍出現(xiàn)一部分傷口愈合不良的現(xiàn)象。這可能是因長期的高血糖引起機體血管損傷,從而引起組織缺氧缺血,特別是微血管損傷[3-5]。因此,為提高DM病人的生活質量,血糖水平對術后傷口愈合的影響及其預防已成為如今探討的焦點和亟需解決的問題。
傷口愈合過程是一個多分子、多細胞共同參與、彼此間相互協(xié)調的復雜且精細的過程,正常的傷口愈合由四階段組成(凝血期、炎癥期、增生期、修復期),它們連續(xù)發(fā)生并又相互交錯,沒有明顯界線[6]。現(xiàn)已有許多研究證明,DM傷口愈合中的重要特征是炎癥反應的紊亂以及促炎因子的大量釋放和促傷口愈合因子的減少,最終致使傷口遷延不愈。炎癥分子會受到血糖的調節(jié),白介素-6(interleukin,IL-6)和腫瘤壞死因子α(tumor necrosis factor α,TNF-α)能夠明顯抑制傷口愈合,主要由巨噬細胞產生,高血糖癥能夠增加炎癥介質的釋放,從而抑制膠原沉積和形成,并誘導大量成纖維細胞凋亡,最終使傷口難以愈合[7-8]。
如今,血糖過高容易引起各種并發(fā)癥已達成共識,中華麻醉學分會指南指出,圍術期血糖降低到一定水平,可以有效降低手術及麻醉風險[9]。但也有研究者發(fā)現(xiàn),雖然圍術期降低血糖水平能夠有效降低傷口感染和不愈合的發(fā)生率,但臨床工作中仍有部分患者傷口出現(xiàn)不愈合的現(xiàn)象。基于此,探求血糖控制時間對局部傷口的影響具有現(xiàn)實的意義。
1 材料與方法
1.1 動物 2月齡健康雄性SD大鼠,180~200g,由山西醫(yī)科大學實驗動物中心提供。
1.2 主要試劑 鏈脲佐菌素(streptozotocin,STZ)、ELISA試劑盒、兔抗F4/80單克隆抗體和山羊抗TNF-α多克隆抗體、兔抗熱休克蛋白47(heat-shock protein 47,HSP47)多克隆抗體均購自Bioword。其它生化試劑均為進口分裝。
1.3 主要方法
1.3.1 DM大鼠傷口模型建立 2月齡健康雄性SD大鼠適應性喂養(yǎng)2周禁食(不禁水)16 h后,一次性腹腔注射STZ進行造模,劑量60 mg/kg。STZ臨用前用pH值為4.4、濃度為0.1 mmol/L的檸檬酸緩沖液配成2%STZ溶液。0.1 mol/L檸檬酸緩沖液調配:檸檬酸2.1 g、雙蒸水100 mL、檸檬酸鈉2.94 g、雙蒸水100 mL,檸檬酸與檸檬酸鈉溶液按1.3︰1比例混合均勻,用NaOH調pH值至4.4,高溫高壓滅菌,4℃冷藏備用。注射STZ 72 h后,尾靜脈取血,隨機血糖≥16.7 mmol/L確認為DM大鼠動物模型。穩(wěn)定4周喂養(yǎng)后根據(jù)實驗分組情況造模。以1.5%戊巴比妥鈉(45 mL/kg)腹腔注射麻醉,15 min后將大鼠麻醉后俯臥于手術板上,四肢固定,背部剃毛,75%酒精常規(guī)消毒;用打孔器在大鼠背部鎖骨下0.5 cm的背中線兩側分別打一圓孔,深達皮下筋膜層,直徑0.5 cm。手術完畢后輔料敷貼固定。
1.3.2 動物分組 a)對照組A組:正常血糖SD大鼠按上述方法制作傷口模型作為對照,分別于造模后第1天、第3天、第7天、第14天(每個時間段3只)心臟取血并處死大鼠,提取創(chuàng)口樣本。b)實驗組:按上述方法制作DM模型,傷口造模前以及造模后均給予中效胰島素(魚干精蛋白鋅胰島素)皮下注射,4~8 U/d。根據(jù)血糖情況調整用量,每天分1~2次注射,控制隨機血糖在13 mmol/L以下。將實驗組分為B組:術前血糖控制1 d;C組:術前血糖控制3 d;D組:術前血糖控制7 d;E組:術前血糖控制1個月。在相同部位制作相同大小的傷口,分別于相同時點采取標本。
1.3.3 傷口愈合的形態(tài)學分析 a)計算機分析傷口愈合大體圖像,計算創(chuàng)面愈合率。傷口愈合率(%)=(傷口初始面積-傷口形成后第n天的面積)/創(chuàng)面初始面積×100%;b)提取傷口樣本并制作石蠟切片,常規(guī)HE染色,觀察傷口的組織學變化。
1.3.4 ELISA檢測 a)標本的采取、收集和保存:SD大鼠心臟采血,離心1 500 rpm,15 min。取上清液,-80℃保存。b)試劑的準備:從冰箱中取出試劑盒,降至與室溫平衡后使用,自配的緩沖液應用pH計測量校正。蒸餾水或去離子水應為新鮮高質量的。c)加樣:4次加樣步驟(標準品、標本、酶結合物、底物),加樣時注意不要濺出,不產生氣泡,應加于酶標板底部。d)保溫:塑料封貼紙封蓋,水育箱中25℃溫育。e)洗滌:ELISA就是靠洗滌實現(xiàn)分離游離的和結合的酶標記物。通過洗滌以清除殘留在板孔中沒能與固相抗原或抗體結合的物質,以及在反應過程中非特異性地吸附于固相載體的干擾物質。聚苯乙烯等塑料對蛋白質的吸附是普遍性的,而在洗滌時又應把這種非特異性吸附的干擾物質洗滌下來。可以說在ELISA操作中,洗滌是最主要的關鍵技術,應引起操作者的高度重視,操作者應嚴格按要求洗滌。f)顯色和比色:采用酶標比色儀,測定吸光度OD值(A460 nm)。
1.3.5 免疫組織化學染色 a)組織切片進行脫蠟、水化,滴加3% H2O2室溫孵育10 min。b)5%牛血清白蛋白(bovine serum albumin,BSA)封閉1 h。c)滴加兔抗F4/80單抗體(稀釋度1∶100)或兔抗HSP47多抗體(稀釋度1∶400),在保濕盒內4℃孵育過夜;d)PBS洗滌切片,于存在生物素標記的IgG保濕盒內孵育0.5 h;e)滴加SP試劑,保濕盒內孵育1 h;f)DAB顯色,蘇木素復染,脫水、透明、封片。染色過程中陰性對照中的Ⅰ抗體為PBS。g)光學顯微鏡(×400)下每個標本隨機選擇10個損傷區(qū)視野,計算陽性染色細胞數(shù)。
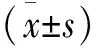
2 結 果
2.1 DM大鼠傷口愈合形態(tài)學分析
2.1.1 傷口愈合率 糖尿病大鼠血糖控制組與正常對照組相比,從傷口造模后的第1天開始,傷口愈合率即出現(xiàn)明顯差異性(40.44% vs 52.89%),且發(fā)現(xiàn)圍術期內血糖控制組的愈合率低于長期血糖控制組;在傷口造模后的第14天,實驗組中圍術期內嚴格控制血糖的DM大鼠創(chuàng)面均未完全愈合,而正常對照組大鼠(A組)和長期血糖控制組大鼠(E組)傷口都已基本完全愈合。且隨著術前血糖控制的時間越長,傷口愈合率會逐漸增加(見圖1)。
2.1.2 組織形態(tài)學觀察 a)正常組SD大鼠:皮膚進行切創(chuàng)造模后,切口愈合的初始階段(第1~3天)即可看到切口已有大量的炎性細胞浸潤,且在切創(chuàng)后的第7天左右,炎性細胞開始減少,但成纖維樣細胞明顯增多,且組織內并可見大量的新生毛細血管,這些結構共同組成新鮮肉芽組織,隨后由于間質細胞增多,逐漸轉變?yōu)轳:劢M織,達到傷口愈合。見圖2。b)圍術期內控制血糖SD大鼠組(即B、C、D組):切創(chuàng)后的SD大鼠,雖然術前血糖得到了短期的控制,但在切口愈合的初始階段,皮膚愈合過程出現(xiàn)了紊亂,炎性細胞浸潤程度明顯低于正常組,但在術后的第5~7天左右,此時的炎性細胞大量浸潤,其內只可見散在的少部分成纖維細胞和新生毛細血管。見圖2。c)長期血糖控制SD大鼠組:由于切創(chuàng)造模前已給予長期的血糖控制,在切口愈合初期,部分炎性細胞浸潤,且于愈合中期階段,炎性細胞浸潤程度較圍術期內控制血糖組有改善,經過長期降糖,切口愈合過程后期有許多成纖維細胞及新生毛細血管生成,共同形成肉芽組織,隨后向瘢痕組織逐漸轉變(見圖2)
2.2 ELISA檢測TNF-α、IL-6水平
2.2.1 ELISA檢測血清中TNF-α含量結果 與正常對照組相比,糖尿病大鼠組于切創(chuàng)造模后切口愈合的初始階段起,血清中TNF-α的水平均明顯增高,表現(xiàn)為高炎癥反應(P<0.05);在術后切口愈合的中期階段,實驗組SD大鼠血清的TNF-α水平均出現(xiàn)下降趨勢,但正常組TNF-α水平開始升高,且相比于圍術期血糖控制組和長期血糖控制組,有明顯差異性(P<0.05);在切口愈合第14天,與圍術期控制血糖組相比,正常組血清中TNF-α水平明顯增高(P<0.05),但和長期血糖控制組比較,差異無統(tǒng)計學意義(P>0.05,見表1)。
2.2.2 ELISA檢測血清中IL-6含量結果 與對照組相比,糖尿病大鼠組于切創(chuàng)造模后切口愈合的整個階段內,血清中IL-6的水平均明顯增高,表現(xiàn)為高炎癥反應;在術后切口愈合的后期階段,切口愈合的第14天,與圍術期控制血糖組相比,正常組血清中IL-6的水平明顯較低(P<0.05),但和長期血糖控制組比較,差異無統(tǒng)計學意義(P>0.05,見表2)。
2.3 傷口愈合過程中巨噬細胞浸潤特點
2.3.1 免疫組化檢測傷口局部巨噬細胞浸潤程度結果 實驗采用F4/80免疫標記巨噬細胞并染色后觀察到,與正常對照組相比,圍術期控制血糖組切口組織愈合初期階段巨噬細胞明顯偏低(P<0.05),在切口愈合的中后期階段,巨噬細胞浸潤明顯增多,表現(xiàn)為一種高炎癥反應(P<0.05)。但與正常對照組相比,長期控制血糖組巨噬細胞浸潤仍有增高傾向,兩者相比差異有統(tǒng)計學意義(P<0.05,見表3)。
2.3.2 檢測成纖維細胞數(shù)量結果 成纖維細胞修復軟組織損傷,與周圍新生毛細血管形成肉芽組織多發(fā)生于傷口愈合的中后期階段,所以本研究中采用HSP47抗體免疫標記成纖維細胞觀察第7天(見圖3)以及第14天發(fā)現(xiàn),與正常對照組相比,圍術期控制血糖組切口組織內成纖維細胞數(shù)量均偏低(P<0.05),但與圍術期控制血糖組相比,長期控制血糖組切口組織內成纖維細胞數(shù)量有所增加(P<0.05),并且與正常組比較差異無統(tǒng)計學意義(P>0.05,見表4)。
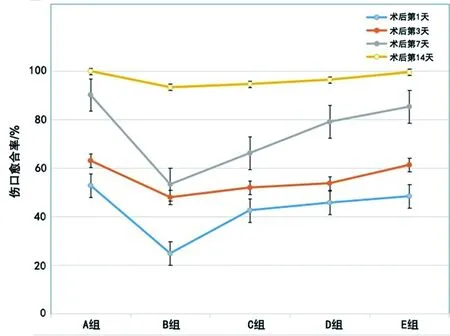
圖1 不同時間段內各組SD大鼠傷口愈合情況

圖2 不同時間段內各組SD大鼠切口皮膚局部組織HE染色情況(×200,比例尺10 μm)
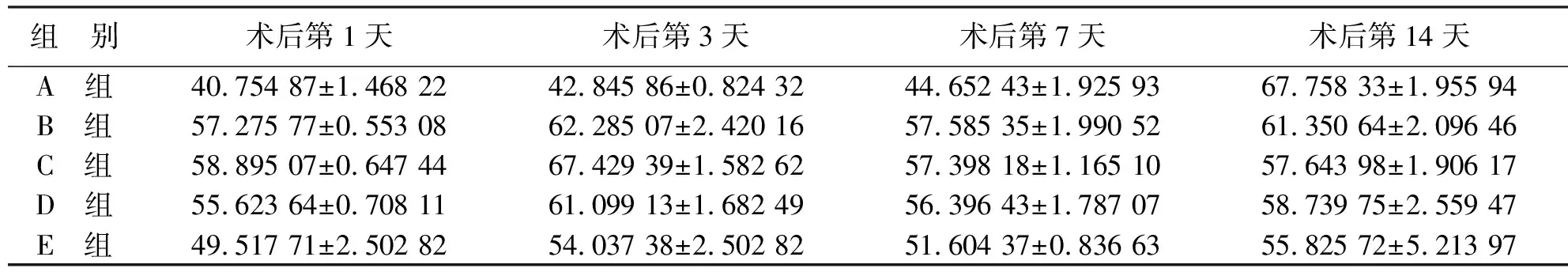
組 別術后第1天術后第3天術后第7天術后第14天A 組40.754 87±1.468 2242.845 86±0.824 3244.652 43±1.925 9367.758 33±1.955 94B 組57.275 77±0.553 0862.285 07±2.420 1657.585 35±1.990 5261.350 64±2.096 46C 組58.895 07±0.647 4467.429 39±1.582 6257.398 18±1.165 1057.643 98±1.906 17D 組55.623 64±0.708 1161.099 13±1.682 4956.396 43±1.787 0758.739 75±2.559 47E 組49.517 71±2.502 8254.037 38±2.502 8251.604 37±0.836 6355.825 72±5.213 97
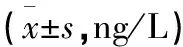
表2 不同時間內各組大鼠血清中IL-6水平比較
表3 各組SD大鼠在傷口愈合不同階段切口局部巨噬細胞浸潤數(shù)量的比較
3 討 論
正常傷口愈合過程中需要適度的炎癥反應來促進膠原蛋白以及肉芽組織的生成,但是DM傷口易出現(xiàn)愈合困難的現(xiàn)象,這可能是因高血糖反應引起的的炎癥反應紊亂所致。傷口愈合過程中局部浸潤的巨噬細胞會釋放許多的促炎細胞因子(TNF-α、IL-6等),啟動傷口修復的進程。巨噬細胞作為清道夫可吞噬、清除細菌和壞死組織,避免感染的發(fā)生[10]。但DM會發(fā)生持續(xù)性炎癥反應,導致促炎因子的過度釋放,抑制傷口愈合。有研究報道稱,DM可以引起TNF-α以及IL-6的分泌增多,從而抑制膠原沉積并誘導成纖維細胞的凋亡,不利于傷口的愈合[8],而系統(tǒng)的降低血糖或TNF-α可顯著促進傷口的愈合[11-12]。
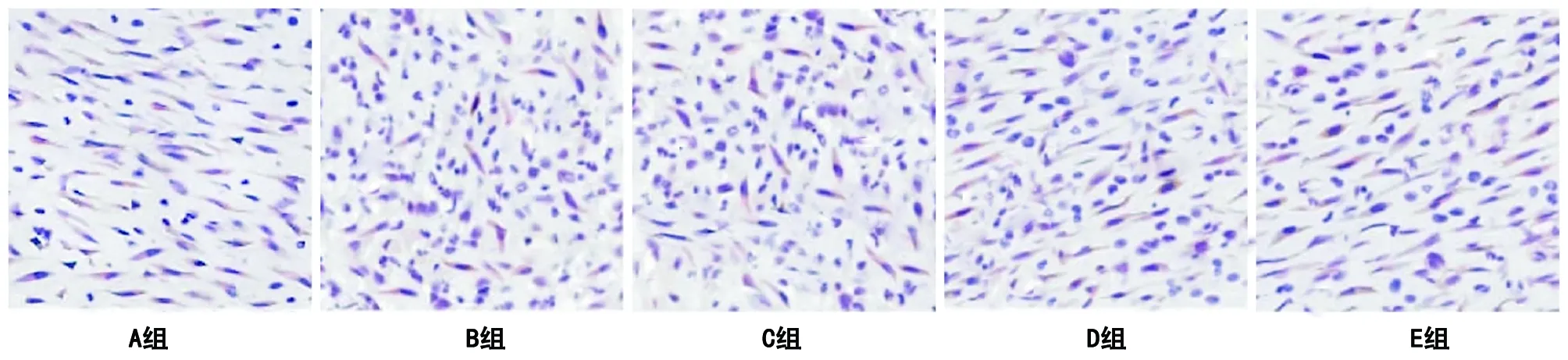
圖3 各組SD大鼠在術后第7天時的切口局部成纖維細胞表現(xiàn)(×400,比例尺20 μm)
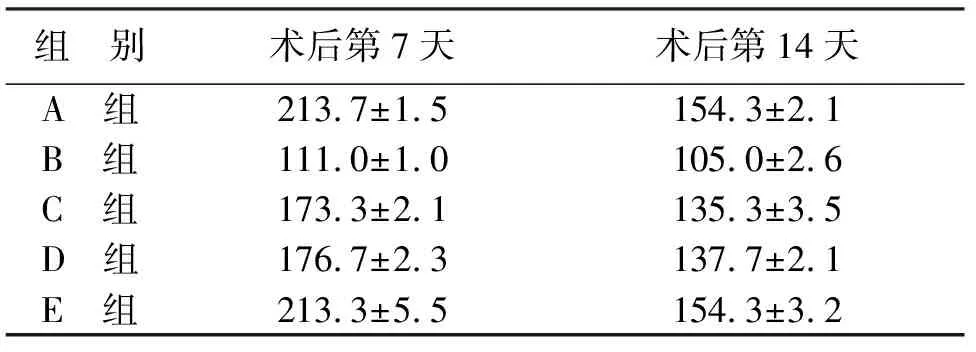
組 別術后第7天術后第14天A 組213.7±1.5154.3±2.1B 組111.0±1.0105.0±2.6C 組173.3±2.1135.3±3.5D 組176.7±2.3137.7±2.1E 組213.3±5.5154.3±3.2
本研究通過與對照組相比較后發(fā)現(xiàn),實驗組中DM大鼠的傷口愈合均出現(xiàn)了延遲,且傷口愈合程度與術前血糖控制時間的長短相關。術前血糖控制時間越長,傷口越易愈合。研究還發(fā)現(xiàn)實驗組在傷口造模后的前期(第1~3天)較對照組局部巨噬細胞浸潤較少,但血清中TNF-α、IL-6的含量很高,表現(xiàn)為高炎癥狀態(tài)。在傷口愈合的中、后期,正常組炎癥因子開始升高,但此時實驗組均出現(xiàn)下降趨勢,此種炎癥反應的紊亂抑制了各階段的傷口愈合過程。實驗組內相比較發(fā)現(xiàn),術前控制血糖時間越長,傷口愈合的前期巨噬細胞和成纖維細胞浸潤發(fā)生時間和數(shù)量越趨近正常組,越有助于傷口的愈合。而且術前血糖控制時間最長的大鼠,血清中TNF-α、IL-6的含量明顯偏低,這可能降低了中期成纖維細胞凋亡的發(fā)生,最終促進傷口的愈合。這說明術前控制血糖時間與傷口愈合呈正相關,此外這這或許還可以說明臨床中為什么DM患者圍術期內經合理的控制血糖后仍有部分患者會出現(xiàn)傷口不愈合或愈合困難的現(xiàn)象,但其具體機制仍待進一步的實驗研究去證實。

