短肽FLPNF對地塞米松誘導的胰島細胞凋亡的保護作用
段睿,焦奧,張城碩,林建貞,石悅,張佳林
(中國醫科大學附屬第一醫院肝膽外科暨器官移植科,沈陽 110001)
糖皮質激素具有抗炎、免疫抑制等多種生理作用[1-2],可用于類風濕性關節炎、系統性紅斑狼瘡、血管炎等疾病的治療[3-5]。臨床應用糖皮質激素一般采用長時間和 (或) 高劑量的全身療法,對胰島β細胞具有一定的毒性作用[6],使其受到損傷,進而發展成為類固醇性糖尿病。這種損傷的程度與糖皮質激素的使用劑量和時間呈正相關。地塞米松(dexamethasone,Dexa)是常用的糖皮質激素藥物,有研究[7-8]發現它可通過多種途徑誘導細胞損傷。前期研究發現,短肽FLPNF對過表達人胰島淀粉樣多肽 (human islet amyloid polypeptide,hIAPP) 的大鼠胰島細胞INS-1具有一定的保護作用。但目前尚未有研究報道FLPNF是否可以對Dexa誘導的胰島β細胞凋亡具有保護作用。本研究擬探討短肽FLPNF對Dexa誘導的胰島β細胞凋亡的影響,為進一步研究FLPNF對類固醇性糖尿病的防治作用提供依據。
1 材料與方法
1.1 試劑與儀器
RPMI1640培養液、胎牛血清、胰蛋白酶、PBS( 北京Hyclone公司) ;Dexa,上海Sigma-Aldrich公司) ;短肽FLPNF,短肽NFGAIL( 上海強耀生物科技有限公司) ;胃饑餓素( Ghrelin,美國Anaspec公司) ;兔抗Bcl-2多克隆抗體、鼠抗Bax多克隆抗體、兔抗c-caspase-3多克隆抗體、鼠抗Glut2多克隆抗體( 武漢Proteintech公司) ;Annexin-V-FITC-PI雙染試劑盒、增強型CCK-8試劑盒、一步法TUNEL細胞凋亡檢測試劑盒、細胞周期與細胞凋亡檢測試劑盒( 上海碧云天生物科技有限公司) ;全自動酶標儀( 瑞士SUNRISERC公司) ;FACSCalibur流式細胞儀( 美國BD公司)。
1.2 方法
1.2.1 細胞培養:大鼠胰島細胞株INS-1( 上海拜力生物科技有限公司) 為我院普外實驗室凍存。將復蘇后的INS-1細胞添加RPMI1640培養基( 10 mmol/L HEPES、2 mmol/L L-谷氨酰胺、1 mmol/L丙酮酸鈉、10 μ mol/L β-巰基乙醇、10%胎牛血清、100 U/mL青霉素及100 μ g/mL鏈霉素)[9]置于37 ℃、5%CO2培養箱中培養。
1.2.2 細胞分組:將細胞隨機分為空白對照組、Dexa組、FLPNF組、FLPNF+Dexa組、Ghrelin對照組、Ghrelin+Dexa對照組、NFGAIL對照組、NFGAIL+Dexa對照組,其中含有Ghrelin的對照組為陽性對照組,含有NFGAIL的對照組為陰性對照組。此分組中,用于處理細胞的Dexa的濃度為100 nmol/L,短肽FLPNF、NFGAIL的濃度為200 μ mol/L,Ghrelin的濃度為100 nmol/L,FLPNF+Dexa組、Ghrelin+Dexa對 照 組、NFGAIL+Dexa對照組分別用FLPNF、Ghrelin、NFGAIL預處理細胞24 h,再添加Dexa。該分組用于方法1.2.3(3)、1.2.4、1.2.5、1.2.6及1.2.7部分。
1.2.3 CCK-8法測定INS-1細胞活力:( 1) 為了探究Dexa與FLPNF的先后添加順序對INS-1細胞活力的影響,取對數生長期細胞,接種至96孔板( 5×103/孔),每個實驗條件設置4個復孔。將細胞分為空白對照( Control) 組、Dexa組、FLPNF組、FLPNF+Dexa組、Dexa 48 h+Control 72 h組、Dexa 48 h+FLPNF 72 h組、Control 72 h+Dexa 48 h組、FLPNF 72 h+Dexa 48 h組,其中FLPNF+Dexa組采用FLPNF與Dexa同時處理細胞的方式添加,其余組按時間順序添加,添加的處理處理因素Dexa的濃度為100 nmol/L,短肽FLPNF、NFGAIL的濃度為200 μ mol/L,Ghrelin的濃度為100 nmol/L。( 2) 為了探究不同濃度FLPNF對INS-1細胞增殖活力的影響,取對數生長期細胞,接種至96孔板(1×104/孔),每個實驗條件設置4個復孔。將細胞分為空白對照( Control) 組、Dexa組、100 μ mol/L FLPNF組、100 μ mol/L FLPNF+Dexa組、200 μ mol/L FLPNF組、200 μ mol/L FLPNF+Dexa組、400 μ mol/L FLPNF組、400 μ mol/L FLPNF+Dexa組,FLPNF+Dexa組用FLPNF預處理24 h,再添加Dexa。( 3) 為檢測FLPNF與其他對照肽類對INS-1細胞活力的影響,取對數生長期細胞,接種至96孔板( 1×104/孔),每個實驗條件設置4個復孔。( 4) 各組細胞經過藥物處理后,在每孔培養基中加入10 μ L CCK-8溶液,于37 ℃培養箱中繼續培養1~1.5 h。待CCK-8孵育結束后,將96孔板放入酶標儀中,測定各孔在450 nm處的吸光度值。
1.2.4 ELISA法檢測葡萄糖刺激胰島素分泌功能:取對數生長期細胞接種于96孔板( 1×104/孔)。將INS-1細胞分為Control組、 Dexa組、 FLPNF組、 FLPNF+Dexa組,Dexa終濃度為100 nmol/L,FLPNF終濃度為200 μ mol/L,FLPNF+Dexa組先用FLPNF預處理24 h后,再添加終濃度為100 nmol/L的Dexa。藥物處理后,以PBS洗滌2次,加入不含葡萄糖的KRBH液100 μL/孔,37 ℃孵育30 min,棄KRBH液,用含有低糖( 1.1 mmol/L)或高糖( 20 mmol/L) 的KRBH液孵育1 h,將各組樣本液體收集至離心管中,3 000r/min離心30 min,收集上清。在96孔板中加入標準品或樣品( 50 μ L/孔),稀釋標準品,制作標準曲線。每孔加入樣品稀釋液40 μ L及樣品10 μ L,空白對照孔加入樣品稀釋液40 μ L及完全培養基10 μ L。用封口膜封閉孔口,置于37 ℃培養箱中孵育30 min。棄除液體并連續洗滌5次后,加入酶標試劑50 μ L/孔,空白對照孔中不加。封口膜封孔后,37 ℃孵育30 min后,連續洗滌5次,每孔加入顯色劑A、B各50 μ L,室溫避光靜置15 min。顯色后終止,用酶標儀測定450 nm處吸光度值。
1.2.5 TUNEL法檢測細胞凋亡:將對數生長期細胞接種至48孔板,進行相應藥物處理( 按1.2.2分組方法處理) 后,PBS洗滌1次。4%多聚甲醛常溫下固定30 min,PBS洗除固定液。加入免疫染色強力通透液1 mL/孔,室溫孵育5 min。將TdT酶與熒光染色液按1︰9混合成標準TUNEL檢測液。孵育后的細胞用PBS洗滌2次,加入標準TUNEL檢測液50 μ L/孔,用封口膜將孔口封閉,37 ℃孵育60 min,PBS洗滌1次。加入DAPI熒光染液100 μ L/孔,37 ℃孵育15 min。PBS洗滌2次,在激光共聚焦顯微鏡下觀察和對比不同藥物作用后的細胞形態和凋亡情況。
1.2.6 Annexin V-FITC/PI法檢測細胞凋亡率:各組INS-1細胞經藥物處理后,用不含EDTA的胰酶消化,計數后將每組細胞數調節至1×105/mL,每組樣品取1 mL細胞懸液,1 000 r/min、4 ℃離心10 min,棄上清。用預冷的PBS洗滌2次。將細胞重懸于195 μ L Annexin V-FITC結合液。每管樣品加入5 μ L Annexin V-FITC、10 μ L碘化丙啶染色液混勻,避光室溫反應15 min,立即用流式細胞儀檢測。
1.2.7 Western blotting檢 測Bcl-2、 Bax、 caspase-3及Glut2蛋白的表達水平:向6孔板中各組細胞加入Western及IP裂解液 (100 μ L/孔,添加1%的苯甲基磺酰氟),裂解30 min后用超聲儀勻漿。BCA法測定總蛋白濃度,煮沸5 min使蛋白變性。蛋白上樣,電泳,轉印至硝酸纖維素膜。5%脫脂牛奶封閉2 h,分別加入一抗 (抗Bcl-2抗體、抗Bax抗體、抗caspase-3抗體1︰500稀釋,抗Glut2抗體1︰1 000稀釋),4 ℃過夜。室溫孵育2 h,TBST洗膜3次,分別加入羊抗鼠二抗、羊抗兔二抗,室溫孵育1 h,TBST洗膜3次。ECL顯色,采用ImageJ 1.8.0軟件對獲取的圖像進行分析。以β-actin為內參。
1.3 統計學分析
采用GraphPad Prism 5軟件進行統計學分析。計量資料用±s表示,方差分析兩兩比較采用LSD法比較。P < 0.05為差異有統計學意義。
2 結果
2.1 FLPNF對Dexa作用下INS-1細胞增殖活力的影響
如圖1A所示,與Dexa組相比,FLPNF+Dexa組的細胞活力明顯增高( P < 0.001),FLPNF 72 h+Dexa 48 h組的細胞活力無明顯變化,Dexa 48 h+FLPNF 72 h組的細胞活力有所增加,差異有統計學意義( P <0.001)。與FLPNF+Dexa組 比 較,Dexa 48 h+FLPNF 72 h組的細胞活力較低,差異有統計學意義( P <0.01),FLPNF 72 h+Dexa 48 h組的細胞活力較FLPNF+Dexa組低,但無統計學差異。如圖1B所示,不同濃度( 100、200、400 μ mol/L) FLPNF對INS-1細 胞 活 力的影響幾乎無差異;與Dexa組相比,FLPNF( 100 μ mol/L) +Dexa組的細胞活力有所增高,但無統計學差異,而FLPNF( 200 μ mol/L) +Dexa組及FLPNF( 400 μ mol/L) +Dexa組的細胞活力均有顯著增高( P < 0.001) ;FLPNF( 200 μ mol/L) +Dexa組與FLPNF( 400 μ mol/L)+Dexa組的細胞活力無顯著差異。表明短肽FLPNF與Dexa共同處理細胞時,FLPNF的保護效果較好,發揮最佳保護作用的濃度為200 μ mol/L。
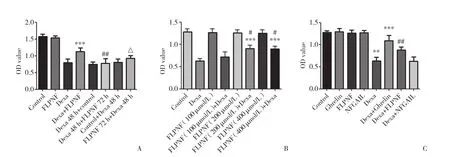
圖1 CCK-8法檢測各組INS-1細胞增殖活力Fig.1 The proliferation viability of INS-1 cells detected by CCK-8
如圖1C所示,與Control組相比,Ghrelin組、FLPNF組及NFGAIL組INS-1細胞增殖活力無明顯變化,Dexa組細胞活力則明顯降低 (P < 0.05)。與Dexa組相比,Dexa+Ghrelin組 (32.1%)、Dexa+FLPNF組 (18.7%) 的細胞活力均有顯著增加 (P < 0.001,P < 0.05),Dexa+NFGAIL組則無顯著變化 (P > 0.05)。經過Dexa處理的INS-1細胞的活力明顯下降,而加入短肽FLPNF和Ghrelin均對Dexa誘導的INS-1細胞活力有顯著改善。
2.2 FLPNF對Dexa誘導的INS-1細胞葡萄糖刺激胰島素分泌功能的影響
如圖2A所示,低糖 (1.1 mmol/L) 條件下,FLPNF組、Dexa組及Dexa+FLPNF組與對照組的胰島素分泌量無顯著差異;在高糖 (20 mmol/L) 刺激下,Dexa組的胰島素分泌量顯著減少,而Dexa+FLPNF組的胰島素分泌量比Dexa組則有較為明顯的增加。如圖2B所示,與對照組相比,FLPNF組的葡萄糖刺激胰島素分泌刺激指數無明顯變化,Dexa組則明顯降低 (P <0.001),Dexa+FLPNF組雖然比對照組有明顯降低,但比Dexa組則有明顯增加 (P < 0.05)。
2.3 短肽FLPNF對Dexa誘導的INS-1細胞凋亡的影響
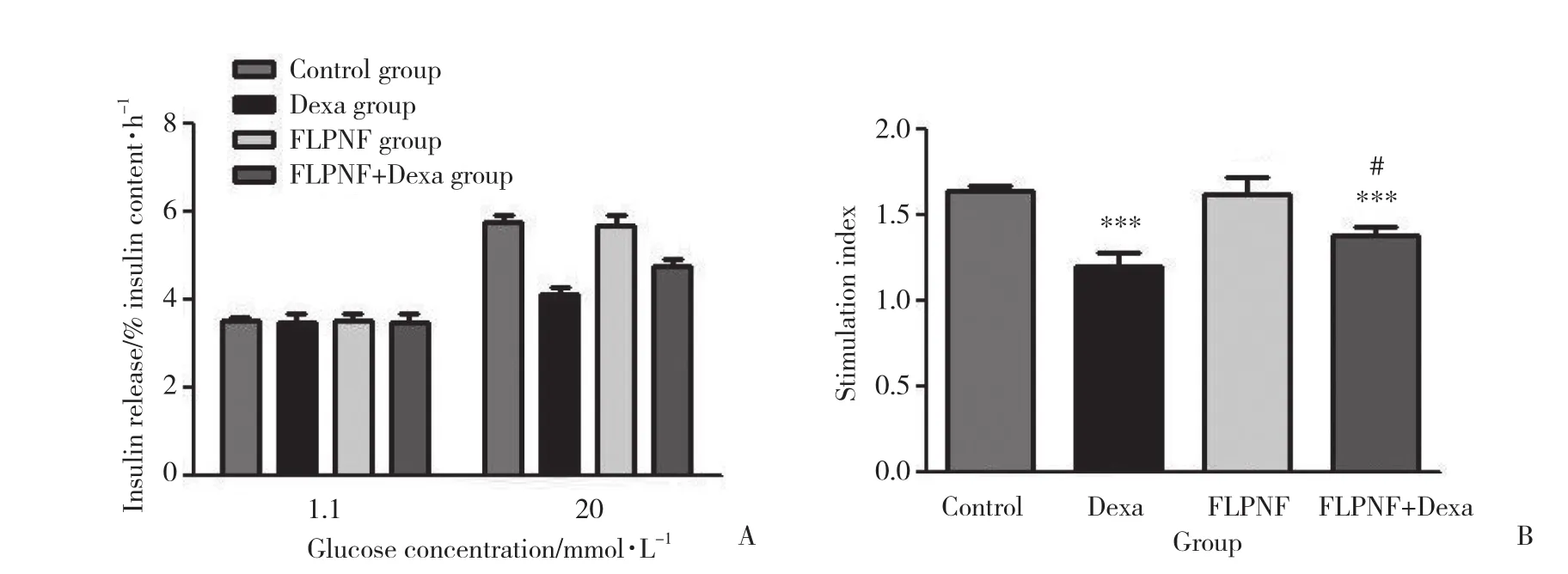
圖2 FLPNF對Dexa培養的INS-1細胞葡萄糖刺激胰島素分泌功能的影響Fig.2 Effect of FLPNF on glucose-stimulated insulin secretion in dexamethasone cultured INS-1 cells
TUNEL法檢測細胞凋亡的結果如圖3所示,空白對照組中較少見到細胞凋亡,相比之下,Dexa組與NFGAIL+Dexa組中細胞凋亡比例最高,兩者無統計學差異;Ghrelin組、FLPNF組與空白對照組無明顯差異,NFGAIL組稍有增加,但無統計學差異 (P >0.05);Ghrelin+Dexa組 及FLPNF+Dexa組 能觀察 到細胞凋亡,但比Dexa組細胞凋亡均有明顯減少 (P <0.001)。
如圖4所示,Annexin V-FITC/PI法檢測細胞凋亡的結果與TUNEL法檢測細胞凋亡的結果基本一致,空白對照組的細胞凋亡率較低,Dexa組和NFGAIL+Dexa組細胞凋亡率明顯升高 (P < 0.001),Ghrelin組、FLPNF組、NFGAIL組與空白對照組無明顯差異 (P > 0.05),Ghrelin+Dexa組及FLPNF+Dexa組的細胞凋亡率比Dexa組有明顯降低 (P < 0.001)。
2.4 短肽FLPNF對Dexa誘導的INS-1細胞Bcl-2、Bax、caspase-3及Glut2蛋白表達的影響
如圖5、6所示,Dexa組的Bcl-2、Glut-2表達水平較Control組顯著降低 (P < 0.05),經過FLPNF短肽處理后,Dexa+FLPNF組的Bcl-2、Glut-2表達明顯升高 (P < 0.05)。相反,Dexa組的Bax、cleaved caspase-3表達水平明顯高于Control組 (P < 0.05),而Dexa+-FLPNF組的Bax、cleaved caspase-3表達較Dexa組則明顯下降 (P < 0.05)。
3 討論
糖皮質激素盡管對炎癥性疾病、自身免疫病等多種疾病的治療與預防具有顯著成效[10-11],但其應用帶來的胰島并發癥不可忽視。Dexa能產生氧自由基,促進胰島細胞凋亡,減弱胰島素的分泌功能[12]。前期研究結果表明,短肽FLPNF具有抗過表達hIAPP的胰島細胞凋亡的作用,這種作用可能與短肽FLPNF與胰島淀粉樣沉淀的直接結合有關,也可能與其本身的促進增殖或抗凋亡作用有關。本研究通過Dexa誘導INS-1細胞凋亡,證明了短肽FLPNF能直接拮抗Dexa誘導的胰島β細胞凋亡。
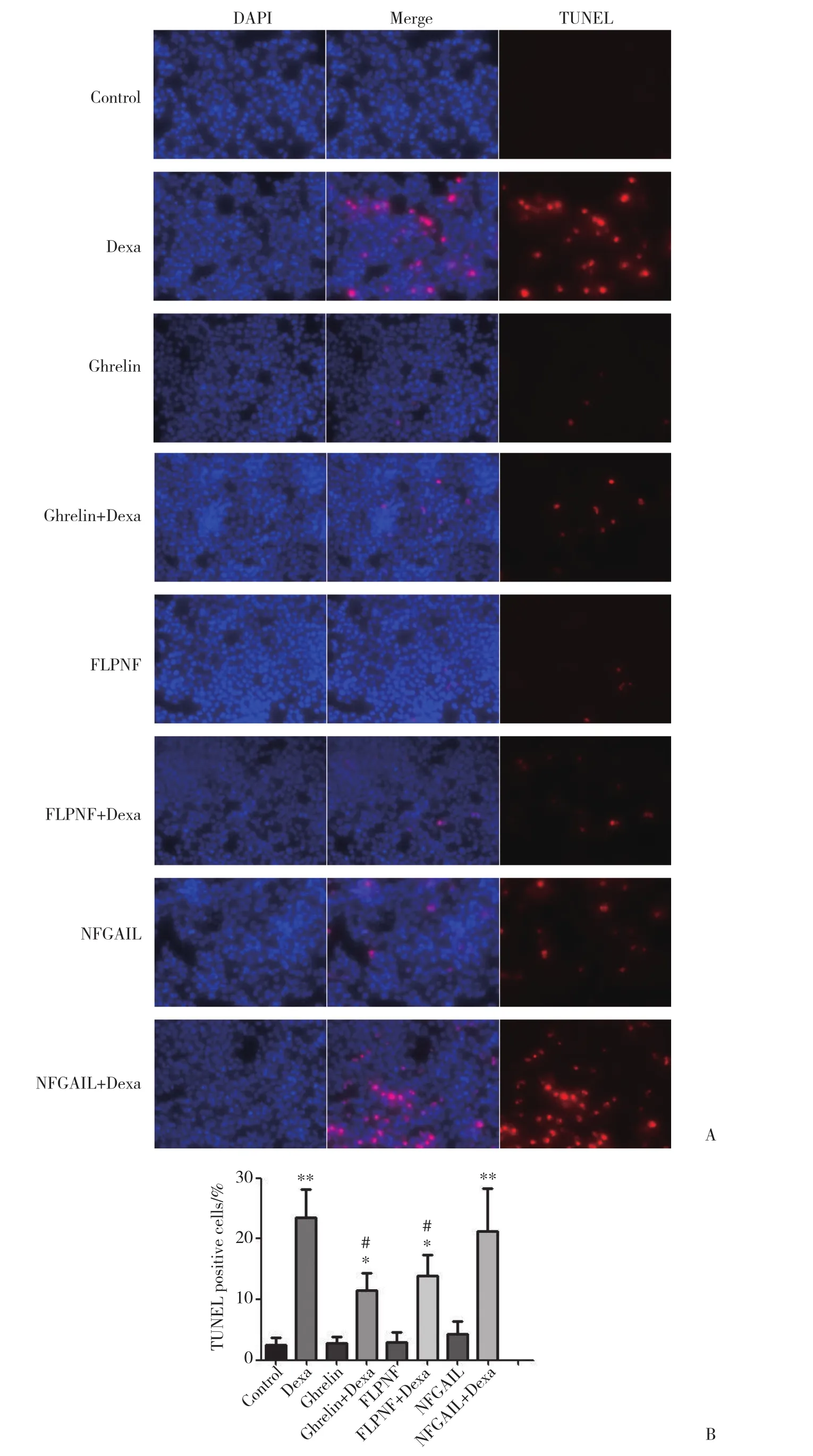
圖3 TUNEL法檢測短肽FLPNF對Dexa誘導的INS-1細胞凋亡的影響Fig.3 Effect of oligopeptide FLPNF on dexamethasone-induced INS-1 cell apoptosis assessed by TUNEL
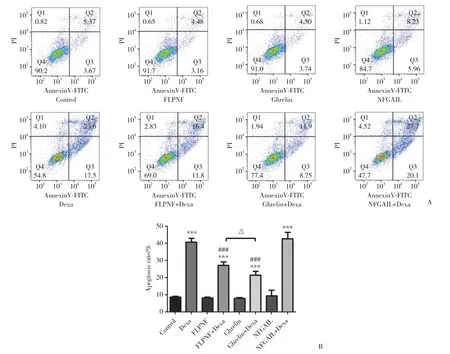
圖4 Annexin V-FITC/PI流式細胞術檢測細胞凋亡Fig.4 Cell apoptosis detected by Annexin V-FITC/PI flow cytometry
INS-1細胞在100 nmol/L Dexa的誘導下出現增殖活力降低,在加入短肽FLPNF后,細胞增殖雖未完全恢復正常,但已有了很大程度的提升。短肽FLPNF對正常增殖狀態的INS-1細胞則無明顯的促增殖作用。相比于正常細胞,短肽FLPNF可能更容易穿過被誘導凋亡的細胞的細胞膜,因此對凋亡的INS-1細胞具有更明顯的作用。關于短肽FLPNF如何保護Dexa培養的INS-1細胞活力的機制,可能是直接發揮促增殖的作用,也可能是通過拮抗凋亡的過程而發揮作用。本研究中,相比于先后使用短肽FLPNF或Dexa處理細胞,短肽FLPNF與Dexa同期處理細胞的方式顯示出更好的保護效果。此外,200 μ mol/L FLPNF能起到較好的保護INS-1細胞活力的作用,而100 μ mol/L FLPNF則不能發揮顯著的保護作用,400 μ mol/L FLPNF的效果與200 μ mol/L FLPNF的保護作用無顯著差異,因此,在后續實驗中采用了200 μ mol/L的濃度作為研究短肽FLPNF的濃度。本研究中,通過與陽性對照肽Ghrelin、陰性對照肽NFGAIL對比發現,短肽FLPNF雖具有一定保護INS-1細胞活力的作用,但其作用較Ghrelin稍差,這可能與其本身的作用較弱有關,也可能與其肽鏈不穩定有關。而相對陰性對照肽NFGAIL,FLPNF則有顯著的保護作用,使胰島細胞活力提升較為明顯。

圖5 Western blotting檢測INS-1細胞Bcl-2、Bax、cleaved caspase-3蛋白表達的變化Fig.5 The protein expression changes of Bcl-2,Bax and cleaved caspase-3 in INS-1 cells detected by Western blotting
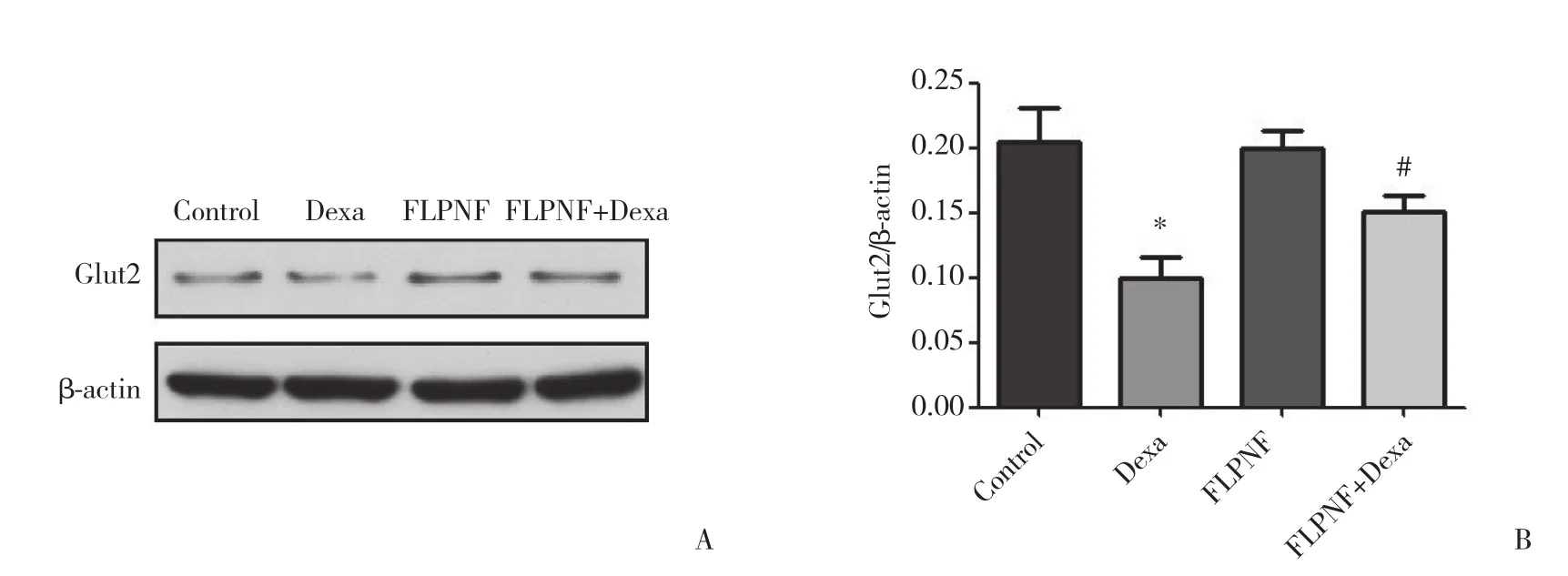
圖6 Western blotting檢測FLPNF對Dexa培養的INS-1細胞Glut2蛋白表達的影響Fig.6 The protein expression change of Glut2 in INS-1 cells detected by Western blotting
Glut是一類存在于細胞膜、負責由細胞外向細胞內轉運葡萄糖的受體,分為Glut1、Glut2、Glut3、Glut4等幾個主要亞型,分布于不同組織器官。嚙齒類動物胰島β細胞上主要表達Glut2,使該細胞對葡萄糖有較為敏感的反應。當葡萄糖濃度升高時,胰島β細胞通過Glut2攝取葡萄糖,觸發動作電位,使胰島素釋放入血液中,進而發揮降低血糖的作用。本研究結果顯示,應用Dexa誘導胰島細胞凋亡的同時,胰島素受葡萄糖刺激引起排泌量減少,可能與Dexa導致Glut2表達下降有關。
胰島細胞功能障礙的最直接表現是其胰島素分泌功能的改變,胰島素分泌方式、分泌量等改變都受胰島細胞完整性的密切影響。胰島素的產生過程是從PPI基因轉錄成PPI mRNA,并在內質網翻譯成胰島素前體物質,形成胰島素原后轉移至高爾基體。當血糖升高,Glut將葡萄糖轉運入胞,刺激胰島β細胞產生動作電位,由胰島素原被切割成胰島素與其他物質,形成分泌顆粒,由胰島β細胞釋放入血,從而發揮胰島素的作用。有研究[13]發現,Dexa可以通過促進Glut2翻譯后降解致Glut2蛋白表達減少,使胰島細胞對葡萄糖刺激的敏感性大幅度下降,導致胰島細胞內的胰島素分泌顆粒不能正常分泌。前期蛋白組學預測發現,FLPNF具有促進Glut2表達的作用。本研究通過測定Dexa誘導INS-1細胞凋亡的狀態下葡萄糖刺激胰島素的釋放量,證明FLPNF顯著改善了Dexa培養的INS-1細胞的葡萄糖刺激胰島素釋放功能。
通過TUNEL法可以觀察到INS-1細胞經不同藥物處理后的細胞核形態及凋亡情況,而通過Annexin V-FITC/PI雙染法則從凋亡率更具體地表現出不同藥物處理后細胞的凋亡數目差異。本研究結果顯示,用Dexa處理的INS-1細胞的凋亡細胞密度和凋亡率都有顯著升高,而使用短肽FLPNF處理的細胞凋亡水平則有了明顯的降低。
Dexa可通過多種途徑導致胰島β細胞凋亡及功能障礙。Bcl-2家族蛋白在凋亡通路中具有至關重要的作用,其中以Bcl-2與Bax蛋白的比例最為重要。Bcl-2是Bcl蛋白家族中的抗凋亡蛋白,Bax則是促凋亡蛋白,Bcl-2蛋白減少、Bax蛋白增加是凋亡通路的重要起始因素。隨著Bcl-2/Bax的比例下降,線粒體膜的通透性逐漸增加,使線粒體內的物質如細胞色素c外流,進一步促進細胞凋亡的進展,導致caspase-3的升高。Dexa可通過降低Bcl-2/Bax的比例,促進線粒體通路細胞凋亡的發生[8]。本研究中,短肽FLPNF可拮抗Dexa的線粒體通路,使Bcl-2蛋白的表達明顯升高,Bax蛋白的表達明顯降低,抑制了線粒體通路的啟動。
綜上所述,本研究以大鼠胰島素瘤INS-1細胞為研究對象,證實了短肽FLPNF能抑制Dexa誘導的胰島細胞凋亡,促進其增殖,并改善胰島細胞的葡萄糖刺激胰島素分泌功能。本研究從細胞層面探討和證明了FLPNF的抗凋亡作用,可能對臨床應用糖皮質激素所產生的胰島損傷的預防和治療具有一定的臨床意義。

