生物傳感細胞ADP1_pWHlux表征水中污染物急性毒性的實驗設計
張 凱, 陳 健, 賈建麗
(1. 中國礦業大學(北京) 化學與環境工程學院, 北京 100083;2. 中國礦業大學(北京) 地球科學預測繪工程學院, 北京 100083)
人類向環境排放的大量污染物長期在水環境中暴露和積累,其中不乏具有急性毒性的物質[1-4]。目前國際公認的對水中急性毒性的生物測定方法主要是通過藻類(大型藻)及淡水魚(斑馬魚)兩類標準生物法,但是操作過程復雜、漫長,難以廣泛應用。近年來,通過基因工程改造而構建的生物傳感細胞在檢測水環境的急性毒性物質應用越來越引起研究人員的興趣[5-6]。毒性物質通過阻礙細菌新陳代謝,進而抑制發光基因的表達,因此可通過細菌的發光強度測定水環境中急性毒性物質[7]。生物傳感細胞檢測水環境中急性毒性物質較傳統方法具有響應速度快,操作步驟簡單,靈敏度高,成本低等優點[8]。
當前,國內高校本科生環境監測、環境生物學等教學實驗普遍是以污染物定量測定為主的經典國標法理化表征實驗,實驗內容比較陳舊,很難激發學生對實驗課的興趣,因此有必要設置一些學科前沿的實驗課程[9-11]。利用發光菌毒性快速檢測水體污染物的實驗探索[12],重金屬Zn、Cu和Hg對重組發光細菌的影響[13],重組發光細菌應用于重金屬檢測技術研究[14],BODIPY基熒光探針對銅離子檢測[15]等實驗雖然開展豐富了環境科學與環境工程學科的實驗教學內容,但也存在一些如實驗成本過高、實驗步驟繁瑣等不利于推廣的問題。本實驗采用的原料均廉價易得,實驗用材料可自行培養獲得,對實驗條件要求不高,便于推廣。因此,期望本實驗的開展能夠為環境科學與環境工程學科專業實驗有所助益。
1 實驗材料與設備
實驗材料:急性毒性檢測的生物傳感細胞(ADP1_pWHlux),HgCl2溶液,無菌去離子水。
主要設備:棕色瓶、移液器、酶標儀LB 962(Berthold,USA)與黑色底透96孔酶標板(Grenier,Germany)配合使用,計時器。
2 實驗前準備
2.1 ADP1_pWHlux的培養
(1) 含200 μg/mL 氨芐青霉素的LBA(LBA_ amp200)固體培養基用于培養并保存ADP1_pWHlux菌株,平板培養皿保存溫度4 °C,保存時間1個月,超過1個月要重新接種。使用時從平板培養皿中挑取ADP1_pWHlux單菌落接種到有5 mL LB_amp200的滅菌50 mL塑料離心管中,于30 °C、150 r/min的恒溫振蕩培養箱中過夜(16 h)培養,為保證傳感細胞生長良好,測其OD600值須在0.4以上(如不符合要求,則重新接種培養),記為菌液A。菌液A保存于4 ℃冰箱,超過7 d時棄掉,重新從平板上接種培養。
(2) 取200 μL菌液A接種到約5 mL LB_amp200中,于30 ℃、150 r/min的恒溫振蕩培養箱中過夜培養,測其OD600值,須在0.5~0.6(如不符合要求,則重新接種培養),記為菌液B。菌液B每次使用都需要重新接種。
(3) 將菌液B在6 000 r/min條件下離心10 min,收集菌體,棄上清,加入與離心前等量的LB重懸菌體(用移液器充分吹打重懸)。按照所設稀釋比(此前實驗驗證1∶10為最佳稀釋比)用LB培養基進行稀釋,所得稀釋后的ADP1_pWHlux菌液用于檢測急性毒性。
2.2 污水水樣的采集
選取靠近上清橋的清河的某排污口處、下游及上游3點各取500 mL的水樣,分別記為A1、A2、A3,其中A2距排污口20 m,A3距排污口30 m,水樣采集點距河岸5 m。
2.3 實驗知識準備
實驗課上,教師講解在急性毒性物質作用下生物傳感細胞的發光強度變化的原理,講解酶標儀的原理(見圖1)、基本構成以及使用方法(參照多功能讀板機_BERTHOLD_LB9462操作流程),并完成實驗設計的理論。
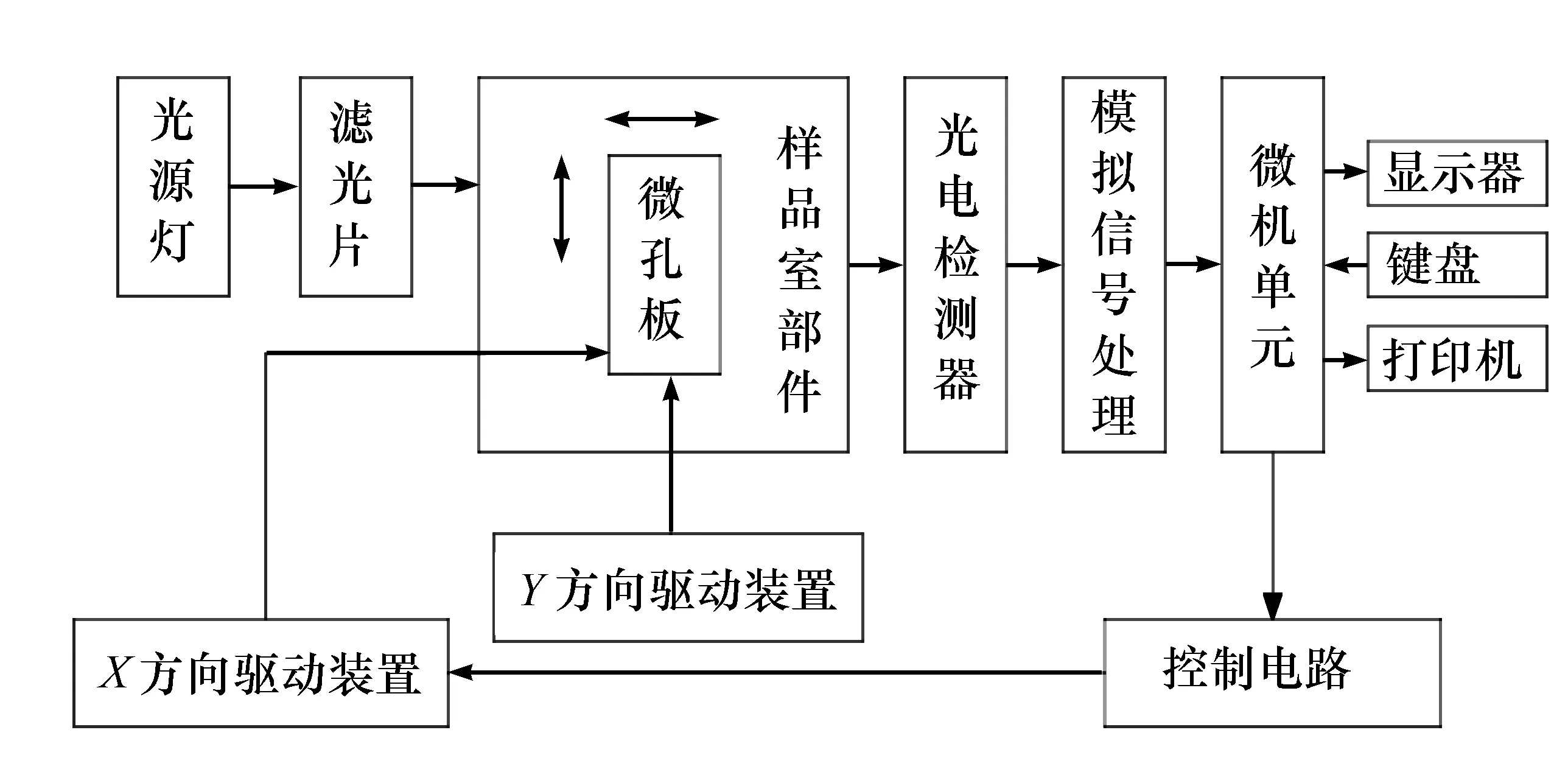
圖1 酶標儀工作原理圖
閱讀參考文獻[9-10],掌握發光細菌在測定水質綜合毒性的研究進展、生物傳感細胞的構建及其在急性毒性物質誘導下,基因表達方式及對發光強度的影響原理。生物傳感細胞(ADP1_pWHlux)主要具有啟動基因和報道基因相互耦合的結構,當啟動基因為組成型表達時,毒性物質會抑制報道基因轉錄和翻譯,通過檢測報道產物的量的減少即可表征毒性的強度。利用生物傳感細胞進行急性毒性測定主要是基于非特異型傳感細胞應答機制,有毒物質通過阻礙細菌新陳代謝,抑制發光基因的表達,因此細菌發光強度與毒性物質濃度成負相關(Light-off效應)(見圖 2)。
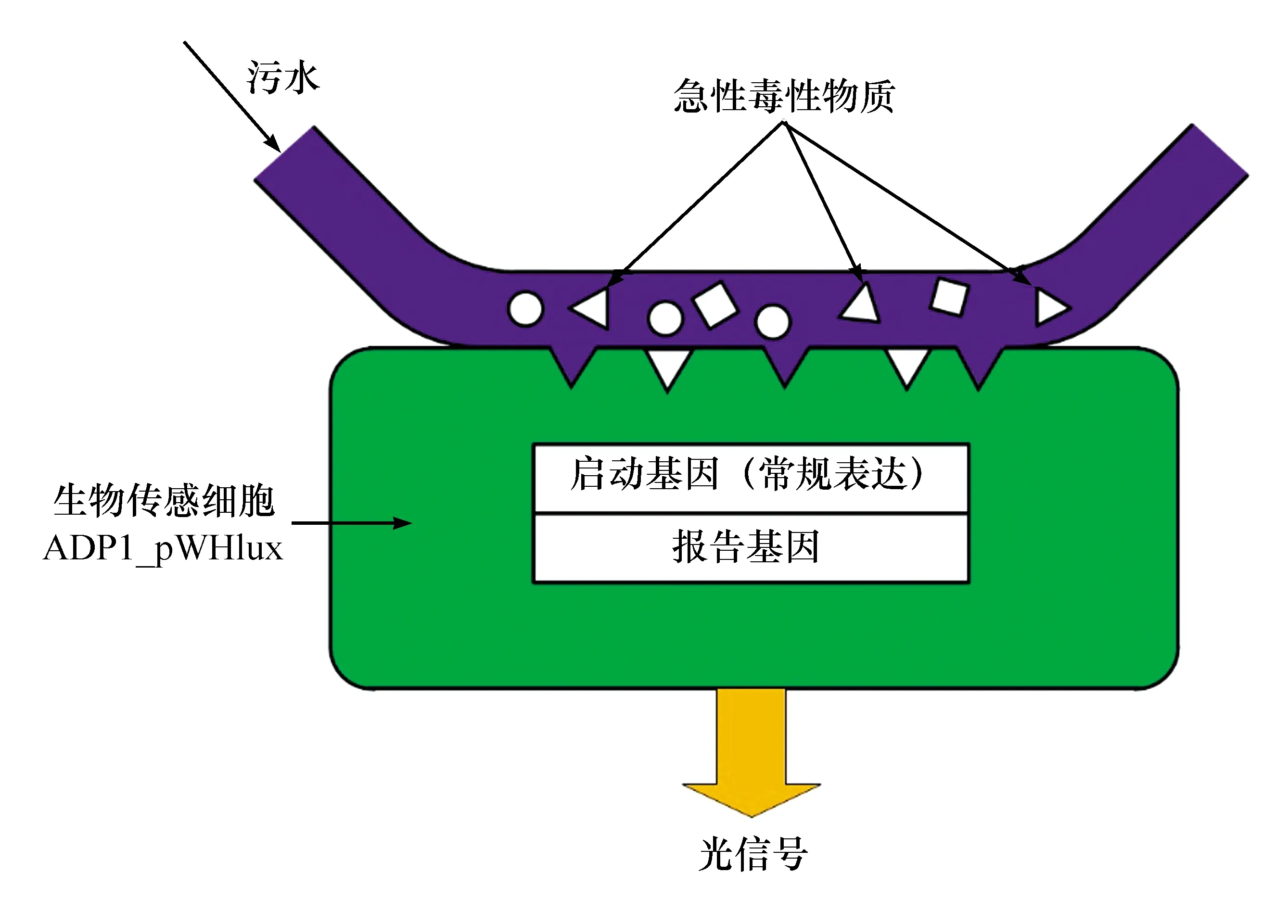
圖2 非特異型生物傳感細胞毒性檢測應答機制
閱讀文獻[13],了解不同濃度的HgCl2及其他水環境中優先污染物(如 Be2+、Ba2+、Cu2+等)對 ADP1_pWHlux 發光強度的影響,初步掌握ADP1_pWHlux對水環境中急性毒性物質的檢測。
3 實驗
3.1 ADP1_pWHlux對HgCl2的響應
參照GB/T 15441—1995國家標準,本實驗取HgCl2作為急性毒性檢測的標準物質,分別稀釋至質量濃度為0.4、1、2、3、4 mg/L,保存于30 mL棕色細口瓶中。分別在酶標板微孔內加入菌液100 μL ,取 100 μL 上述不同質量濃度 HgCl2加入酶標板各孔中,無菌去離子水作為陰性對照,共設置3個平行實驗。酶標儀設置參數:每5 min讀取每個酶標板微孔的化學發光強度值,共連續測定2 h。
根據每5 min測定的發光強度數值,繪制出ADP1_pWHlux在不同濃度HgCl2誘導下發光強度隨時間的變化曲線。
3.2 ADP1_pWHlux對待測水樣的測定
取100 μL待測水樣和100 μL菌液混合,設置3個平行實驗。在室溫下,置于酶標儀中60min時測量其發光強度值。
計算出待測水樣與 ADP1_pWHlux 混合 60 min 時的發光抑制率,并和標準的HgCl2溶液誘導下的發光抑制率相比較,快速表征水體的急性毒性程度。
3.3 數據處理
所有實驗都設置3個平行組,分別計算平均值、標準偏差及發光抑制率。發光抑制率計算如下式:
發光抑制率=
上式反映待測水樣中可被生物傳感細胞有效利用部分的急性毒性水平。細胞對某種物質急性毒性的檢出限定義為暴露于該質量濃度污染物60 min后,細胞發光明顯低于陰性對照的質量濃度(P<0.05)[16]。發光抑制率越高,表明待測樣品急性毒性越強,不具急性毒性的樣品理論發光抑制率為0;在毒性水平相同條件下,發光抑制率越高,則說明傳感細胞越靈敏。
4 實驗結果
4.1 ADP1_pWHlux對HgCl2響應曲線繪制
ADP1_pWHlux分別在不同濃度的HgCl2誘導下,其發光強度隨時間的變化見圖3。由圖3可知,當HgCl2的濃度高于0.4 mg/L時,ADP1_pWHlux的發光強度明顯降低,其對急性毒性物質產生響應。4 mg/L 的HgCl2迅速對ADP1_pWHlux發光產生抑制,5 min時就可將發光強度降至初始的50%以下;誘導時間在100 min時,發光強度基本降至為0。大量實驗結果表明,ADP1_pWHlux的發光強度在0.4~4.0 mg/L的HgCl2誘導60 min變化已較為明顯,HgCl2濃度越高,其對ADP1_pWHlux的發光抑制越明顯。為了簡化檢測水體急性毒性物質的步驟,快速得到結果,可直接讀取誘導60 min時的發光強度值。
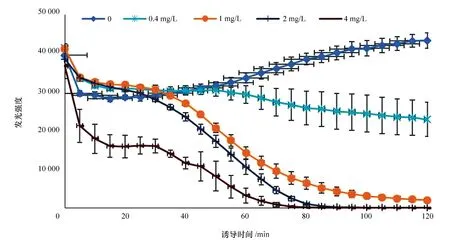
圖3 不同濃度 HgCl2 對 ADP1_pWHlux 發光強度的影響
4.2 待測水樣的急性毒性表征結果
ADP1_pWHlux 與待測水樣混合至60 min 時讀取發光強度值,并計算出發光抑制率,并與在0.4~2.0 mg/L的HgCl2誘導下ADP1_pWHlux的發光抑制率相比較,結果如圖4所示。由圖可知,在清河所取的3個水樣的急性毒性大小順序:0.4 mg/L HgCl2急性毒性 圖4 ADP1_pWHlux對污染水樣的檢測(誘導60min) 生物傳感細胞ADP1_pWHlux表征污水急性毒性在環境檢測、污染物毒性評估等諸多領域獲得了高度的關注與應用,研究進展突飛猛進。通過本實驗,不僅可以鍛煉學生的基本實驗操作技能,還可以加深學生對環境生物檢測前沿技術的理解,激發學生的專業興趣和對科學的探索與研究。本實驗應用在我校環境科學與工程專業本科生專業實驗課程中取得了良好的教學效果,因此建議在環境領域相關學科中廣泛推廣。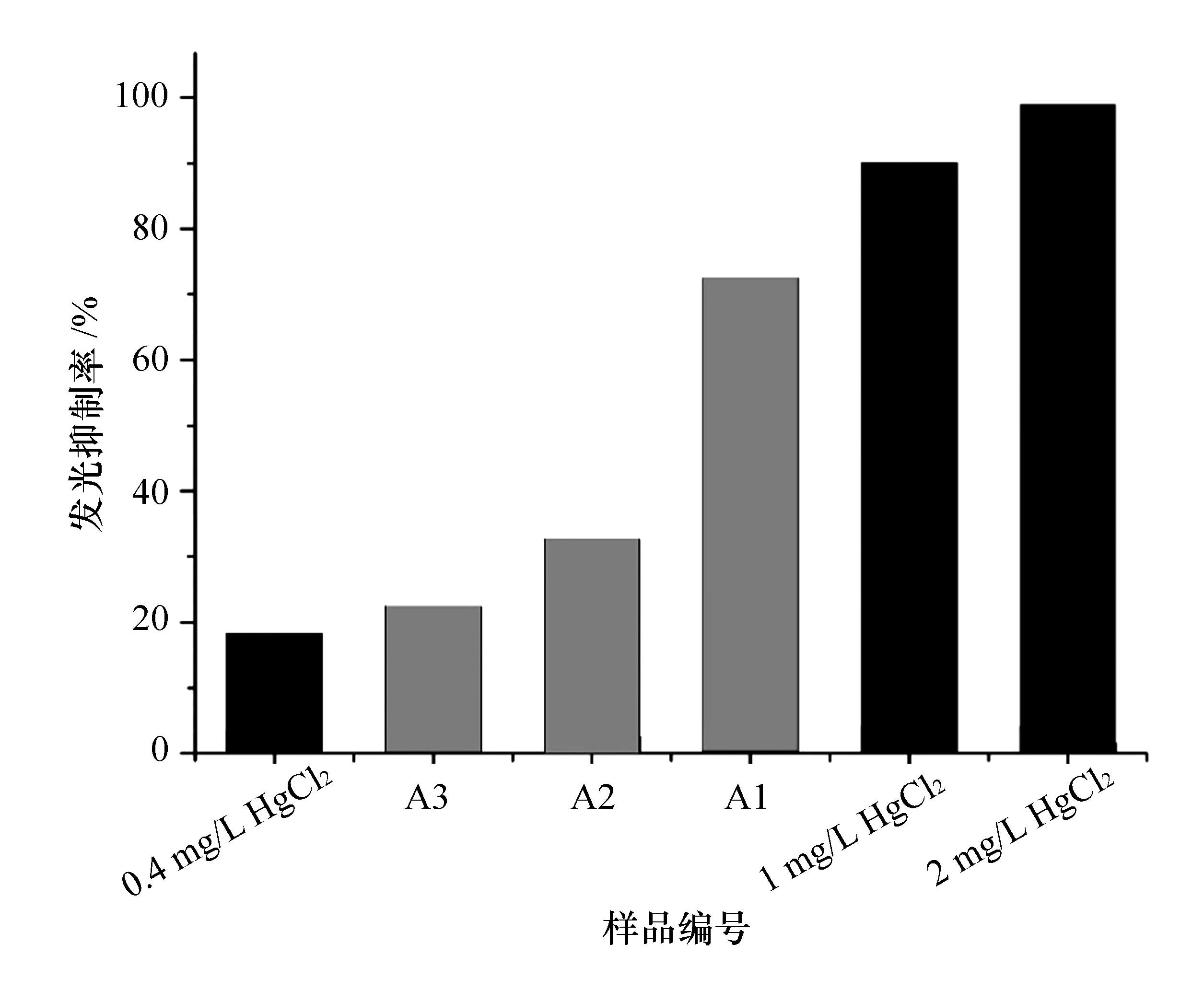
5 結語

