介孔二氧化硅在腫瘤治療領域的研究進展
姚琳通 劉婭婷 劉雅靜 陳真真
(鄭州大學生命科學學院,鄭州 450001)
納米技術應用于腫瘤在很大程度上歸功于其藥物遞送、診斷和成像、開發合成疫苗以及一些納米材料本身的治療性質[1-5]。隨著癌癥納米醫學領域的巨大進步,納米其中的一些功能,如增強循環和降低毒性,已經在使用,其他一些功能在臨床開發中同樣表現出巨大的潛力,預期在不久的將來會有明確的結果。目前研究的大多數納米載體(如脂質體[6-8]、聚合物膠束[9-11]和樹枝狀聚合物[12-14]等)已經在癌癥治療領域表現出很好的應用前景。介孔二氧化硅納米粒子(Mesoporaus silica nanoparticles,MSNs)通過其外表面的功能化修飾,防止藥物的過早釋放,響應于外部或內部刺激(如pH、離子、酶、溫度、光和磁場)確保在所需位點釋放較高藥物濃度,這使其成為一個強大的技術。
1 介孔二氧化硅
自20世紀90年代初發現介孔二氧化硅,近20年來,介孔二氧化硅材料的發展爆炸式增長,最廣為人知的是硅基納米材料。MSNs是基于改進St?ber合成法合成的,如使用正硅酸乙酯(Tetraethyl orthosilicate,TEOS)作為硅膠縮合前體,不同的添加劑作為模板,如十六烷基三甲基溴化銨(Cetyltrimethylammonium bromide,CTAB),聚合物,膠束形成劑或其它摻雜劑[15]。簡而言之,在堿性條件下將表面活性劑在水與醇的混合物中攪拌,并在攪拌條件下加入TEOS或其它硅酸鹽。二氧化硅源、模板劑和攪拌條件的濃度和組成決定了粒徑、孔徑和形狀。當表面活性劑濃度高于臨界膠束濃度時,CTAB自聚集成膠束,二氧化硅前體在表面凝聚。二氧化硅結構形成在膠束表面周圍。然后,必須將表面活性劑完全除去,以獲得生物相容性介孔二氧化硅納米粒子以用于進一步修飾[16]。另一種方法是由Zhao等[17]首先介紹的,他們使用三嵌段共聚物作為孔徑高達30 nm的有序六角形介孔二氧化硅結構的模板。MSNs的共同孔徑范圍在2-5 nm之間,但是通過加入溶脹劑如三甲苯,可以產生23 nm的孔徑[18]。另外,Wu等[19]研究了中空結構的MSNs作為藥物載體,采用了基于穩定性差異的選擇性鍵斷裂方法。簡而言之,該方法依賴于Si-C鍵弱于Si-O鍵并且可以通過水熱處理而降解的事實。通過應用不同的溫度,孔徑逐漸增加到24 nm。粒徑也可以實現更大的變化,取決于表面改性。雖然一些二氧化硅納米粒子的直徑為100-120 nm,其他納米粒子大于200 nm,但孔徑相似(分別為2.5 nm或3.0 nm)[20-22]。不同類型的介孔二氧化硅,包括MCM-41/48,SBA-15,TUD-1及其衍生物,在催化、原子篩分、光學、分離和吸附等多個領域得到了廣泛的應用[23-26]。MSNs最有潛力的應用之一是在癌癥治療中的藥物遞送[27-28],作為一個成功的藥物傳輸系統(Drug delivery system,DDS),必須滿足一些先決條件,包括良好的生物相容性和無毒性;高載藥量;在到達目標位點之前保護負載物并防止過早泄漏的能力;控制藥物釋放;細胞和組織靶向[29]。設計不同的基于MSNs的藥物載體用于癌癥細胞和組織的控制藥物遞送已經是近年來特別活躍的研究領域。
2 介孔二氧化硅的應用研究
作為成功的藥物輸送系統(DDS),Seminal和同事們為MSNs進行了有效的DDS的精髓工作[30]。Lane等[31]提出了“閥門”的概念,用閥門覆蓋介孔,客體分子被封閉在MSNs的介孔里。通過各種技術,包括靜電結合,物理吸附或共價偶聯,官能化的MSNs可以被用來靶向特定的細胞或組織,通過將肽,適體,抗體或基因修飾到它們的表面上,增強包封藥物的治療效果并減少毒副作用(圖1)。
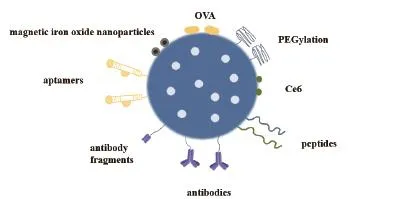
圖1 不同分子修飾介孔二氧化硅用于納米遞送系統
2.1 多肽修飾介孔二氧化硅納米粒子
2.1.1 靶向肽 精氨酸-甘氨酸-天冬氨酸(Arginine-glycine-asparticacid,RGD)肽,一種特別有效的靶向肽,可以被在各種人癌細胞中過表達的αvβ3整聯蛋白受體識別[32-34]。因此,包含RGD序列的多肽已經被認為是納米載體的理想靶向部分,不僅是MSNs,而且還包括脂質體,膠束,其他無機或有機納米粒子。環狀RGD可以比線性RGD更強地結合受體,因為線性RGD在溶液中呈現大量的構象,這會導致結合強度的下降[35]。許多研究小組已經證明將RGD多肽引入MSNs可以實現特定的內在化,通過受體的內吞作用增加納米顆粒的攝取量,導致治療效果增強。例如,加載光敏劑(PdTPP)用于光動力療法[36],抗腫瘤藥物用于化療[37-38]。核定位信號(Nuclear localization signal,NLS)是通過核孔復合物(Nuclear pore complex,NPC)將藥物運輸到細胞核中的策略[39]。作為最常見的NLS多肽之一,TAT多肽通過結合受體,隨后靶向NPC,最終進入細胞核。Pan和他的同事們構建了核定向MSNs,用TAT多肽修飾并負載DOX作為抗癌藥物(DOX@ MSNs-TAT)[40],并且發現直徑為50 nm以下的DOX @ MSNs-TAT可以進入HeLa細胞核并將藥物輸送到核質中,引發更高的細胞毒性。隨后的研究表明,該DDS可有效克服多藥耐藥,增加多藥耐藥MCF-7 /ADR 細胞凋亡[41]。
2.1.2 刺激響應多肽 生物反應性是多肽最具吸引力的特性,已經引起了全球科學家的廣泛關注。具有特定序列的多肽可以被特異性的酶識別切割。這種高選擇性將成為設計酶響應性MSNs的關鍵所在,可以用作診斷劑、顯像劑和刺激響應性藥物遞送系統等。2010年,Thornton等[42]完成了雙酶響應多肽修飾二氧化硅納米顆粒的開創性工作。基質金屬蛋白酶(Matrix metalloproteinase,MMPs)具有降解細胞外基質的特性,并與腫瘤進展、血管生成或轉移相關。MMP響應性肽可被有效地切割,且大部分切割位點是甘氨酸(G)和亮氨酸(L)之間的肽鍵[43]。因此,通過使用多肽底物作為納米顆粒與其他功能單元之間的接頭分子來設計酶響應性藥物遞送系統是有前景的策略。pH值在組織和細胞水平上有所不同。例如,由于厭氧(糖酵解)呼吸導致乳酸的積累,腫瘤組織(pH≈6.8)或炎癥組織(pH5.4-7.2)的細胞外pH一般低于正常組織(pH7.2-7.4)[44]。胞吞作用后,由于空泡質子ATP酶介導的質子通道,發生快速內體酸化導致內涵體和溶酶體的pH值迅速下降至pH <6.0[45]。令人驚喜的是,科學家們發現低pH插入肽(pHLIP),它對于輕微的pH變化更為敏感[46-48]。Zhao[45]及其同事通過將雙重作用pHLIPss(pH敏感性肽和閥門)連接到MSNs表面來設計pH驅動靶向和氧化還原響應性藥物遞送納米載體。pHLIPss-MSNs在中性pH下與細胞膜松散連接。當暴露于pH 6.5時,pHLIPss將快速插入膜中,然后通過形成螺旋結構將納米顆粒轉移到細胞質中。由于細胞內高濃度的谷胱甘肽(Glutathione,GSH),pHLIPss中的二硫鍵將被切割,阻斷劑將從MSNs表面離開,導致DOX釋放并引發細胞死亡。該系統在藥敏細胞(MCF-7細胞)和耐藥腫瘤細胞(MCF-7 / ADR細胞)中都是有效的。溫度是改變多肽二級結構的另一個因素。用作MSNs的納米閥的熱響應卷曲螺旋多肽就是很好的例子。用半胱氨酸修飾的肽“E”[C(EIAALEK)3]和互補多肽“K-PEG”[(KIAALKE)3-PEG]修飾 MSNs通過形成卷曲螺旋基序封閉介孔,當溫度達到80℃時,卷曲螺旋基序松散,負載藥物被釋放[49]。但是它不適合在體內進一步應用。原因是上述肽的反轉溫度很高,與疾病組織(40-42℃)和健康組織(37℃)之間的溫度差異不匹配[50]。它們作為生物材料在實際應用還有很長的路要走。
2.1.3 多功能嵌合多肽 由于復雜的腫瘤微環境,單功能多肽缺乏實際應用,相反,設計的多功能嵌合肽,整合了幾種具有不同生物活性和生物反應性的肽片段,更加靈活有效。基于介孔二氧化硅納米粒子(MSN)的多功能包膜納米器件被精心設計用于藥物和治療肽的亞細胞共遞送至腫瘤細胞。Luo等[51]以介孔二氧化硅MCM-41納米粒子加載抗腫瘤藥物拓撲替康(Topotecan,TPT)為核心。用含三苯基磷(Triphenylphosphine,TPP)和抗生素肽(KLAKLAK)2的靶向線粒體治療劑(Tpep)通過二硫鍵修飾納米顆粒表面,隨后通過靜電相互作用包載電荷逆轉聚(乙二醇)- 嵌段-2,3-二甲基馬來酸酐改性的聚(L-賴氨酸)[(PEG-PLL(DMA)]。在酸性腫瘤微環境下,由于DMA嵌段的降解,可以去除外屏蔽層,并且通過形成陽離子納米顆粒顯著增強了細胞的攝取。胞吞作用后,細胞內的GSH裂解二硫鍵,藥物制劑(Tpep和TPT)可從納米顆粒中釋放,并隨后分別誘導腫瘤細胞線粒體和細胞核的特異性損傷,具有顯著的協同抗腫瘤作用。Cheng等[52]設計了一個簡單而強大的制定高度可控的藥物遞送系統用于協同癌癥治療。MSNs作為納米平臺封裝抗癌藥物DOX,通過二硫鍵結合靶向腫瘤細胞膜穿透肽(TCPP)和線粒體的治療肽(TPP)密封表面介孔,體外結果表明,這些生物活性多肽修飾的MSNs可以靶向癌細胞,穿透細胞膜并響應細胞質中高濃度的GSH以快速釋放負載的抗癌藥物DOX和線粒體靶向肽TPP,表現出顯著的協同抗癌作用。Xiao等[53]開發了包含非共價官能化MSNs和含有RGD配體的氧化還原響應介孔二氧化硅納米顆粒(RRMSNs)作為藥物納米載體。將具有硫醇末端基團的烷基鏈硬脂酸(C18)通過二硫鍵固定在MSNs的表面上,然后MSNs的十八烷基和AP烷基鏈之間的疏水相互作用自組裝為多肽(AP)C18-DSDSDSDSGGDS。體外藥物釋放實驗表明,在沒有谷胱甘肽(GSH)或二硫蘇糖醇(Dithiothreitol,DTT)的情況下,抗癌藥物(Doxorubicin,DOX)幾乎不會被滲漏。隨著DTT或GSH的添加,負載的藥物由于二硫鍵的裂解而迅速釋放。
2.2 抗體或抗體片段
整個抗體或抗體片段功能化的介孔二氧化硅作為藥物遞送載體用于腫瘤靶向也是很好的應用前景。例如,西妥昔單抗(靶向EGF受體),曲妥珠單抗(靶向HER2/ neu受體)和貝伐單抗(靶向VEGF受體)或具有相似靶標的相關抗體已經批準用于癌癥治療。Durfee開發了一種名為“原始細胞”的藥物納米載體,該納米載體以用于載藥的MSNs為核心和用于表面改性的門閥和平臺的脂質雙層組成,負載的上皮生長因子受體(EGFR)抗體在體外和體內都可以有效地靶向白血病細胞[54]。利妥昔單抗是靶向B細胞上的CD20抗原的嵌合單克隆抗體,并且被批準用于B細胞非霍奇金淋巴瘤治療[55],Zhou等[56]將利妥昔單抗偶聯到MSNs,并在體外和體內評估了藥物遞送載體,在小鼠異種移植淋巴瘤模型中,由利妥昔單抗靶向并負載阿霉素的MSNs可以明顯的引起腫瘤體積減小,并且與用游離DOX處理的小鼠相比,小鼠體質保持更好。Chen等[57-58]已經應用靶向腫瘤血管系統的抗CD105抗體(TRC105)于鼠乳腺癌模型中。抗體結合的MSNs的腫瘤攝取明顯大于沒有靶向性的納米粒子,但是在注射24 h后在肝臟仍有積聚。該課題組在小鼠脈管系統模型中,使用TRC105抗體片段(Fab)靶向雙標記MSNs用于腫瘤的體內正電子發射斷層成像(PET)成像/近紅外熒光染料(NIRF)成像。急性白血病由白血病干細胞(LSCs)啟動和維持,因此開發針對LSCs的創新性治療方法具有重要意義。Mandal[59]設計琥珀酸酐功能化,抗B220抗體標記,并且加載蒽環霉素柔紅霉素的介孔二氧化硅納米顆粒(MSNs)。在體外,與B220陰性AML LSCs相比,介孔二氧化硅納米顆粒可以被有效滲入鼠B220陽性AML LSC中,并優先殺死這些細胞。此外,移植前用MSNs短期治療AML LSCs顯著延遲了受體小鼠的白血病發展。這些數據表明,通過使用功能化的和抗原定向的MSN作為抗白血病藥物的載體,可以改善靶向AML LSC。
2.3 核酸適體
除了小分子和多肽以外,適體可用于腫瘤細胞靶向。適體是合成的單鏈DNA或RNA寡核苷酸,表現出對不同靶點的高親和力和特異性。它們是聚陰離子的,比小肽大,但比抗體小[60]。Babaei[61]及其同事采用了一種與上皮細胞黏附分子(EpCAM)結合的適配體,用于體外和體內靶向肝癌細胞。他們在MSNs中包裹5-氟尿嘧啶,用檸檬酸鈉修飾的金納米粒子作為閥門,將其PEG化并與EpCAM適體結合制備新型納米顆粒(EpCAM-PEG-AU@Si-5-FU)。與沒有靶向性PEG-AU@Si-5-FU納米顆粒相比,EpCAM-PEG-AU@Si-5-FU納米顆粒在2D和3D 培養的HepG2細胞中引起更強的細胞活力降低。此外,在體內,該系統作為一個超分子裝置進行了測試,并且在羅丹明6G負載的MSNs注射體內成像之后在腫瘤部位觀察到大量積累[61]。適體靶向的另一個受體是在癌細胞上表達的核仁素。Tang等[62]開發了一種新型的適體靶向光敏藥物釋放系統,通過在石墨烯包裹的負載阿霉素(Dox)的介孔二氧化硅納米粒子表面上非共價組裝Cy5.5-AS1411適體綴合物(MSNs-Dox @ GO-Apt)用于光刺激的藥物釋放以及靶向適體的癌癥治療。然而,在體外,有無靶向的負載阿霉素的MSNs對乳腺癌細胞的細胞活力的影響沒有區別。在大多數基于適配子的刺激響應介孔二氧化硅納米粒子(MSN)系統中,適配體在MSN上通過靜電相互作用進行修飾,但是在系統中一定時間后可能存在泄漏,因此穩定性不好。最近研究實現首次通過點擊化學反應使MSN的孔徑被適體封閉,然后用于開發熒光生物傳感器。所提出的生物傳感器已成功應用于高選擇性血清樣品中的凝血酶檢測。通過改變所采用的適體,可以應用相同的策略來開發用于不同目標的生物傳感器[63]。
2.4 克服多藥耐藥性
克服多藥耐藥的各種蛋白質如P-糖蛋白(P-gp/ MDR1),乳腺癌耐藥蛋白(BCRP),MDR蛋白1(MRP1)或抗凋亡蛋白在各種癌癥類型中高度過表達,使不同種類的藥物(如阿霉素、紫杉醇和表阿霉素等)流失,導致其在細胞內濃度降低[64-65]。在這個方面,基于納米技術的體系已被用來克服通過內體輸送藥物的MDR,提供了更強的細胞內遞送,是作為治療癌癥的有希望的方案[66]。在所研究的各種納米載體中,MSNs在以多種方式提高藥物在MDR細胞中的治療方面顯示出巨大的潛力[67],如調整它們的殼體孔徑,引入刺激響應功能,遞送多種治療劑和MDR相關蛋白表達的基因[68-69]。CD44在多藥耐藥性人乳腺癌細胞上過表達。CD44單克隆抗體通過抑制增殖并調節多藥耐藥細胞中P-糖蛋白介導的藥物效應活性顯示出抗癌潛力。Wang等[70]設計負載阿霉素的CD44單克隆抗體功能化介孔二氧化硅納米粒子增強了對人乳腺癌耐藥癌MCF-7細胞毒性并且與CD44抗體相比增強了P-糖蛋白的下調。CD44修飾的介孔二氧化硅納米粒子提供了有活性的靶點,這促進了耐藥細胞對DOX更多的細胞攝取,抗性乳腺癌異種移植物的動物研究表明,CD44工程藥物遞送系統顯著誘導細胞凋亡并抑制腫瘤生長。Jia等[71]設計制備pH響應性的負載抗腫瘤藥物紫杉醇(PTX)和逆轉多藥耐藥的漢防己甲素(TET)的多功能介孔二氧化硅納米粒子(PTX / TETCTAB@ MSN),實現克服MCF-7 / ADR細胞的多藥耐藥性。細胞攝取的研究結果表明TET可顯著增加納米粒子的細胞內積聚。此外,PTX/TET-CTAB @ MSN比僅遞送PTX(PTX-CTAB @ MSN)或游離PTX更有效地抑制腫瘤細胞生長。納米顆粒負載藥物PTX/TET摩爾比為4.4∶1完全逆轉了MCF-7/ADR細胞對PTX的耐藥性,并且耐藥逆轉指數為72.3,這種納米載體可能在多種藥物聯合遞送以克服MDR的臨床意義上具有重要的潛力。
2.5 治療診斷學應用
治療診斷學已經成為納米醫學領域的一個新領域,它將診斷和治療策略同時結合在一個系統中。這個獨特的平臺提供了更具體和個性化的治療[72]。Yang等[73]在這項工作中,通過自組裝將WS2納米片的表面預吸附氧化鐵(IO)納米顆粒,再涂覆聚乙二醇(PEG)修飾的介孔二氧化硅殼。制備的WS2-IOMS-PEG納米粒子表現出許多固有物理性質,包括高近紅外(NIR)光和X射線吸收,以及強烈的超順磁性。同時,WS2-IO @ MS-PEG中的介孔二氧化硅殼體可裝載化療藥物阿霉素(DOX),其后細胞內釋放可由NIR誘導的光熱加熱引發,用于增強癌細胞殺傷。通過三模式熒光,磁共振(MR)和X射線計算機斷層攝影(CT)成像所顯示的,在荷瘤小鼠中觀察到WS2-IO @ MS-PEG / DOX有效的腫瘤歸巢。然后用WS2-IOMS-PEG / DOX進行體內聯合的光熱和化學療法,實現了明顯的協同療效,優于各種單療法。Su等[74]報道了新型多功能MSNs支持的紅細胞(RBC)模擬治療診斷納米顆粒,具有長時間血液循環,深紅色光活化腫瘤成像和藥物釋放。RBC膜包裹同時加載抗癌藥物Dox(39.1%,質量分數)和近紅外光敏劑Ce6(21.1%,質量分數)的MSNs,實現高負載能力。紅細胞膜包衣防止藥物泄漏,大大提高了MSNs的膠體穩定性。在單一系統中綜合光動力治療和化療顯著抑制了4T1乳腺癌細胞的生長,為MSNs的優化和高效的抗癌藥物輸送提供了新的策略。通過克服耐藥性并隨后加強治療,光動力學療法(PDT)和化學療法的聯合療法有希望用于癌癥治療。然而,主要的挑戰是如何建立一個先進的納米平臺,可以有效地引導到腫瘤部位,然后同時并準確地穩定釋放化療藥物和光敏劑。Tang等[75]成功構建了新型 Fe3O4@ mSiO2(DOX)@ HSA(Ce6)納米平臺,可以作為一個有效的具有磁性指導高度特異靶向和保留的協同抗腫瘤納米平臺。阿霉素(DOX)分子被裝載到具有高負載能力的介孔二氧化硅中,且介孔通道被聚多巴胺(PDA)涂層阻塞。人血清白蛋白(HSA)綴合到外表面,增加生物相容性和血液循環時間,同時可以用于加載光敏劑Ce6。在酸性條件下持續釋放DOX和由紅光誘導的PDT對神經膠質瘤細胞發揮協同抑制作用。實驗證明,pH響應性Fe3O4@ mSiO2(DOX)@ HSA(Ce6)納米平臺通過磁性靶向被引導到腫瘤區域,并且納米平臺有效地抑制膠質瘤腫瘤生長,這意味著該系統是非常有前途的光動力/化療組合納米平臺,對癌癥治療具有協同效應。
2.6 免疫治療
樹突狀細胞(DC)是最重要的抗原呈遞細胞(APC),被認為是免疫的起始者,是癌癥免疫治療有前景的靶向細胞[76]。DC可通過主要組織相容性復合體(MHC)I / II分子的抗原呈遞誘導CD4+T輔助淋巴細胞和CD8+細胞毒性T淋巴細胞(CTL)的產生和活化,這已成為許多肽疫苗臨床試驗的理論基礎。目前正在開發基于腫瘤抗原肽的預防性和治療性疫苗,具有許多優點,包括高純度,誘導的抗腫瘤免疫應答的安全性和特異性[77-78]。然而,限于特定MHC類型的肽,特別是那些單表位多肽可能不足以誘導強烈的免疫應答,并且其臨床應用很少成功。與游離蛋白質或肽的巨胞飲作用相比,包裹在納米顆粒(NP)中的抗原通過吞噬作用內化并且更有效地在MHC I / II類分子上交叉呈遞以提高免疫原性[79]。因此,納米顆粒疫苗遞送系統通過誘導強效的CTL細胞免疫應答顯著提高常規疫苗制劑的功效。Kupferschmidt等[80]研究了介孔二氧化硅顆粒的輔助作用及其修飾已存在的過敏性Th2樣免疫應答的能力。作者在抗原特異性卵清蛋白(OVA)體系中研究了介孔二氧化硅顆粒(SBA-15)在體內和體外的佐劑效應。評估負載OVA的SBA-15顆粒(SBA-15-OVA)在鼠過敏模型中的免疫應答能力。同單獨的OVA相比,SBA-15-OVA顯著增強OVA特異性脾臟細胞增殖,與僅注射SBA-15或OVA的小鼠相比,在來自SBA-15-OVA免疫小鼠的離體OVA刺激的脾細胞中觀察到顯著高表達的IFN-γ。與明礬OVA處理組相比,用SBA-15-OVA處理OVA致敏的小鼠,顯著降低了OVA特異性的IgE血清水平和更高的IgG表達。Heidegger等[81]評估了多功能MSN在新鮮分離的原代小鼠的免疫細胞中的生物相容性和功能性。功能化的二氧化硅納米粒子被迅速和有效地吸收到特定的抗原呈遞細胞,如樹突狀細胞的內體區室。二氧化硅納米粒子顯示出有利的毒性分布,并且在相關濃度下不影響來自脾臟的原代免疫細胞的存活力。通過檢測原代細胞的表面標志物的表達和抗炎細胞因子如白細胞介素-6,-12和-1β的釋放,證實裸露的MSN僅引起非常低的免疫應答。相反,當用pH響應性聚合物封端的表面官能化的MSN加載免疫活化藥物Toll樣受體7激動劑R848,可以引起強烈的免疫應答。證明了MSN作為一種有效的藥物傳遞載體,對原始免疫細胞既無毒又不引起炎癥反應,滿足在生物醫學應用中使用這些顆粒的先決條件。
3 展望
20世紀中期以來,介孔二氧化硅已經被應用于藥物輸送,并且與生物技術的結合獲得了豐碩的成果。高載藥量和靈活的表面修飾使介孔二氧化硅成為理想的納米載體。介孔二氧化硅的另一個巨大的優勢是其可生物降解性和體內高生物相容性。但是,介孔二氧化硅作為新型生物材料,仍然有很多問題亟待解決:(1)EPR效應[82-84]已經成為納米遞送至實體瘤的基礎,但是,即使在相同患者或者腫瘤類型中,EPR隨時間在患者和腫瘤類型之間是顯著變化的,而目前有關EPR在納米治療功效方面的研究還不是很清楚。(2)為了評估體內納米材料性能(如藥代動力學、生物分布、功效和安全性),動物模型的使用是強制性的。然而,沒有任何一種模型可以完全復制人類惡性腫瘤的所有方面,并且EPR通常在動物模型中比在癌癥患者中更一致。因此,開發模擬人類腫瘤的異質性和解剖組織學的動物模型對于納米治療是非常重要的[85]。(3)納米材料進入生物環境,其表面會很快被不同的生物分子(特別是蛋白質)覆蓋形成蛋白質冠,這將會顯著降低納米材料在復雜生物環境中的靶向能力[86-87],并且有關體內納米材料與蛋白質的相互作用在藥代動力學,生物分布和治療能力方面的研究也不是很清晰[85]。值得關注的是,最近有關中空二氧化錳(H-MnO2)納米載體[88],非病毒納米載體[89],刺激響應納米膠束[90],智能仿生藥物遞送納米載體[91-93]都取得了很好的抗腫瘤效果,為納米載體應用于癌癥治療提供了更多的選擇。相信經過多領域科研人員的不斷努力,會加速這些納米系統從實驗室應用到臨床的進程。

