羅漢果環阿屯醇合酶的同源建模、分子對接及催化環化的機理推測
喬晶 崔晟榕 石宏武 羅祖良 馬小軍
(中國醫學科學院 北京協和醫學院藥用植物研究所,北京 100193)
環阿屯醇(Cycloartenol)廣泛分布于植物中,是重要的藥效物質,近年來研究發現它具有明顯的抗炎[1-2]、抗氧化[3]、抗腫瘤[4-5]、調節膽固醇[6]等藥理活性。此外,它還是重要的藥物中間體和先導化合物,是植物甾醇、甾體皂苷等化合物半化學合成及生物合成的關鍵底物。環阿屯醇合酶(Cycloartenol Synthase,簡稱CAS)作為合成環阿屯醇的關鍵調控基因,也是很多植物甾醇及甾體類物質生物合成途徑中的重要環化酶[7]。目前,已有20多種植物的CAS基因被分離和克隆出來,如擬南芥[8](Arabidopsis thaliana)、盾葉薯蕷[9](Dioscorea zingiberensis)、光果甘草[10](Glycyrrhiza glabra)、黃芪[11](Astragalus membranaceus)、 丹 參[12](Salvia miltiorrhiza)和刺五加[13](Eleutherococcus senticosus)等,并通過異源表達進行功能驗證。在生物體內,三萜類物質和植物甾醇均通過異戊二烯途徑合成,且都源于同一前體物質—2,3-氧化鯊烯[14]。Liang等[15]研究表明,CAS可與β-AS競爭2,3-氧化鯊烯,對CAS基因的表達進行抑制后,減少了植物甾醇合成,使2,3-氧化鯊烯更多的進入到三萜皂苷代謝支流,從而間接提高了三萜皂苷的產量,說明CAS不僅是植物甾醇合成過程中的關鍵酶,同時又是三萜物質合成的重要調控位點。雖然目前已在CAS基因的分離、純化、克隆及表達分析上取得了一定的進展,但是對于CAS的酶結構以及催化2,3-氧化鯊烯發生環化的機理尚不清楚。因此,該酶性質及催化機理的研究對次生代謝調控具有重要意義。
CAS屬于氧化鯊烯環化酶(OSCs)大家族的成員之一,OSC催化的環化作用是以2,3-氧化鯊烯為底物經過一系列的質子化、環化、重排和去質子化作用完成的。然而,由于OSCs分子結構較大且屬于膜蛋白,晶體結構獲得困難[16],目前,只有來自人、牛和酵母的羊毛甾醇合酶被純化獲得晶體結構,通過三維晶體結構研究催化機理及活性位點的工作無法開展[17],從而阻礙了酶進一步的改進及應用。同源模建是根據模板蛋白,預測目標蛋白的三維結構。對于尚未或者無法獲得實驗晶體結構的蛋白質,同源模建無疑是一種重要而有效的輔助手段。近年來,越來越多的研究者以已解析的晶體結構為模板,結合生物化學、有機化學和計算機輔助設計等開展OSCs催化活性的研究,以深入理解OSCs的催化環化/重排反應機理,產物多樣性以及活性功能氨基酸殘基。
綜上所述,CAS反應機制的研究是近年來一個極富挑戰性的難點和熱點,揭示其催化的活性位點及環化的機制,具有重要的理論意義。同時該酶能競爭三萜合成的共同底物2,3-氧化鯊烯,實現對次級代謝支路的調控,具有十分廣闊的應用前景。本研究以羅漢果CAS為對象開展研究,通過分析序列,采用同源建模及分子模擬的軟件模擬預測CAS三維結構和活性中心,以及其催化底物2,3-氧化鯊烯的環化的機制,旨為酶的改造及其代謝調控奠定基礎。
1 材料與方法
1.1 材料
1.1.1 同源建模序列來源及模板選擇 CAS氨基酸序列為本實驗室前期研究所獲得[18],已登錄于NCBI數據庫,基因登錄號為HQ128566。基于CAS氨基酸序列,利用Blast程序在蛋白質結構數據庫(Protein data bank,PDB)中搜尋與其氨基酸序列一致性大于或等于30%的X射線衍射晶體結構用于三維結構的建模。
1.1.2 受體結構準備 上文同源建模得到的CAS酶結構用于下面的分子對接。初始結構用AutoDockTools 1.5.6進行處理,保存蛋白原有電荷,并生成pdbqt文件用于對接。
1.1.3 配體結構準備 小分子配體2,3-氧化鯊烯以及碳正離子中間體的三維結構如圖1所示。使用MOPAC程序優化分子結構并計算AM1原子電荷用于后續的分子對接,然后用AutoDock Tools 1.5.6處理配體結構,處理后生成相應的pdbqt文件用于對接。
1.2 方法
1.2.1 同源建模 根據獲取的模板蛋白三維結構文件以及序列比對文件,根據序列的相似性推測結構的相似性,使用Modeller 9.17對CAS進行同源模建,從而獲取目標蛋白CAS的三維結構。所有計算均在MolDesigner分子模擬平臺(MolDesigner Molecular Simulation Platform)上完成。
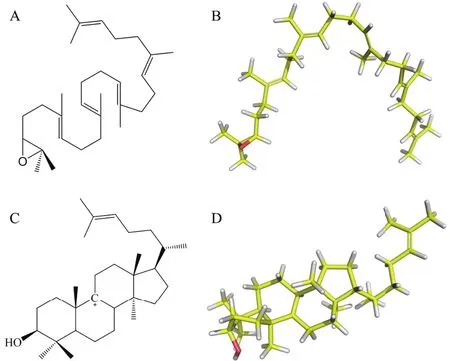
圖1 2,3-氧化鯊烯以及碳正離子中間體的分子結構
1.2.2 模型評價 本文分別用PROCHECK和Verify-3D程序對優化后模型蛋白結構進行評價。Ramachandran plot用于闡述蛋白質或肽立體結構中肽鍵內α碳原子和羰基碳原子間的鍵的旋轉度對α碳原子和氮原子間鍵的旋轉度,主要用來指明蛋白質或肽類中氨基酸殘基的允許和不允許的構象。Ramachandran plot主要分為三個區域,允許區(紅色區域),最大允許區(黃色區域),不允許區(空白區域)。
1.2.3 分子對接 分子對接采用AutoDock 4.2.6程序實現。首先確定配體對接位點,對接口袋中心點坐標為(26.264,70.645,14.631),網格數目分別為40×60×50,格點間距為 0.375 埃(?ngstr?m,符號?),對接口袋區域的格點能量采用AutoGrid程序進行計算。對接時,構象搜索策略采用拉馬克遺傳 算 法(Lamarckian Genetic Algorithm,LGA), 關鍵參數如下:對接次數(Number of GA Runs)設置為100,種群數目(Population Size)設置為150,最大迭代次數(Maximum Number of evaluations)設置為25 000 000,其余參數采用默認值。所有計算均在MolDesigner分子模擬平臺(MolDesigner Molecular Simulation Platform)上完成。
2 結果
2.1 同源建模
2.1.1 模板選擇 通過在PDB數據庫中搜尋發現,在下載的OSCs氨基酸序列中,僅人的羊毛甾醇合酶1W6J和1W6K能獲得一致性大于或等于30% 的晶體模板,也僅這2個蛋白可以進行同源建模。圖2為CAS和2個模板的序列比對結果,模板覆蓋率為86%,序列一致性為49%。
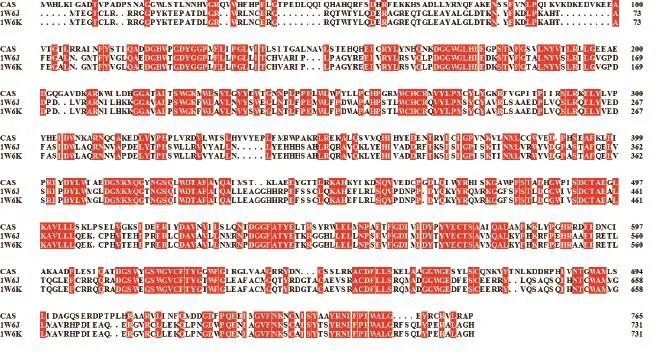
圖2 CAS與模板1W6J、1W6K的序列比對
2.1.2 模型評價 CAS模型的Ramachandran plot顯示模型中的氨基酸殘基如圖3所示,90.8%的氨基酸位于允許區,8.7%的氨基酸殘基位于最大允許區域,只有0.5%的氨基酸殘基位于扭轉角的禁止區域。模型中99.5%的蛋白質殘基的二面角都在合理的范圍之內,符合立體化學能量規則。
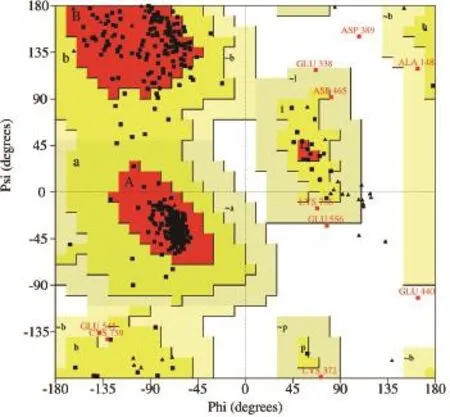
圖3 模建CAS酶的Ramachandran plot
Verify-3D是UCLA的David Eisenberg教授開發的一種基于“穿線”法的模型評價程序。該方法采用3D-1D的打分函數來檢測所構建模型與自身氨基酸序列的匹配度關系。80%殘基的Verify score大于0.2即認為模型合理。Verify-3D圖顯示了序列中每個氨基酸的打分。從圖4可知,CAS結構中的92.34%氨基酸殘基在Verify-3D中Verify score平均值大于0.2,模型通過了Verify 3D檢測,表明所建模型質量較好。
2.1.3 酶結構分析 為進一步討論建模所得模型的合理性和分析CAS的催化活性中心結構,本文對1W6J晶體蛋白結構與CAS模型進行了疊合對比。通過CAS模型與1W6J晶體結構的疊合對比分析可得(圖5),CAS酶模型與晶體蛋白間的RMSD為0.246 ?,CAS能夠與晶體模板很好重合。晶體模板上的催化中心主要由Asp455、Cys456、Cys533、Tyr503、His232關鍵殘基構成。通過疊合對比,CAS酶上的Asp491、Cys492、Cys570、Tyr540、His265殘 基 與晶體模板的關鍵殘基相互重合。
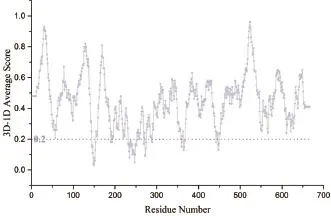
圖4 CAS的Verify-3D圖
2.2 分子對接結果
對接結果表明2,3-氧化鯊烯分子能夠結合到CAS酶的活性空腔,結合自由能為-11.15 kcal/mol。為進一步探索CAS酶對2,3-氧化鯊烯的催化機制,我們對CAS酶和2,3-氧化鯊烯的相互作用進行了分析。如圖6-A、C所示,2,3-氧化鯊烯上的環氧與CAS酶的Asp491羧酸氫原子可形成一個氫鍵,鍵長為1.8 ?,該氫鍵引發后續的環化反應。2,3-氧化鯊烯的疏水鏈與CAS酶結合空腔中的His265、Pro375、Val376、Phe480、Phe734殘基間可形成疏水作用,疏水作用可進一步加強配體與CAS的結合,有利于反應物2,3-氧化鯊烯穩定結合在酶的活性空腔中。
在CAS酶催化2,3-氧化鯊烯過程中,C27和C11間會形成單鍵,進而生成產物環阿屯醇。據此我們推測,原本環化后的C27碳正離子中間體,經過碳正離子遷移后形成C11位的碳正離子中間體(如圖6-B所示),而C27位上的氫被結合位點附近的殘基奪走,進而C27、C11形成單鍵。在2,3-氧化鯊烯與CAS酶催化位點的對接結構中,2,3-氧化鯊烯能夠進入到催化位點,且Tyr540的羥基氧原子與C27位上的氫原子間距離為3.1 ?(如圖6-C紅色虛線所示),表明Tyr540可能具有接收C27上的氫質子進而催化C27、C11成鍵的作用。
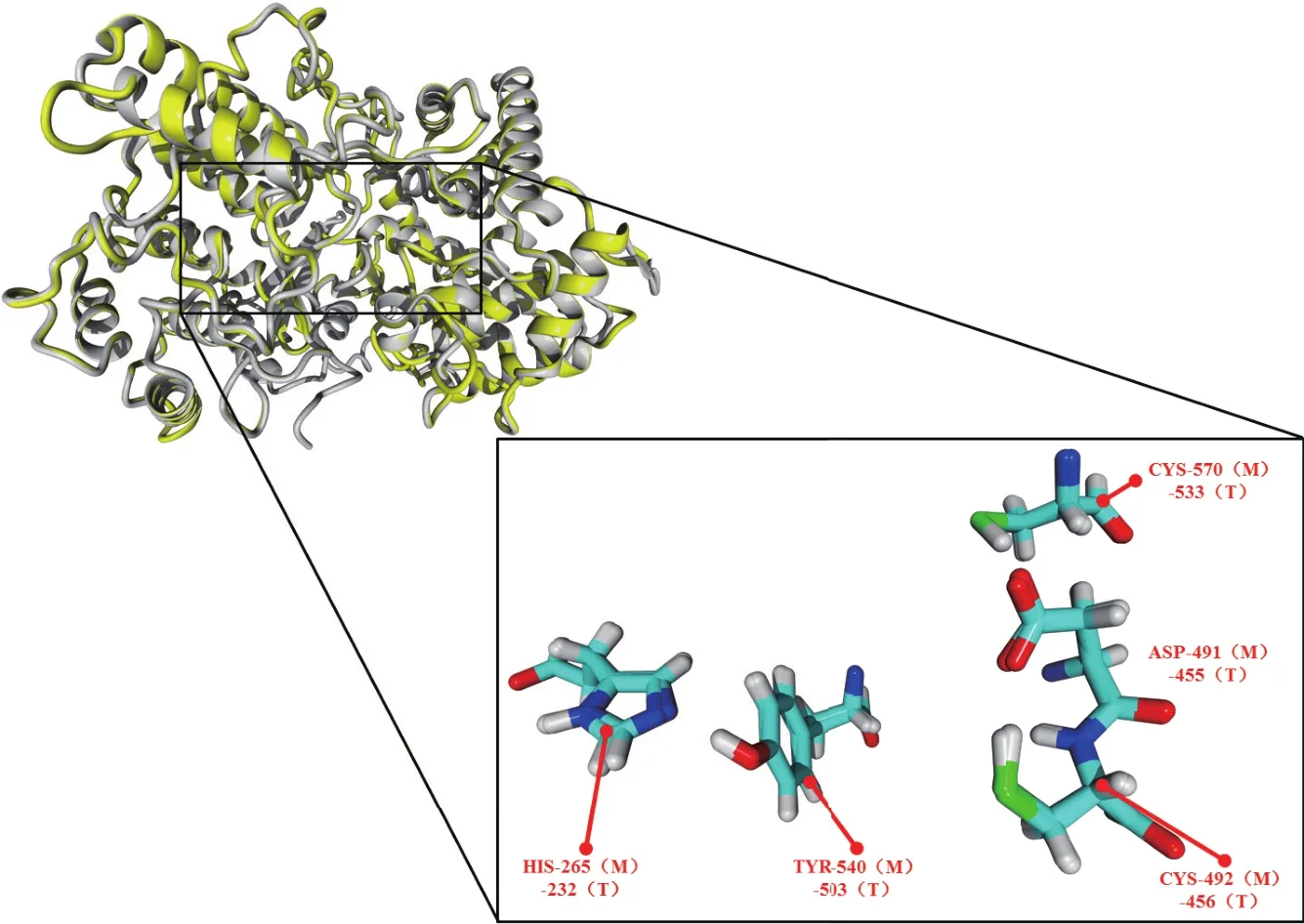
圖5 模建CAS酶與晶體蛋白1W6J的疊合圖示
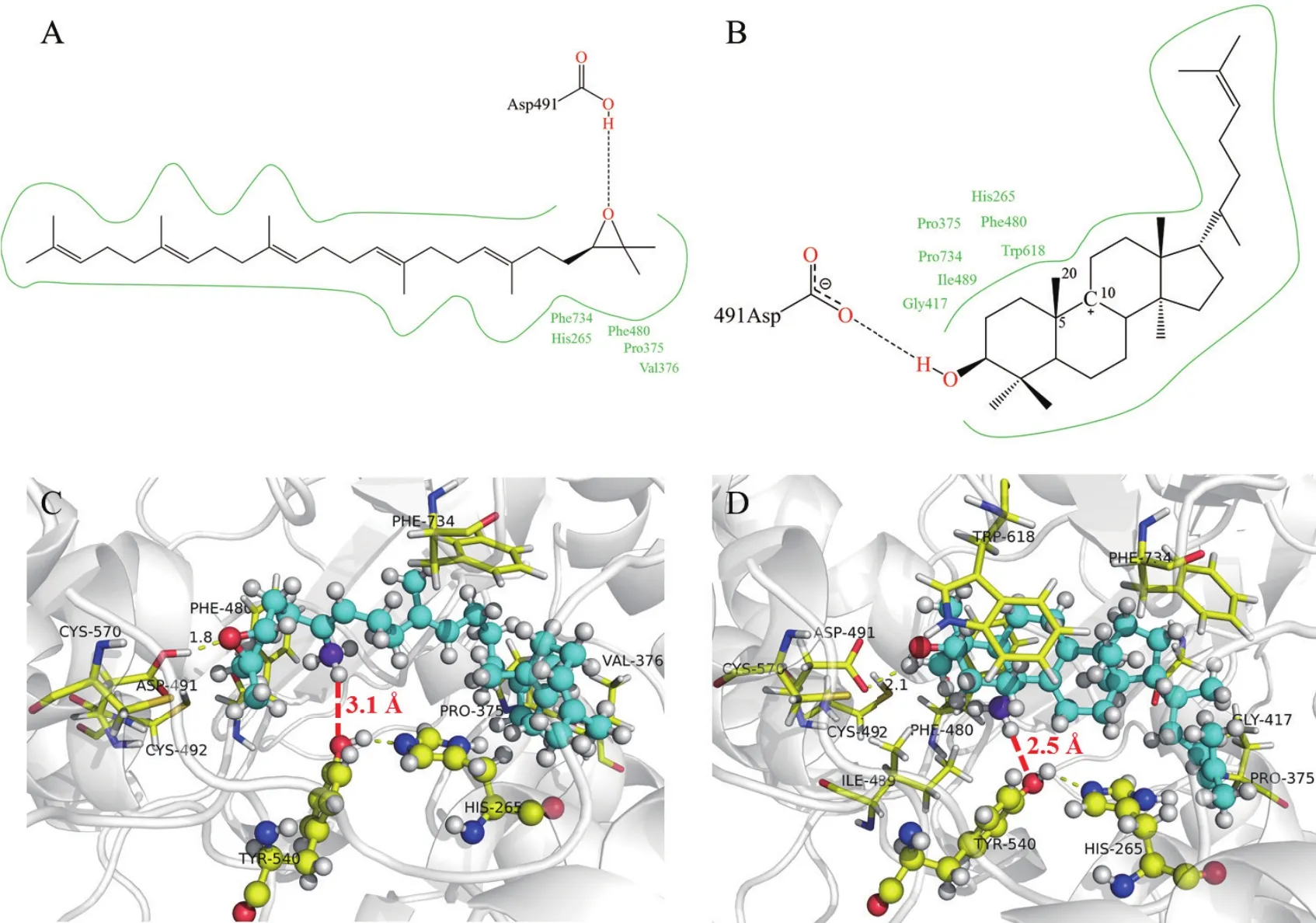
圖6 小分子與CAS酶的相互作用分析
碳正離子中間體與CAS酶的結合構象中,中間體C27原子(如圖6-D所示,C27顯示為藍紫色球型)上的一個氫原子與Tyr540的羥基氧原子的距離為2.5 ?(如圖6-D紅色虛線所示),該距離比反應物體系中的距離明顯減小,表明去質子化的Tyr540羥基氧原子可能奪取C27上的氫原子,使得C27與C11間形成單鍵生成產物環阿屯醇。
另外,我們進一步發現CAS酶活性空腔內的Tyr540殘基上的羥基氫原子能夠與His265的氮原子形成氫鍵。說明在催化過程中,Tyr540羥基上的氫原子可能轉移到His265的氮原子上,去質子化的Tyr540作為氫質子受體接受2,3-氧化鯊烯甲基上的氫原子,從而導致2,3-氧化鯊烯被催化為環阿屯醇。
2.3 催化機制推測
根據上述對接結果,本文推測CAS酶對2,3-氧化鯊烯的催化機理主要分三步完成(圖7):(1)Cys492和Cys570殘基向Asp491提供氫質子,2,3-氧化鯊烯上的環氧基奪取Asp491上的氫質子后斷裂,由于碳正離子-π電子作用(cationic-π interaction)引起四個環的環化反應形成C27正離子中間體;(2)C27正離子中間體經過一系列碳正離子重排,形成C11正離子中間體;(3)Tyr540殘基上的羥基氫原子能夠與His265的氮原子形成氫鍵,被去質子化的Tyr540奪取C27上的氫質子,進而C27與C11原子形成單鍵生成環阿屯醇。
3 討論
研究蛋白質的結構是了解蛋白質的生物學功能的重要途徑。氨基酸序列對蛋白質構象起著決定性的作用,很多同源性的氨基酸序列就可以決定同一蛋白構象,這是蛋白質三維結構預測的理論基礎[19]。目前研究蛋白質空間結構方法包括X射線晶體衍射技術和核磁共振技術,均屬于生物學實驗方法,它們能夠準確測定蛋白三維結構,但同時也存在許多技術難點,尤其是膜蛋白晶體結構難以獲得,使得OSCs蛋白方面的研究進展十分緩慢[20]。為了加快新蛋白質的結構測定及其與化合物的相互作用方式,當前通過PDB蛋白結構信息庫中搜索已知結構的同源蛋白質作為模板,利用同源建模軟件對新蛋白進行結構建模是最為常用且有效的一種蛋白質結構預測方法。隨著生物信息學的快速發展及其在生物學研究中的突出作用,蛋白質同源模建技術已經成為一種可靠性高且被廣泛認可的蛋白結構預測技術。任何一對氨基酸序列長度大于80的蛋白質,如果兩者的序列同源性超過30%,則可認為它們具有相似的三維結構,即蛋白質的基本折疊相同[21]。本研究中所用的環阿屯醇合酶基因CAS的編碼區能夠編碼765個氨基酸,在 PDB 數據庫中搜索發現蛋白1W6J和1W6K與CAS的氨基酸序列同源性高達49%。因此符合蛋白同源建模的條件,可以以此二者為模板對CAS的三維結構模型進行預測。
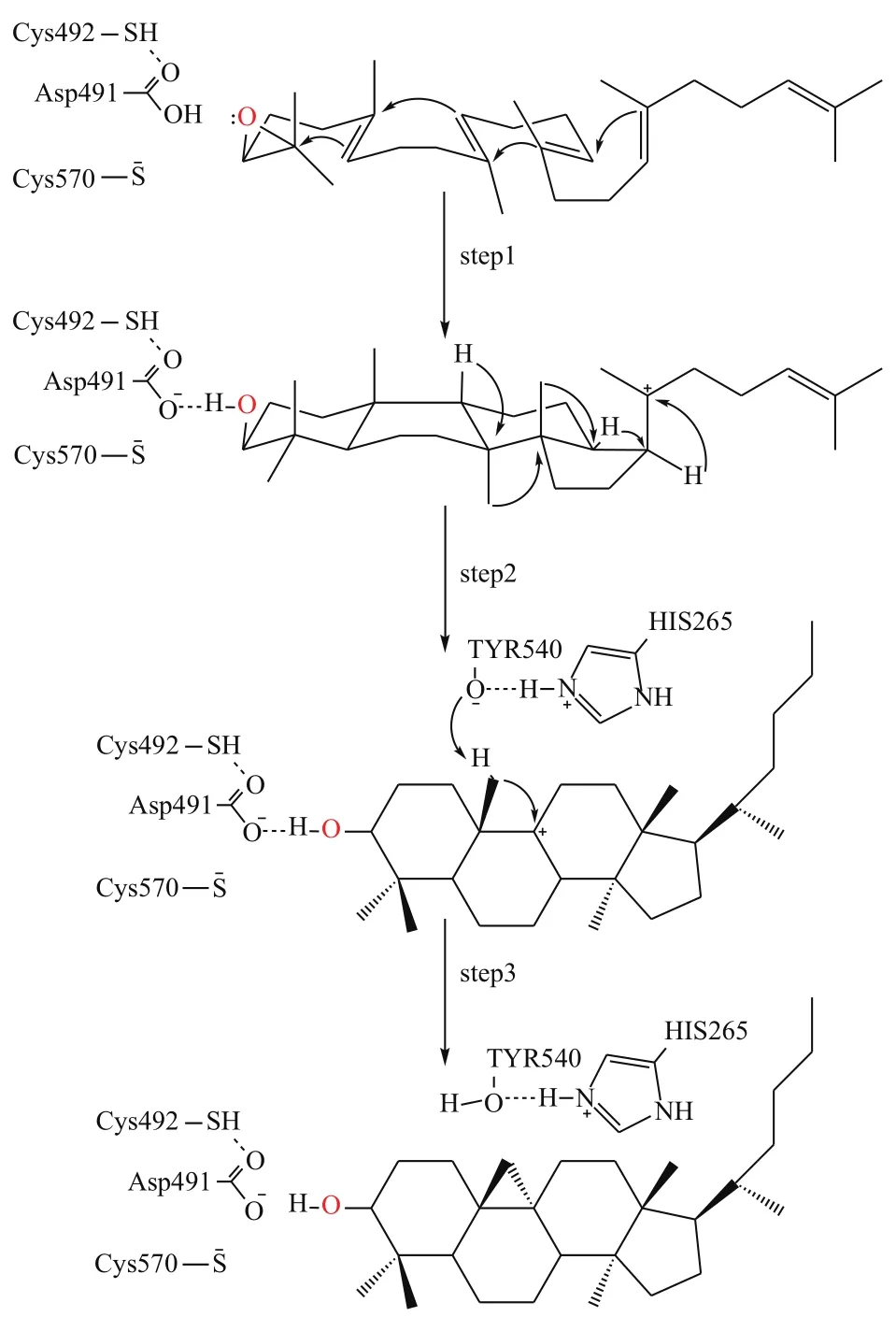
關于OSCs晶體結構及催化機制的研究較少,Thoma等[22]首次報道了人氧化鯊烯環化酶LaS的晶體結構,發現Asp455、Cys456、Cys533是催化環化形成的活性位點,而His232則是終止反應的關鍵。Wu等[23]通過蛋白同源建模發現,釀酒酵母ERG7的His234可與LaS His232疊合,后續通過實驗驗證,該位點為催化氧化鯊烯環化形成多種不同結構產物的關鍵位點;Ma等[24]通過對黃瓜中的Bi蛋白進行同源建模比對分析,推測Leu146和Tyr439為形成不同環化產物的活性位點;Hoshino等[17]也通過與LaS和SHC的同源建模闡述了催化β-AS形成的活性位點。以同源建模為基礎,分子對接則可以找到配體小分子與蛋白受體在其活性區域相結合時能量最低的構象,Major等[25]利用此技術分析了三萜類化合物BPP形成的機制。所以,利用同源建模、分子對接等計算機軟件模擬技術已成為相關氧化鯊烯環化酶的活性位點及催化機制研究的有力工具。本研究用同源建模軟件對CAS蛋白結構與其對應底物2,3-氧化鯊烯和相應碳正離子中間體的相互作用模式進行模擬,結果表明CAS酶上的Asp491、Cys492、Cys570、Tyr540、His265殘基是催化環化的關鍵氨基酸。這些研究對進一步運用生物實驗手段研究其結構和功能,為設計高活性的酶以及調控次級代謝通路有重要意義。
隨著分子生物學研究的突飛猛進,點突變技術成為一項重要的分子生物學實驗技術手段,在生物和醫學領域中的應用非常廣泛。通過同源建模和分子對接找到影響催化作用的活性位點氨基酸殘基,可很好地指導突變研究。定點突變技術已廣泛地應用于蛋白質改造及結構—功能關系研究中,如利用點飽和突變技術鑒定蛋白質功能位點,提高酶比活力,改善酶熱穩定性、底物結合特異性及立體異構特異性等多方面性質[26]。通過定點突變實驗,β-AS活性位點氨基酸的鑒別,催化機理、骨架形成的必須結構單位等研究已經取得了顯著進展,且還獲得了幾十種具有藥用潛力的目標化合物[17]。所以下一步,通過運用點突變技術對CAS關鍵活性位點進行定向改造,可獲得具有巨大商業價值的目標產物,同時通過改善酶活力、擴大催化閾值可為中藥化學成分的高效合成提供新技術。
4 結論
本文通過同源建模和分子對接技術,對CAS酶催化2,3-氧化鯊烯生成環阿屯醇的機制進行了探討。結果表明,Asp491、Cys492、Cys570、Tyr540、His265是CAS酶的關鍵催化位點,其中位于活性空腔頂部的Asp491、Cys492、Cys570通過質子化2,3-氧化鯊烯上的環氧基來激活催化反應,而位于活性口袋底部的Tyr540、His265則通過對底物去質子化形成產物來終止反應。此外,活性空腔內存在大量的疏水氨基酸,則通過疏水作用穩定反應物、中間體結合在活性空腔。據此推測CAS酶催化機制為:Asp491質子化2,3-氧化鯊烯引發四個環化反應形成C20正離子中間體,然后中間體經過一系列的碳正離子重排形成C11正離中間體,最后通過His265與Tyr540去質子化使得C27與C11原子間形成單鍵生成產物環阿屯醇。

