高血糖狀態下牙齦卟啉單胞菌對大鼠肝臟的影響*
杜 芹,孟 姝,裴心佛,4Δ
1.四川省醫學科學院·四川省人民醫院 口腔科(成都 610072);2.電子科技大學附屬醫學院(成都 610054);3.四川大學華西口腔醫院 牙周科(成都610041);4.上海交通大學附屬新華醫院 口腔科(上海 200240)
牙周炎是牙齦的慢性炎癥,是口腔內最高發的感染性疾病之一[1]。牙周炎和糖尿病為雙向關系,許多研究[2]證明在糖尿病基礎上,牙周疾病會加重胰島素抵抗,但其分子生物學機制目前尚不清楚。牙齦卟啉單胞菌(porphyromonasgingivalis,P.g)是目前公認的主要牙周致病菌。研究[3]顯示,在高血糖狀態下,牙齦P.g可以通過口腔進入血液循環并遠處定植在肝臟內,導致胰島素抵抗,進一步加重脂糖代謝紊亂,但其機制尚不明確。
在高血糖狀態時,晚期糖基化終產物積累,導致機體糖基化終產物受體(receptor for advanced glycation end-products,RAGE)表達上升。高遷移率族蛋白l (high mobility group protein box 1, HMGBl)是真核細胞核內的非組蛋白染色體結合蛋白,在細胞損傷或受到炎癥剌激后被釋放至細胞外并誘導細胞因子釋放和招募白細胞觸發和維持炎癥反應。HMGB1是RAGE的重要配體,也是一種重要的晚期炎癥因子[4]。近年研究[5]表明,HMGBl在肝臟胰島素抵抗中也起到重要作用。本研究選取大鼠肝臟作為被研究的器官,在高血糖的基礎上,多次尾靜脈注射P.g模擬牙周致病菌長期微量入血,檢測肝細胞形態學改變及肝臟組織中HMGB1、RAGE的表達變化,分析高血糖狀態下牙周致病菌入血對肝臟的影響。
1 材料與方法
1.1 實驗動物模型
實驗選用4~6周齡雄性SD大鼠15只(四川大學華西醫學實驗動物中心提供) ,實驗前適應性飼養1周,觀察無明顯全身疾患,無失牙及進食異常,納入本實驗。
按照隨機數字表法將大鼠分為空白對照組(NC組),糖尿病組(DM組),糖尿病+靜脈注射P.g組(DM+i.v.組),每組5只。各組動物均自由飲水,自由攝食,嚴格控制飼養條件。實驗動物和實驗條件均符合國家科學技術委員會頒布的《實驗動物管理條例》及四川大學實驗動物管理條例。DM組、DM+i.v.組自第2周開始,高脂飲食誘導4周+小劑量一次性腹腔注射鏈脲佐菌素(STZ)(25 mg/kg)建立大鼠糖尿病模型。術后改為普通飼料喂養,觀察6周,記錄DM組、DM+i.v.組隨機血糖變化和體重變化,隨機血糖>13.9 mmol/L 即認為達標。DM組和DM+i.v.組建立糖尿病模型后自第7周起,DM+i.v.組尾靜脈注射P.g W83(×109CFU/mL)活菌懸液0.1 mL(每周3次,共6周),模擬P.g長期微量入血。DM組尾靜脈注射PBS 0.1 mL(每周3次,共6周)。第13周,3組大鼠全麻下處死后取肝臟。
1.2 標本制備
1.2.1 肝臟標本制備 處死大鼠后,橫膈膜下方約0.5 cm處作切口暴露腹腔,鈍性分離肝包膜后腹主動脈灌流至肝臟呈黃色。取肝臟稱重,切取肝門附近組織,4 °C生理鹽水沖洗后浸泡于4 ℃多聚甲醛溶液中固定。固定好的肝臟標本,置入梯度酒精慢脫水,常規石蠟包埋。制備切片,涂有黏附劑的玻片上,烘干。
1.2.2 HE染色 取肝切片組織切片,進行常規HE染色,光鏡下觀察組織病理學變化。
1.2.3 免疫組化染色 按試劑手冊步驟操作,染色結果統一曝光時間及亮度,BX53顯微鏡和照相系統(Olympus,Japan)隨機選取400倍高倍鏡下的5個視野進行拍攝。Image J 1.51處理圖片,統一圖片背景、閾值,計算出每個視野面積中陽性表達面積所占百分比(%Area),取平均值。
1.3 統計學方法

2 結果
2.1 大鼠肝臟組織組織形態學觀察
NC組、DM組和DM+i.v.組大鼠肝臟組織經HE染色均未見明顯的肝細胞脂肪變性或空泡樣改變,或者其他明顯的肝臟實質病變(圖1)。

圖1 3組大鼠肝臟組織HE染色
2.2 大鼠肝臟組織HMGB1、RAGE免疫組化染色
NC組,DM組,DM+i.v.組HMGB1、RAGE免疫組化陽性染色為棕色顆粒。
NC組HMGB1、RAGE的免疫組化染色基本沒有發現陽性細胞;DM組HMGB1免疫組化染色可見細胞核棕染,染色相對DM+i.v.組較淺,RAGE廣泛陽性表達,染色深淺與DM+i.v.組類似;DM+i.v.組HMGB1免疫組化染色陽性表達最廣泛,染色最深,RAGE也可見廣泛陽性表達。HMGB1表達多位于細胞核內,但尚未出現明顯胞外表達(圖2)。

圖2 3組大鼠肝臟組織中HMGB1、RAGE的表達
注:A:HMGB1在NC組中表達情況;B:HMGB1在DM組中表達情況;C:HMGB1在DM+i.v.組中表達情況;D:RAGE在NC組中表達情況;E:RAGE在DM組中表達情況;F:RAGE在DM+i.v.組中表達情況
2.3 肝臟組織免疫組化染色HMGB1、RAGE陽性表達面積平均百分比比較
DM+i.v.組 HMGB1陽性表達面積高于DM組(P<0.05),并且顯著高于NC組(P<0.01);DM組和NC組比較,差異無統計學意義(P>0.05)。DM+i.v.組和DM組RAGE陽性表達面積百分比組間比較,差異無統計學意義(P>0.05),但均高于NC組,差異有統計學意義(P<0.05)(圖3、表1)。

圖3大鼠肝臟組織HMGB1,RAGE免疫組化染色平均陽性面積比率直方圖。
注:A.肝臟HMGB1陽性面積比率;B:肝臟RAGE陽性面積比率
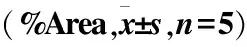

組別HMGB1RAGENC組0.46±0.581.45±2.11DM+i.v.組5.69±5.007.35±4.80P<0.0010.016DM組2.72±2.847.80±6.65DM+i.v.組5.69±5.007.35±4.80P0.013 0.830NC組0.46±0.581.45±2.11DM組2.72±2.847.80±6.65P0.4410.027
3 討論
許多研究證明牙周疾病是引起胰島素抵抗及加重糖尿病的危險因素之一,但具體機制尚不明確。牙齦 P.g是牙周炎病變區域或活動部位最主要的優勢菌,與牙周炎治療后復發或病情繼續加重有關。目前有許多研究提示口腔內P.g可能會遠處轉移至肝臟。Ishikawa 等[3]用P.g感染小鼠口腔,在小鼠肝臟細胞中發現P.g的存在,且肝臟中的P.g為活細胞,能夠被培養,感染P.g能夠調節肝糖原合成,使小鼠血糖升高;其發現高血糖能夠促進P.g遠處轉移至肝細胞中,但原因并不明確。另一項研究[6]發現,在非酒精性脂肪性肝病(NAFLD)和非酒精性脂肪性肝炎(NASH)患者中,口腔內P.g的檢出率均大大高于正常人,且在感染P.g的NAFLD人群中,糖尿病的發病率增加。同時發現P.g與變異鏈球菌、血鏈球菌、唾液鏈球菌具有獨特增加體重和肝臟重量的特點。非酒精性脂肪性肝病為過剩的脂肪酸及脂代謝失衡導致肝組織中脂肪沉積,與糖尿病同為代謝性綜合征的重要組分,二者聯系密切。在另一項個案[7]報道中,研究者報告一位肥胖的非酒精性脂肪性肝炎合并嚴重牙周炎患者因敗血癥死亡后,解剖發現其肝細胞內有牙齦P.g定植。追蹤其病史發現嚴重的牙周感染與其肥胖史時間一致。以上研究提示P.g能夠遠處轉移至肝臟,且更傾向于在脂、糖代謝異常的高脂肪肝臟中聚集,進一步影響肝糖原合成,加重肝臟的胰島素抵抗。
HMGB1是一種重要的晚期炎癥介質[8],在細胞損傷或受到炎癥剌激后被釋放至細胞外,誘導細胞因子釋放和招募白細胞觸發和維持炎癥反應。HMGBl的主要受體是RAGE[9]和Toll樣受體(toll-like receptor, TLR),如TLR-2、 TLR-4和 TLR-9[10-11]。研究[12]表明HMGBl在多種肝損傷疾病中的表達水平升高。如在NAFLD的早期階段,HMGBI-TLR4-MyD88信號轉導通路起重要作用。Alisi等[13]證實在兒童NAFLD患者中HMGB1的循環水平升高,且其升高程度與肝炎和肝纖維化的嚴重程度密切相關。
本研究發現DM+i.v.組大鼠接受6周P.g菌懸液的微量注射期間,沒有觀察到大鼠的生活狀態下降,無大鼠死亡,說明牙周致病菌入血對機體影響較為溫和。肝細胞形態學未發生改變,說明肝臟的炎性狀態尚未達到肝臟實質性病理損害的程度。
RAGE表達在DM+i.v.組、DM組間比較,差異無統計學意義,和兩組都是糖尿病背景有關。DM+i.v.組在長期靜脈注射P.g后,HMGB1組陽性表達面積明顯高于NC組(P<0.01),并且在DM+i.v.組和DM組RAGE表達無差異的情況下,DM+i.v.組HMGB1表達也高于DM組(P<0.05),說明牙周致病菌長期微量入血,會刺激肝臟組織中HMGB1表達上調,導致肝臟出現炎癥狀態。由于RAGE表達在DM和DM+iv兩組間比較,差異無統計學意義,推測HMGB1信號通路為其他途徑,其具體機制尚需進一步研究。6周P.g菌懸液注射后,發現DM+i.v.組肝組織中HMGB1的高表達多位于細胞核內,還未出現明顯的胞外表達,與肝細胞病理切片結果一致,也說明還沒有到達病理性肝損傷的地步。
綜上所述,本研究表明,在高血糖背景下,靜脈注射P.g能夠導致大鼠肝臟組織內炎癥因子HMGB1異常高表達,其表達顯著高于DM組和NC組,說明P.g長期微量入血,可能引起肝臟的炎癥狀態,但其具體機制尚需進一步研究。