創新生物科技對豬營養和豬肉生產效率改進的推動作用
■伍國耀
(美國德克薩斯州農工大學動物科學系,大學城 77843)
豬肉為消費者提供高品質的動物性蛋白質,并且在中國和美國、加拿大、日本、歐盟等其他國家深受大眾的喜愛。任何品種豬的生產性能(如:生長速率、飼料效率、產仔數和肉品質)均取決于基因(DNA分子和遺傳物質的功能單位)、環境因素(如:營養、環境溫度、毒素和疾病),以及基因與環境的互作(圖1)。基因(基因型)是豬的生長、泌乳、繁殖和其它生產性狀的基礎。然而,只有在有利的環境條件下,例如最佳的營養物質供應(能量、氨基酸、碳水化合物、維生素和礦物質)、舒適的環境溫度、高品質空氣和潔凈的飲用水,基因才能表達出理想表型。
豬肉生產的主要目標是實現豬的繁殖、泌乳、生長(包括骨骼肌中蛋白質增加)和抗病能力的遺傳潛力,同時防止白色脂肪組織的過度沉積以及減少氮和礦物質等廢物的排泄(Wu等,2014)。在過去的60年里,不斷改良的動物育種、營養和管理,極大的提高了豬肉的生產效率;例如,Boyd等(2012)報道,美國生長豬料重比[飼料消耗量(kg)/胴體增重(kg)]從1959年的6.6下降到2009年的4.4,在期間的50年里下降了33%;同時碳排放量(kg CO2e/lb胴體)下降了35%。然而豬產業仍面臨諸多挑戰,首先,豬胚胎死亡率高、宮內生長受限和斷奶仔豬死亡率高(Ji等,2017);第二,日糧能量易被用于生長肥育豬的皮下白色脂肪組織的自發和快速沉積(Wu等,2018);第三,豬對植物性蛋白質、礦物質和纖維的消化能力較弱;第四,豬(尤其是妊娠期、泌乳期、生長期和繁殖期)對熱應激和傳染病的高度易感性;第五,豬生產中迫切需要抗生素的替代品(Yu等,2018)。因此,需要不斷提高飼料利用效率、降低生產成本,以提高全球豬肉產業的經濟效益。解決這些問題的重要方法之一是使用新的生物技術,包括克隆、基因工程(獲得轉基因動物)、基因編輯、疫苗生產和飼料原料的微生物發酵。
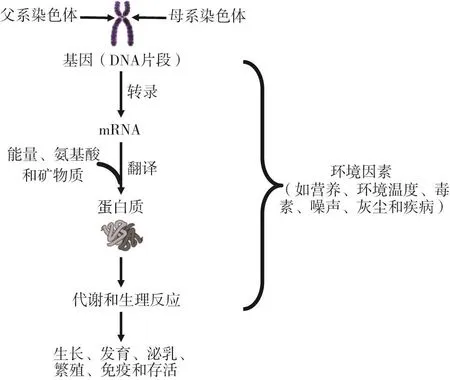
圖1 基因在豬的生長、發育、泌乳、繁殖和健康中發揮的作用
1 染色體、基因和等位基因
細胞是動物、植物和微生物的基本單位,對細胞的認識是理解生物技術的必要條件。動物細胞和細菌包含細胞膜、細胞質和細胞核,然而大多數動物細胞還包含線粒體。在動物體內,日糧營養物質和生物能的轉化需要細胞質和線粒體(主要動力室)的參與;然而在細菌內,這一過程僅在細胞質內通過糖酵解作用完成。能量供應對于細胞的完整性和功能具有重要作用。細胞核一是DNA合成和存儲的場所;二是含有攜帶長鏈DNA分子和相關蛋白的染色體;三是DNA引導RNA合成的場所;四是控制蛋白質合成和細胞增殖的場所。因此,細胞核對于開發新的生物技術用以改變蛋白質(包含酶和細胞組分)和多肽(包含疫苗和抗菌劑)的生產具有重要意義。
家豬有38條染色體,排列為19對(每對2條染色體,分別來自父母本),包括一對性染色體(雌性的XX染色體和雄性的XY染色體)。這和人類有23對染色體形成對比(總共46條染色體)。每條染色體包含不同的DNA片段(即遺傳的基本單位:基因)供細胞進行蛋白合成,從而控制生物體的功能。DNA雙螺旋分子由脫氧核糖、磷酸和堿基:腺嘌呤(A)、胞嘧啶(C)、鳥嘌呤(G)和胸腺嘧啶(T)組成,堿基通過離子鍵進行配對(A-T和 G-C)。豬的整套染色體包含了它的所有基因(即為基因組),它的一個特征是由位于染色體對的相同位置(基因位點)的兩種形式的同一基因(等位基因)所控制,從父母那里各遺傳一個等位基因。等位基因的顯隱性控制單一性狀,這為保護豬的遺傳物質和插入新基因提供了基礎。
數量性狀位點(quantitative trait locus,QTL)是與表現型(如增長率、窩產仔數和產奶量)變異相關的DNA片段。例如,Andersson等(1994)報道了位于4號染色體上的QTL,可以調控豬(歐洲野豬與大白雜交)從出生到體重達70 kg期間的生長發育、小腸長度和脂肪沉積。此外,在豬的8號染色體上的QTL被鑒定為分泌的磷蛋白1(secreted phosphoprotein 1,SPP1,osteopontin骨調素),用于調控產前成活率和窩產仔數(Allan等,2007);并且,現在認為這種蛋白是通過豬的胎盤來調節離子和水的轉運(Johnson等,2013)。QTLs通過識別與觀察到的特征相關聯的分子標記進行映射,如單核苷酸多樣性(single nucleotide polymorphisms,SNPs)。基因標記是一段與影響性狀相關的DNA序列,在豬生產上具有重要經濟價值。迄今為止,隨著RNA-Seq技術(也稱為下一代測序)的成熟,基因組生物學已經超越了傳統的基因組測序,來定義有機體的整個轉錄組(Wickramasinghe等,2018)。現在,這一突破性技術越來越多地用于動物體內基因表達的分析和SNPs的發現。可以比較和識別對某些疾病具有耐藥性或易感性的基因組,或比較和識別具有高或低生產性能(如:產奶量、肌肉生長率和飼料轉化率)的動物,以達到改善豬在不同生長階段的健康和生產性能的目的。
2 豬營養與生產中的生物技術
生物技術是指在生物學研究和應用中使用的技術。從廣義上講,生物技術可以歸類為動物克隆(通過胚胎細胞核移植和體細胞核移植)和基因工程(重組DNA技術、基因編輯和轉基因動物生產)(Bazer等,2012)。動物克隆是指通過無性繁殖來生產基因相同的個體以保存遺傳物質,這就像自然界中誕生同卵雙胞胎一樣。克隆也可以通過胚胎分割完成,通過將4細胞胚胎中多達4個單個卵裂球轉移到4個不同的受體母體中。相比較而言,添加、去除或重排DNA以修飾表型性狀的生物技術稱為基因工程或基因轉移。克隆和基因工程是兩種不同的技術,但可以組合用來生產特殊的個體動物(例如用于器官移植的α-1,3-半乳糖基轉移酶基因敲除的基因修飾豬)。
2.1 克隆動物
2.1.1 基本過程
“克隆”主要指生物體通過自身的細胞形成相同的后代個體。當供體細胞(如成纖維細胞)來源于早期胚胎時,克隆被稱為胚胎細胞核移植(embryonic cell nuclear transfer,ECNT),當供體細胞(如皮膚細胞)來源于胎兒、幼齡或成熟動物時,克隆稱為體細胞核移植(somatic cell nuclear transfer,SCNT)。從根本上說,克隆主要將供體細胞的細胞核轉入到成熟的無核卵母細胞中(細胞核被去除的卵母細胞)(見圖2)。實際上,核轉移可以通過以下方式完成:①融合,微操作進入透明帶內的卵周隙,再通過電融合使兩個細胞進行融合;②直接通過顯微注射法,將細胞核、細胞核與部分細胞質或者整個供體細胞注入受體卵母細胞;③通過微操作或酶催化法去除受體卵母細胞的透明帶,然后通過電融合或化學方法將供體細胞進行融合(Bazer等,2012)。無論哪種方式形成新的卵母細胞,通過在試管中發育成早期胚胎,然后植入成年雌性動物的子宮。最終,成年雌性動物產下與供體胚胎或體細胞動物相同基因組成的動物。這種與親本細胞基因相同的動物被稱為克隆動物。在家畜上,1996年著名“多莉”綿羊的健康誕生主要利用的是體細胞核移植技術(Wilmut等,1997)。
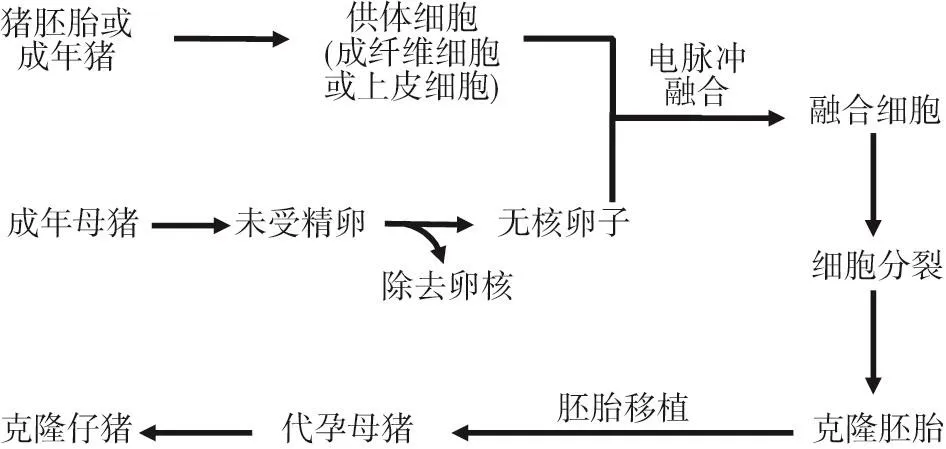
圖2 通過胚胎或成年供體細胞克隆豬的方案
動物科學家已經有大約40年的克隆經驗。1979年通過在試管中分割小鼠的胚胎,然后將此胚胎植入成年雌性小鼠的子宮中,首次獲得基因相同的小鼠。1997年公示蘇格蘭動物科學家用來源于6歲母羊的乳腺細胞作為供體細胞,經過276次嘗試后成功地培育出一只名叫多莉的羔羊。通過直接將豬胎兒成纖維細胞的核注入無核卵母細胞,隨后通過電刺激誘導其發育,Onishi等(2000)將110個克隆胚胎轉入到四頭代孕母豬,培育出一個正常的雌性仔豬。利用體細胞核移植技術,Betthauser等(2000)從兩頭母豬中培育出四只健康的雄性仔豬。值得注意的是,自然出生或由克隆生產的基因相同的動物表型不一定相同。這主要是因為表觀遺傳因素和環境因素(如營養、環境溫度和空氣質量)也會影響細胞的基因表達。
2.1.2 優勢
克隆技術在保護品種或物種(特別是瀕危物種)方面具有明顯的優勢,從而維持或增加種群的遺傳多樣性(Bazer等,2012)。克隆技術還可以讓擁有優良性狀(例如:肉質好、生長快,瘦肉率和飼料轉化率高)的被閹割的雄性動物將遺傳特性傳給后代。在畜牧業,克隆主要用于生產優良種畜。2018年美國食品和藥物管理局認為“克隆牛、豬、羊所生產的肉和奶以及傳統上用于食用的任何物種的克隆后代,與傳統育種動物生產的動物產品一樣都可以安全地食用”。如前所述,用克隆豬為某些疾病的患者提供可以移植的特殊器官的研究受到越來越多的關注(Prather等,2013)。因此,克隆不僅可以用于生物醫學和農業研究,也可用于制藥生產和自然遺傳保護。
2.1.3 弊端
體細胞核移植仍然是一個操作難度大且成本高昂的技術(Tan等,2016)。動物克隆的主要缺點是培育后代的效率較低、健康狀況不佳并且后代的存活率較低。這可能是因為:①不適當地將供核DNA重新編程為具有正常新陳代謝的表型;②不適當干預胚胎或胎兒與受體母親子宮之間的相互作用。值得注意的是,只有1%到20%的受孕母親可以正常妊娠;25%的懷孕母親會發生水腫(水腫是胎兒的一種病癥,其特征是至少有兩個胎兒的腔室內有液體積聚,尿囊和羊膜腔內分別積累過量的液體形成水腫尿囊和水腫羊膜);20%~25%的子代發育異常;新生兒死亡率高(例如:有30%~40%的犢牛在出生后150 d內死亡)(Bazer等,2012;Betthauser等,2000;Onishi等,2000)。雖然克隆的過程非常明確,但由于各種復雜因素,包括細胞融合、胚胎發育、母體子宮功能等,導致結果并不完全可以預測。由于其效率低下,克隆技術不適用于大量生產人類消費的經濟肉類。
2.2 基因工程
2.2.1 重組DNA技術
重組DNA(rDNA)分子是由兩個或多個來源的遺傳物質通過實驗室方法形成的DNA分子(Nagaich,2015)。用于構建重組DNA分子的DNA序列可以來源于任何物種(包括細菌、植物和動物)。重組DNA分子也被稱為嵌合DNA,因為它們通常由來自兩個不同物種的遺傳物質組成(如豬和細菌)。重組DNA技術與基因重組的不同之處在于前者是在試管中由人工方法產生的,而后者是細胞內DNA序列交換和重新組合的一個正常生物學過程。重組DNA技術的基本方法是將目的DNA片段(例如:豬的DNA序列)插入到載體(DNA分子或質粒)中,重組DNA分子能夠在宿主細胞(例如:大腸桿菌)中自主復制。除質粒(來自細菌的環狀DNA分子)外,其他最常用的載體(非染色體DNA)包括病毒和酵母細胞(Adrio等,2014;Bazer等,1991;Jazayeri等,2018)。攜帶豬源DNA序列的重組DNA分子可以在大腸桿菌宿主細胞內快速復制,產生大量的重組DNA,進而合成目的蛋白質或多肽(見圖3)。
2.2.1.1 優勢
重組DNA技術應用廣泛。例如,它可以編輯單個基因位點而不影響基因組的其余部分,對基礎研究、醫學和農牧業具有很大的價值,也是生產轉基因動物的技術基礎(包括豬)(Hammer等,1985)。此外,科學家還可以利用重組DNA技術在細菌(如大腸桿菌)中表達蛋白質(包括干擾素、激素和酶制劑)、肽、疫苗、氨基酸、脂肪酸和維生素(見表1)。這種生產方式成本低,效益高。例如,飼料級氨基酸的使用可以大幅度降低日糧中蛋白質水平,從而減少氮的排放。日糧蛋白質水平降低1%(例如,從16%至15%)可以使生長豬的氮(尿液和糞便)排放總量減少8.5%(Lenis等,1999)。此外,重組DNA技術還可以對細菌基因組進行編輯:①生產用于飼料發酵的酶(Demirci等,2014);②生產可以減少細菌耐藥性的酶(da Costa等,2018);③開發疫苗,使用特異性的單克隆抗體分離抗原,通過克隆基因合成蛋白質抗原以及合成肽疫苗(Nagaich,2015)。
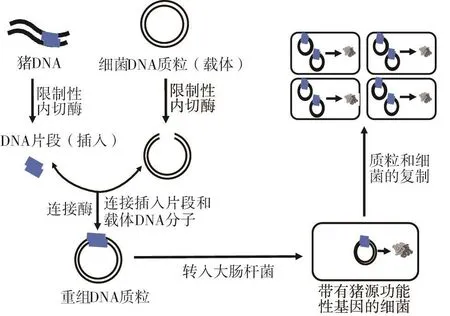
圖3 DNA重組技術

表1 重組DNA技術在細菌合成蛋白質、疫苗、氨基酸和維生素方面的應用
2.2.1.2 弊端
由于目前研究還尚不完善,一些人擔心使用重組DNA技術生產的蛋白質(例如重組牛生長激素)以及其副產物的安全性。動物基因組中基因的插入或敲除都可能會影響生物體的基因功能及其穩定性。最后,體外培養方式不一定實現重組分子中基因的高轉錄和翻譯效率,還需要開展更多的工作來解決這些問題。
2.2.2 轉基因動物
通過新的生物技術可以獲得生殖系和非生殖系轉基因動物。異位DNA移植(非生殖系轉基因)是指直接將DNA構建體或轉基因干細胞導入胎兒或活體動物的非生殖組織中獲得轉基因動物,但其轉基因性狀不能通過配子遺傳給后代(Bazer等,2012)。生殖系轉基因是本文的重點內容(見圖4),轉基因動物實質上是基于生化反應、細胞生物學、細胞培養、胚胎移植以及胎兒在受體母畜內的生長發育獲得的。
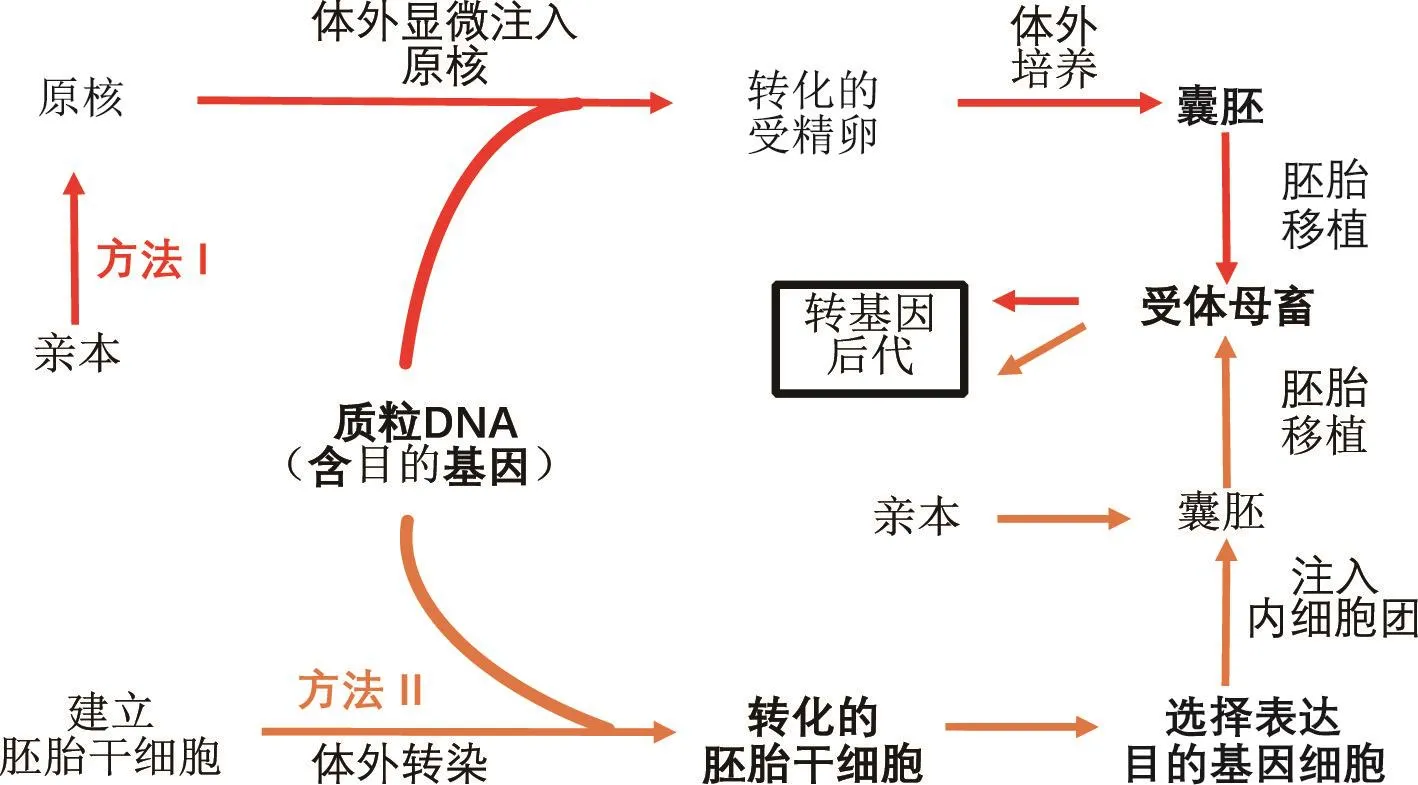
圖4 將重組DNA注射到原核中(方法Ⅰ)或將含有重組DNA的胚胎干細胞注射到囊胚中來獲得轉基因動物(方法Ⅱ)
轉基因動物,即基因組中整合人為插入的外源基因的一類動物,外源基因是用DNA重組技術在體外構建,質粒DNA不僅包含目的基因,還包含其它DNA序列,包括啟動子片段(為確定基因表達時間和基因靶向位置),增強子序列(放大基因功能)和標記基因(外源DNA的整合檢測)。然后通過兩種已建立的方法之一,將DNA構建體整合到動物生殖細胞基因組中:①將重組DNA(也稱DNA構建體)注射到原核(方法Ⅰ);②將含有重組DNA的轉化胚胎干細胞注入囊胚(方法Ⅱ)。由于缺乏來自豬胚胎干細胞的已建成的細胞系,迫使科學家們不得不采用方法Ⅰ(體細胞的基因修飾和體細胞核移植用以生產轉基因的豬)(Ryu等,2018)。
第一種方法是快速收集受精后的卵母細胞,通過精細的顯微注射針將重組DNA(如:目的質粒DNA)注射至原核,這也是最常用的方法(Hammer等,1985);或者,在卵母細胞胞質內注射轉染有目的質粒DNA的精子(Lai等,2001),受精卵在體外發育至囊胚,后被移植至受體,發育至成熟。轉基因后代的一些個體包含已被整合到其自身基因組的重組DNA,這些外源基因存在于生殖細胞和體細胞中,所以它可以通過育種遺傳給后代(Hammer等,1985)。第二種方法是通過胚胎干細胞將基因導入動物體內,來源于早期胚胎的胚胎干細胞,既能實現自我更新,又能保留細胞多能性,移植到早期胚胎中能夠對生殖細胞實現基因靶向(Tan等,2016)。簡而言之,即從早期胚胎中分離胚胎干細胞用于培養以建立細胞系,隨后通過細胞轉染(如電穿孔法)將重組DNA(如目的質粒DNA)導入基因組。選擇穩定轉化的胚胎干細胞,然后注射到受體囊胚的內細胞團中,以參與囊胚發育成早期胚胎。第一種方法是將基因組中含有重組基因的胚胎導入受體中發育,將雜合轉基因后代進行交配以產生純合子轉基因系。由于家畜的胚胎干細胞尚未被分離出來,導致方法Ⅱ在家畜中的使用并不多(Tan等,2016)。值得注意的將克隆和轉基因技術相結合,使供體體細胞可以通過電穿孔法或病毒載體進行基因整合,再通過體細胞核移植法產生轉基因后代。
2.2.2.1 優勢
在家畜育種中,轉基因動物技術將外源基因導入動物生殖系中以構建理想性狀(例如獲得高瘦肉率和高飼料效率)和功能(例如合成具有營養作用的蛋白質)。這一技術成功獲得了多種轉基因動物,包括豬、小鼠、大鼠、牛、兔、綿羊、雞和魚(Bazer等,2012)。為彌補傳統育種技術的不足,可以通過增強以下因素來提高畜牧業生產效率:①日糧營養物質的消化、吸收和利用;②對代謝性疾病和傳染病的抵抗力;③生活環境適應性(Prather等,2013;Shoji等,2008;Tiley,2016)。
轉基因動物可以產生必需脂肪酸(Pai等,2014)、氨基酸、治療性蛋白質(J?nne等,1992)、功能性蛋白質(Wang等,2017)以及消除抗營養因子的酶(Zhang等,2018),可以提高營養利用效率,減少農場動物數量以及緩解氮和磷排放導致的環境污染。轉基因動物可生產:①對引起乳腺炎的細菌具有抑菌特性的溶菌酶(Lu等,2015);②具有廣譜抗菌活性的人和牛乳鐵蛋白(Wang等,2017);③乳汁中獲得的疫苗(如有效的瘧疾疫苗)(Stowers等,2002)。
作為原理驗證,Hammer等獲得了表達人生長激素的轉基因豬(Hammer等,1985)。幾年后,獲得了轉基因豬高效表達牛生長激素或生長激素釋放因子,極大地提高了轉基因豬的生長速率和飼料利用效率,同時降低體脂含量和血漿膽固醇水平(Pursel等,1989;Solomon等,1994)。然而,這些有益性狀卻被繁殖性能低下、疾病發作(如關節炎、胃潰瘍、皮炎和腎病)和過早死亡等負面影響所抵消(Pursel等,1989)。轉基因動物的這些不良影響的發生是由于對以下方面的理解不完全所致:①胚胎培養的條件(如培養基中營養物質的組成,包括氨基酸、葡萄糖、礦物質和維生素等);②負責正常表達模式的調節因子;③外源DNA整合位點;④特定基因產物的生理功能。為了實現轉基因動物的經濟價值和生產,必須進行大量的研究來解決這些問題。
獲得可以合成必需多不飽和脂肪酸的轉基因豬是研究轉基因動物的期望結果之一。例如,Saeki等將植物基因Δ12脂肪酸去飽和酶導入豬的白色脂肪組織(Saeki等,2004),該酶在C12位點上去除飽和油酸(18∶1,ω9)生成亞油酸(18∶2,ω6),亞油酸是豬的營養必需多不飽和脂肪酸(Wu等,2018)。同時亞油酸是合成花生四烯酸(20∶4,ω6)的前體物,花生四烯酸也是豬的必需多不飽和脂肪酸;此外,亞油酸有益于人類和豬的心血管健康。還有一種轉基因豬可以表達秀麗隱桿線蟲(C.elegans)基因脂肪酸去飽和酶,將亞油酸轉化為ω3多不飽和脂肪酸(Lai等,2006)。與野生型豬相比,轉基因豬具有的四種ω3多不飽和脂肪酸含量更高,即α-亞麻酸(ALA,18∶3,ω3)、二十碳五烯酸(EPA,20∶5,ω3)、二十二碳五烯酸(DPA,22∶5,ω3)和二十二碳六烯酸(DHA,22∶6,ω3)。這些發現具有重要意義,當轉基因豬能夠合成ω6和ω3多不飽和脂肪酸時,可以減少甚至消除日糧中植物油(如大豆油、葵花油、花生油)以及魚油的使用,大大降低豬的生產成本。
現代生物技術的另一個期望結果是生產出在唾液腺中表達植酸酶的轉基因豬。首先獲得一種在唾液中釋放植酸酶的約克夏轉基因豬(Cassie系)(Golovan等,2001),這種轉基因豬消化植酸的能力有所提升。例如,飼喂無磷添加的普通日糧的轉基因公豬和后備母豬,與同月齡的飼喂補充磷的普通日糧的豬相比,兩者在生長速率和飼料利用效率上結果相似。此外,飼喂無磷添加的低磷日糧的轉基因閹豬,與飼喂無磷添加的低磷日糧的普通閹豬相比,在斷奶、生長和肥育階段分別增加了25%~40%、77%~91%和27%~56%的磷保留量。最近,Zhang等基于從細菌和真菌中分離的基因,獲得了一種轉基因豬,該轉基因豬可在唾液腺中表達植酸酶和碳水化合物酶(木聚糖酶和兩種β-葡聚糖酶)(Zhang等,2018),與飼喂相同日糧的非轉基因豬相比,轉基因豬口腔內可水解植酸和非淀粉多糖,使氮產量下降24%,廢物排泄減少44%。目前一些研究間的數量差異可能是由于轉基因的表達水平和日糧營養成分(包括Ca、P和蛋白質)的差異所致(Golovan等,2001;Forsberg等,2013;Meidinger等,2013)。有發展潛力之處在于,表達用于合成營養性必需氨基酸的植物或微生物的轉基因豬可以允許攝入低磷和低蛋白質日糧而無需補充磷或結晶氨基酸;其中一種氨基酸是蘇氨酸(Zhang等,2014),對滿足仔豬生長需要而言,蘇氨酸在植物源飼料中含量較低(Wu等,2013)。
2.2.2.2 劣勢
動物轉基因的原始方法,即原核注射和整合病毒的效率較低,同時會導致基因沉默,基因表達調節不良以及由于整合位點隨機而造成基因變異性較大(Tan等,2016)。動物轉基因技術的另一個主要缺陷是包括豬在內的轉基因家畜產前和斷奶前死亡率較高,這可能是由于宿主基因組中基因隨機整合的過程導致了插入誘變的結果。例如Zhang等將4 008個重建胚胎移植至16只受體母豬中,僅有33頭活仔豬出生,胚胎發育效率不足1%。在33只活產仔豬中,25只轉基因豬呈陽性,其中20只仔豬具有完整的基因表達盒。令人失望的是至斷奶時僅有9只轉基因豬存活(Zhang等,2018)。在將轉基因豬用于生產之前,必須克服這些問題,同時也要解決成本過高的問題。目前,轉基因家畜的研究主要集中在生物醫學應用上,例如缺乏負責超急性排斥反應的α-1,3-半乳糖基轉移酶基因的器官異種移植(Fischer等,2018;Kang等,2016;Tan等,2016),也用于生產抗病毒的豬。

