非小細胞肺癌組織中CRT、BAP31表達變化及其意義
周金林,鄧述愷,張仕國
(1巴中市中心醫院,四川巴中 636000;2西南醫科大學附院第一醫院)
肺癌是最常見的肺部原發性惡性腫瘤,起源于支氣管黏膜或腺體。全球肺癌的發病率和病死率均呈上升態勢,而在我國尤其明顯;目前,我國肺癌的發病率及病死率已居所有惡性腫瘤之首,其中男性發病率和病死率居第一位,女性發病率居第二位(低于乳腺癌),而病死率居第一位[1]。肺癌分為小細胞肺癌(SCLC)和非小細胞肺癌(NSCLC),其中NSCLC大約占肺癌的85%,通過傳統的治療手段,肺癌患者的5年生存率也只有15%左右,使用新的化療藥物和重組人血管內皮抑制素以及分子靶向藥物治療后,患者中位生存時間有一定延長,不過晚期肺癌患者的生存率仍然沒有大幅度提高[2]。近年來,醫學分子生物學和基因檢測技術得到了很大的發展,肺癌的免疫治療已逐漸成為肺癌治療領域研究的熱點,目前已經研究發現了PD1、PD-L1等免疫檢測點抑制劑,臨床試驗表明免疫治療可以使NSCLC的病死率得到一定程度的改善。新近研究[3]發現,在肺癌組織中CRT的表達較正常肺組織明顯升高,并且與肺癌的發生發展以及腫瘤免疫關系密切。BAP31在結直腸癌、宮頸癌及惡性黑色素瘤中明顯升高,可能與腫瘤的發生、發展有一定關系,并且與CRT關系密切;二者均有可能成為NSCLC診斷和治療的新靶點,以及預測預后的重要指標。本研究通過免疫組化法檢測NSCLC組織、正常肺組織、癌旁組織中CRT與BAP31的表達,分析其表達的差異性,探索NSCLC組織中CRT和BAP31的表達與患者年齡、性別、吸煙、病理分型、淋巴結轉移及臨床分期的關系,并且研究CRT與BAP31在NSCLC組織的表達水平有無相關性,為進一步尋找新的NSCLC生物標記物以及免疫檢測和治療靶點提供科學依據。
1 資料與方法
1.1 臨床資料 選取2015年1~12月西南醫科大學附屬第一醫院收治的NSCLC患者60例(腫瘤組),男42例,女18例;年齡35~76(57.3±9.6)歲,其中≥60歲25例,<60歲35例。納入標準:①所選病例均經病理學診斷確診為NSCLC患者;②具備完整的臨床診斷和治療資料;③排除其他肺部疾病以及嚴重的心、肝、腎和代謝性疾病,取得待測標本前均未進行放療、化療、分子靶向治療及其他針對惡性腫瘤的治療。依據WHO肺癌的組織病理學分類方法,腺癌30例,鱗癌30例;依據2014年NSCLC美國國立綜合癌癥網絡(NCCN)指南,其中將既往有吸煙史且吸煙指數(每天吸煙支數×吸煙年數)≥400支年者列為肺癌的高危人群,以此標準將吸煙指數≥400支年者的重度吸煙患者歸入吸煙者(28例),將吸煙指數<400支年者的輕中度吸煙患者、不吸煙者以及被動吸煙者歸入非吸煙者(32例);有淋巴結轉移26例,無淋巴結轉移34例;按照國際抗癌聯盟(UICC)2015年第八版肺癌分期標準,Ⅰ+Ⅱ期組39例,Ⅲ+Ⅳ期組21例。手術切取NSCLC組織60例份、癌旁組織(至少距腫瘤邊緣5 cm以上)30例份(癌旁組)。
1.2 組織中CRT、BAP31檢測方法 切取NSCLC組織、正常肺組織以及癌旁組織蠟塊,每個標本切片3張,然后進行烤片,其中2張用于免疫組化,一張用于HE染色。HE染色常規進行,光鏡下觀察染色結果,然后與免疫組化結果做對照。免疫組化染色經過脫蠟、脫苯后分別向每張切片滴加約50 μL的3%H2O2浸泡10 min阻斷內源性過氧化物酶活性,然后用PBS液沖洗兩次,隨后將切片浸入盛有檸檬酸緩沖液(pH 6.0)的高溫容器中,微波爐加熱直至沸騰后停止加熱,然后自然冷卻至室溫后取出玻片,蒸餾水沖洗2次,每次2 min,PBS液沖洗3次,每次5 min,厚滴加一抗:每張切片滴加正常山羊血清工作液進行封閉,室溫孵育30 min,然后滴加1∶100的CRT和BAP31一抗,然后進行室溫孵育3 h,PBS液浸洗3次,每次3~5 min;滴加二抗,每張切片滴加50 μL試劑盒中的免疫組化試劑,放入37 ℃的孵育箱中孵育30 min;PBS液沖洗切片,每次5 min,反復沖洗2次;然后進行DAB顯色、分化、脫水、封片,隨后在光學顯微鏡下觀察染色強度及染色細胞數。染色結果的判斷與分級:結果的判斷是根據切片的染色強弱程度以及陽性表達的腫瘤細胞數占腫瘤細胞總數百分比進行綜合評估,根據文獻報道[3],CRT主要定位于細胞質和細胞膜,其陽性表達的結果是腫瘤細胞胞質或胞膜中出現棕色或者褐色顆粒,在高倍顯微鏡(×400)下觀察切片的染色情況,隨機取10個視野的均值,對腫瘤細胞的陽性表達細胞百分比和染色強度分別進行評分,評分規則如下:(1)對組織切片中著色的陽性腫瘤細胞數與腫瘤細胞總數的比例進行評估,<10%為0分,10%~25%為1分,26%~50%為2分,51%~75%為3分,>75%為4分;(2)根據胞質的染色強度進行評分:未見顯色的評為0分,顯色為淺棕色的評為1分,顯色為褐色的評為2分,顯色為黑褐色的評為3分(染色深淺均與背景著色相對比);(3)定義上述兩項分數相乘的結果為N,N≤1分評為陰性(-),1
1.3 統計學方法 采用SPSS19.0統計軟件。計數資料比較采用χ2檢驗,相關性分析采用Spearman等級相關分析法。P<0.05為差異有統計學意義。
2 結果
2.1 兩組CRT、BAP31陽性率比較 腫瘤組、癌旁組CRT陽性率分別為88.33%、13.33%,BAP31陽性率分別為83.33%、6.67%,兩組比較,P均<0.05。
2.2 CRT、BAP31陽性表達與NSCLC臨床病理參數的關系 結果見表1。由表1可知,CRT陽性表達與NSCLC淋巴結轉移、臨床分期相關(P均<0.05)。
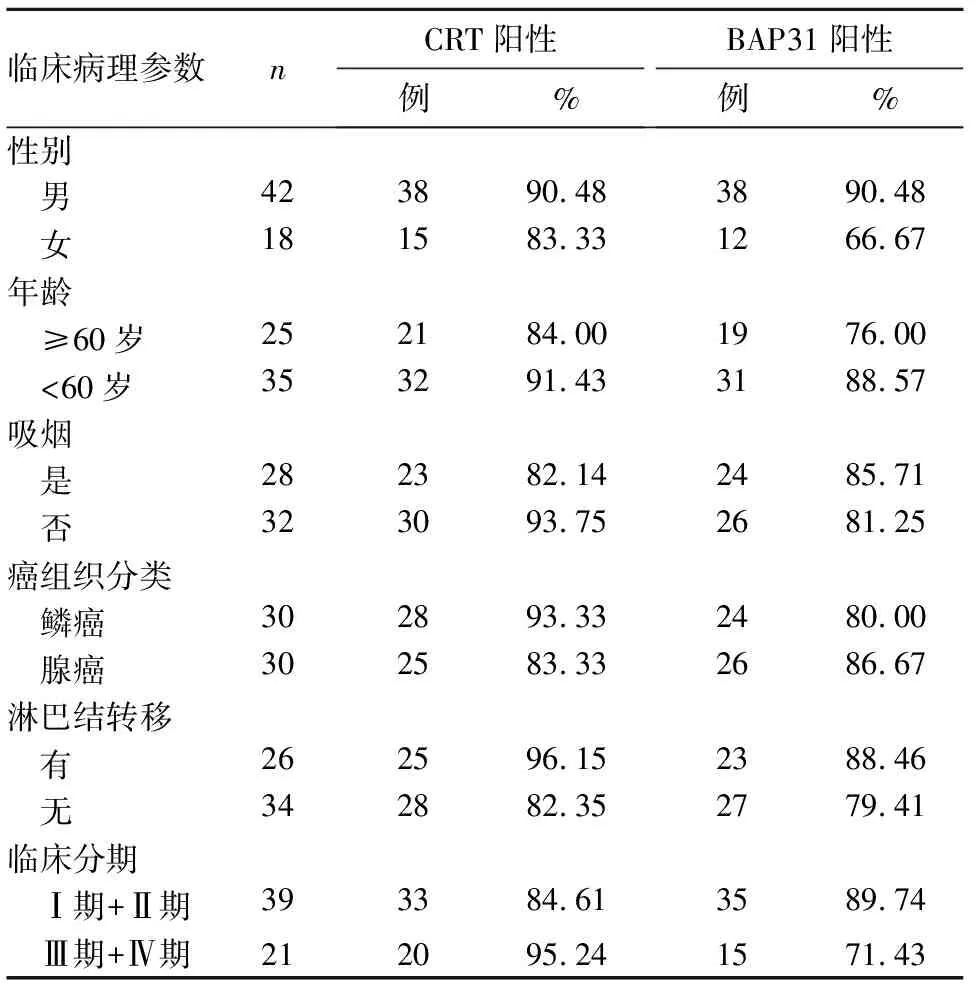
表1 CRT、BAP31陽性表達與NSCLC臨床病理參數的關系
2.3 腫瘤組CRT與BAP31表達的相關性 腫瘤組CRT與BAP31表達無相關性(r=0.400,P>0.05)。
3 討論
CRT是一種主要存在于內質網內的結構高度保守的分子伴侶和鈣離子結合蛋白,參與了人體多種生理和病理過程[6]。CRT在許多疾病中都有異常表達,例如類風濕關節炎、系統性紅斑狼瘡[7]、心血管疾病等。目前已被證實CRT在多種腫瘤組織中呈高表達, CRT在胃癌中表達升高,且高表達的CRT會導致胃癌細胞的增殖和遷移,同淋巴結轉移相關,并且具有較差的預后[8];在乳腺癌中CRT的表達明顯升高,并且惡性程度越高的細胞中CRT表達越高,Ⅲ期和Ⅳ期表達較Ⅰ期和Ⅱ期明顯升高[9];在NSCLC中,有研究報道[3]顯示:CRT在鱗癌和腺癌均呈高表達,而小細胞肺癌中CRT的表達較鱗癌和腺癌卻明顯降低;王富強等[10]采用免疫印跡的方式檢測NSCLC組織中CRT蛋白水平,結果發現CRT同NSCLC患者的淋巴結轉移和TNM分期相關,但是目前尚未見通過免疫組化檢測NSCLC患者中CRT的表達同淋巴結轉移和臨床分期的報道;研究[11]證實,CRT在NSCLC的高表達導致抗腫瘤免疫細胞(如樹突狀細胞等)的累積增加,進而引起抗腫瘤免疫反應,加強常規抗腫瘤治療(放療和化療)的治療效果,從而對NSCLC患者的預后有較大幫助。Liu等[12]研究進一步發現,CRT可以作為佐劑促進樹突細胞成熟,并且增強針對NSCLC的黑素瘤相關抗原3(MAGE-A3)的特異性細胞毒性T淋巴細胞(CTL)應答。在NSCLC中,CRT介導的效應記憶T細胞主要是CD4+T淋巴細胞和CD8+T淋巴細胞,這些T細胞更趨向效應記憶表型,效應記憶T細胞記憶的細胞毒性可以控制原發腫瘤進展和轉移,因此而被認為可以控制癌癥的進展[13];另一方面,Stoll等[14]研究發現,CRT表達缺失的NSCLC患者預后較差。
CRT通過影響細胞黏附、遷移和侵襲從而進一步影響腫瘤轉移的過程,CRT促進細胞黏附的機制主要是通過和整合素之間的相互作用而完成的,整合素的作用是連接細胞外基質和細胞內的細胞骨架以及觸發由內向外、由外向內的信號轉導,CRT結合整合素可能影響整合素-細胞骨架之間的相互作用,從而影響細胞黏附的能力[15],此外有研究證實鈣網蛋白可以通過影響胰島素受體底物1(IRS-1)磷酸化的差異而影響細胞粘附的能力[16]。由此可以看出,CRT可以通過促進細胞粘附和遷移從而影響NSCLC的發展。
BAP31是一種定位于內質網膜的多功能蛋白質,其可以通過與免疫球蛋白(mIgM和mIgD)結合而影響其功能,并且激活B淋巴細胞[17,18],參與了許多重要蛋白質在內質網的跨膜轉運,并且可以介導細胞凋亡等,但BAP31只在人體部分正常組織中低表達(除睪丸組織外)[19],其陽性產物定位于胞質,是蛋白質分子轉運過程中的重要載體蛋白。1996年,Li等[20]首次發現了BAP31在乳腺癌中表達明顯升高;隨后Yu等[21]發現,BAP31在絕大多數惡性黑色素瘤中呈高表達,其總陽性率達86.5%;我國學者董令儀等[22]研究了BAP31在結直腸癌中的表達情況,研究表明BAP31在結直腸癌中的表達陽性率為64.17%,明顯高于黏膜組織中的6.67%,高分化和沒有遠處轉移的結直腸癌患者中BAP31的表達較低分化以及有遠處轉移的患者更高,并且發現BAP31表達陰性患者的總體生存率明顯低于BAP31陽性表達的患者,說明BAP31可能參與了腫瘤細胞的發展過程,可能BAP31的高表達能夠通過一些通路阻止腫瘤細胞的侵襲和遷移,或者其介導的腫瘤免疫有利于患者的預后,這其中的機制尚未闡明,有待進一步的研究。但是,目前BAP31在NSCLC中的表達無相關研究報道。
本研究通過免疫組化法檢測CRT、BAP31在NSCLC組織中的表達,并分析其表達水平同患者年齡、性別、吸煙、病理類型、有無淋巴結轉移和臨床分期的關系,結果顯示NSCLC組的CRT和BAP31表達水平明顯升高,在正常肺組織中和癌旁組織中也有微量表達,說明CRT可能參與了NSCLC形成的過程,可能成為NSCLC的一個獨立預測因子;Ⅲ+Ⅳ期患者較Ⅰ+Ⅱ期患者CRT的表達更強,說明CRT的表達與NSCLC淋巴結轉移相關,并同TNM臨床分期相關,提示CRT可能參與了NSCLC的進展過程,之前有研究報道[10]使用免疫印跡方式檢測CRT在NSCLC的表達,發現CRT在有淋巴結轉移組較沒有淋巴結轉移組明顯升高,ⅢA期較Ⅰ期、Ⅱ期明顯升高,此結果與之前研究結果一致。因此說明CRT可能成為潛在的診斷NSCLC的標志物,并且其陽性表達與淋巴結轉移和TNM分期相關,表明其可能參與了NSCLC的進展過程。BAP31在NSCLC中的表達同一系列臨床參數無明顯相關性,這些實驗結果同前面研究報道[22]BAP31在結直腸癌中的表達結果相一致;目前,BAP31在NSCLC中發生、發展的具體機制尚未闡明,需進一步研究探討。
BAP31作為一種內質網膜蛋白,在CRT移位至細胞膜表面的過程中起了重要作用[23],BAP31是CRT膜轉位中必不可少的物質,阻斷其介導的CRT膜轉位通路,比如BAP31表達缺失的情況下,CRT將不能移位至腫瘤細胞膜表面,從而消除了腫瘤細胞凋亡的免疫原性,減弱腫瘤放療或化療引起的抗癌免疫反應。由此可以看出,CRT和BAP31在介導NSCLC的腫瘤免疫過程中起了協同作用,研究二者在NSCLC中的表達相關性可能為研究NSCLC免疫治療提供新的方向。本研究通過對CRT和BAP31在NSCLC中表達的相關性分析發現,兩者對應的總體相關系數無統計學意義,說明此兩指標無明顯相關關系,可能跟實驗樣本量偏小有關,更大樣本量以及更精細的分期的研究或許更有利于分析二者在NSCLC中表達的相關性。
總之,CRT和BAP31在NSCLC中均呈高表達,二者可能均參與了NSCLC的發生發展以及遠處轉移,并且都與腫瘤免疫密切相關,因此CRT和BAP31可能成為診斷NSCLC新的生物標志物,并且有望成為免疫檢測和治療的新靶點,二者介入NSCLC的機制尚未完全闡明,有待進一步的研究證實。

