黃皮果果核揮發油對小鼠黑色素瘤B16-F10細胞增殖和凋亡的影響
廖雪華,甘育鴻,梅思,符偉玉,吳科鋒,4,*,李文德
(1.廣東醫科大學廣東天然藥物研究與開發實驗室,廣東湛江524023;2.梅州市人民醫院,廣東梅州514000;3.廣東醫科大學生物化學與分子生物學研究所,廣東湛江524023;4.廣東醫科大學南海海洋醫藥研究院,廣東湛江524023;5.廣東省實驗動物監測所,廣東廣州510000)
黑色素瘤又稱惡性黑色素瘤,是由分布于神經嵴黑色素細胞所形成的痣或色素斑惡化而成,其惡性程度高,具有高度侵襲性,易發生轉移,是目前為止導致死亡人數最多的皮膚腫瘤[1-2]。黑色素瘤主要發生在皮膚,但也可發生于眼睛、腸道及體內含有黑色素細胞的任何部分[3-4]。早期黑色素瘤可以通過手術切除達到有效治療,但中晚期惡性黑色素瘤對常規的放療、化療不敏感,缺乏有效的治療手段[5-6],且常規的化療藥物存在不良反應大,患者依從性差等特點[7]。因此,從天然的中藥材中尋找有效的抗黑色素瘤藥物成為研究的熱點。
黃皮果為蕓香科植物黃皮 [Clausena lansium(Lour.)Skeels]的成熟果實,是藥食同源的民間藥材,其肉、皮和核皆可入藥[8]。黃皮果核具有行氣止痛、健胃消腫等多方面的生物活性,常用于治療胃痛、疝痛、痛經和風濕骨痛[9]。大量文獻報道,黃皮果揮發油主要成分為萜類、醇類、酯類、酮類及醛類,進一步的研究也指出,該揮發油具有殺蟲、抑菌、抗氧化等作用[10-11]。前期研究發現黃皮果核揮發油主要成分為烯醇類,占揮發油成分的56.74%以上,并可改善因紫外線引起的皮膚老化損傷[12],而對于其抗腫瘤活性及其他生物活性的研究鮮見報道。因此希望進一步探究該揮發油抗黑色素瘤細胞增殖作用的影響。
1 材料與方法
1.1 細胞株
小鼠黑色素瘤B16-F10細胞:中國科學院細胞庫。
1.2 試劑與儀器
黃皮果核揮發油(essential oil of kernel,EOK):廣東醫科大學天然藥物研究與開發重點實驗室保存[12];磷脂酰絲氨酸蛋白抗體/碘化丙啶(Annexin V-FITC/propidiun iodide,Annexin V-FITC/PI) 細胞凋亡檢測試劑盒:北京莊盟國際生物基因科技有限公司;0.25%胰酶溶液(1x):吉諾生物醫藥技術有限公司;超敏ECL(electro-chemi-luminescence)化學發光試劑盒(BeyoECL Plus)、羅丹明 123(rhodamine 123,Rh 123)、放射免疫沉淀(radio immunoprecipitation assay,RIPA)裂解液、二喹啉甲酸(bicinchoninic acid,BCA)蛋白濃度測定試劑盒:碧云天生物技術研究所;胎牛血清、高糖培養基(dulbecco’s modified eagle medium,DMEM)、磷酸鹽緩沖液(phosphote buffered soline,PBS):美國 Gibco公司;青霉素-鏈霉素雙抗溶液:廣州威佳科技有限公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴鹽[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT]:Sigma 公司;二甲基亞砜(dimethyl sulfoxide,DMSO):美國 SANTA CRUZ公司;十二烷基磺酸鈉-聚丙烯酰胺(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE) 凝膠快速配置試劑盒:北京鼎國昌盛生物技術有限公司;預染蛋白標記:美國 Thermo公司;β-肌動蛋白(β-actin)、辣根過氧化物酶標記的二抗、P65、Bcl-2、Bax、Cleaved-caspase 3等一抗:美國SAB公司;一抗稀釋液、二抗稀釋液:Biosharp公司;0.22 μm聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF):美國 Millipore公司。
IX73型倒置熒光顯微鏡:Olympus公司;通用水套CO2培養箱:美國Thermo公司;SW-CJ-1D單人單面垂直凈化工作臺:江蘇蘇凈集團有限公司;HR/T16MM微量高速冷凍離心機:湖南赫西儀器裝備有限公司;SHA-B數顯恒溫水浴震蕩器:天津賽得利斯實驗分析儀器制造廠;AUW120D型電子分析天平:日本SHI-MADAU公司;迷你雙垂直電泳槽、轉印系統:美國Bio-Rad公司;Epoch 酶標儀:美國 Bio-Tek;EPICS XL-MCL流式細胞儀:美國BECKMAN COULTER公司。
1.3 方法
1.3.1 黃皮果果核揮發油(essential oil of kernel,EOK)的提取與分離
稱取一定量黃皮果核,加水浸泡后采用水蒸氣蒸餾法提取揮發油,冷卻后收集揮發油。采用冷凍結晶法分離得到液態揮發油。通過氣相色譜-質譜聯用(gas chromatography-mass spectrometry,GC-MS) 分析顯示,在EOK中檢測到33種化合物,其主要化合物是烯醇類,主要成分含量占56.74%。
1.3.2 細胞培養
B16-F10細胞均培養于含10%胎牛血清的DMEM培養基中,置37℃、5%CO2的培養箱中培養。待細胞長至80%左右時,按1∶3或1∶2傳代,取對數生長期細胞進行試驗。
1.3.3 MTT法檢測細胞存活率
取對數生長期的細胞以3.5×103個/孔均勻接種于96孔板,置37℃、5%CO2培養箱,待細胞貼壁后,加入不同濃度的 EOK(0.2、0.4、0.6、0.8 μL/mL),空白組加入等量生理鹽水,每組6個復孔,分別孵育24、48、72 h 后吸取上清液,每孔加入 MTT(5 g/L)20 μL,繼續培養4 h,隨后小心吸出培養液,加入DMSO 150 μL/孔溶解甲鐕,振蕩搖勻,結晶完全溶解后,酶標儀于波長570 nm處測量各孔的吸光度(OD值),并計算細胞抑制率。
1.3.4 觀察細胞形態
取對數生長期的細胞以2×104個/孔均勻接種于12孔板,置于37℃、5%CO2培養箱中培養至細胞貼壁,將培養基更換為不同濃度的含EOK培養基,在37℃孵育24 h后,將培養液更換為適量的PBS,在顯微鏡下觀察并拍照。
1.3.5 細胞凋亡檢測
取對數生長期的細胞以5×104個/孔均勻接種于6孔板,置37℃、5%CO2培養箱培養至細胞貼壁。將培養基更換為不同濃度的含EOK培養基,37℃孵育24 h后,用胰酶消化收集細胞于1.5 mL試管中,在4℃、2 000 r/min條件下離心5 min,棄去上清液,用PBS洗滌2遍。細胞懸浮于500 μL的緩沖液中,添加5 μL磷脂酰絲氨酸蛋白抗體并混勻,再加入碘化丙啶試劑10 μL,室溫避光反應15 min,然后在1 h內進行流式細胞儀檢測。
1.3.6 線粒體膜電位的檢測
取對數生長期的細胞以5×104個/孔均勻接種6孔板,置37℃、5%CO2培養箱培養至細胞貼壁。將培養基更換為不同濃度的EOK培養基,37℃孵育24 h后,用無血清培養基洗滌1次,加入稀釋好的Rh123工作液(20 μmol/L)1 mL,置細胞培養箱內繼續孵育20 min,PBS洗滌3次,倒置熒光顯微鏡下觀察并拍照。
1.3.7 蛋白免疫印跡試驗
RIPA裂解液按試劑盒說明書要求裂解細胞,分離上清液,即細胞總蛋白。BCA法測定蛋白濃度,10%SDS-PAGE凝膠電泳分離蛋白,轉膜。將印跡的聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)依次進行封閉、加入對應的一抗、二抗、抗體結合區帶加入電化學發光顯色液,掃描后保存。以β-actin為內參,分析各組細胞目的蛋白相對表達量。
1.3.8 統計學方法
2 結果與分析
2.1 黃皮果果核揮發油對小鼠黑色素瘤B16-F10細胞增殖抑制的影響
通過MTT法檢測EOK對小鼠黑色素瘤細胞B16-F10細胞的抗增殖活性,結果如圖1所示。
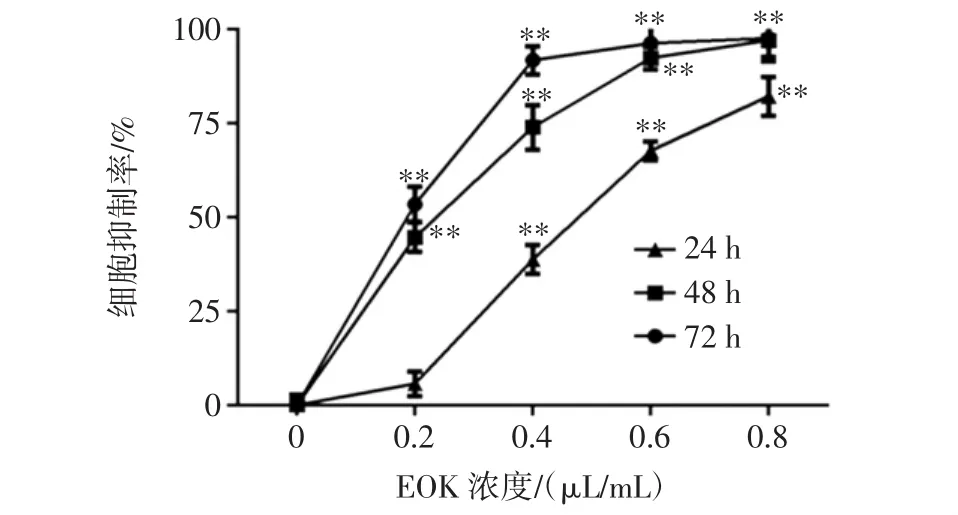
圖1 EOK對B16-F10細胞增殖的影響Fig.1 Effect of EOK on the growth of B16-F10 cells
當揮發油濃度為0.2 μL/mL,作用24 h后,對小鼠黑色素瘤B16-F10細胞的抑制率為(5.67±3.25)%,但差異無統計學意義;當作用48、72 h后,抑制率分別為(44.65±3.96)%、(53.39±4.70)%(P<0.01)。當藥物濃度分別為0.4、0.6、0.8 μL/mL時,隨著作用時間的增加,細胞增殖抑制率明顯升高,且呈現濃度依賴性和時間依賴性。由此可見,EOK對小鼠黑色素瘤B16-F10細胞具有明顯的增殖抑制作用。
2.2 黃皮果果核揮發油對細胞形態影響
EOK處理24 h對B16-F10細胞形態變化的影響結果見圖2。
圖2顯示,對照組細胞貼壁狀態良好,緊密排列,呈不規則梭形(圖2A);與對照組相比,EOK作用24 h后,0.2 μL/mL、0.4 μL/mL 組細胞變長,細胞間隙增大,呈現樹突網狀結構,且有黑色顆粒物;隨著藥物濃度的增加,細胞數量逐漸減少,細胞形態也驟變,0.8 μL/mL細胞體積明顯縮小,呈現固縮的圓形結構,黑色顆粒物不明顯,漂浮在細胞培養液中的細胞增多。從形態方面預示著B16-F10細胞處于凋亡狀態。

圖2 EOK處理24 h對B16-F10細胞形態變化的影響Fig.2 EOK deal with the effect of 24 h on the morphological changes of B16-F10 cells

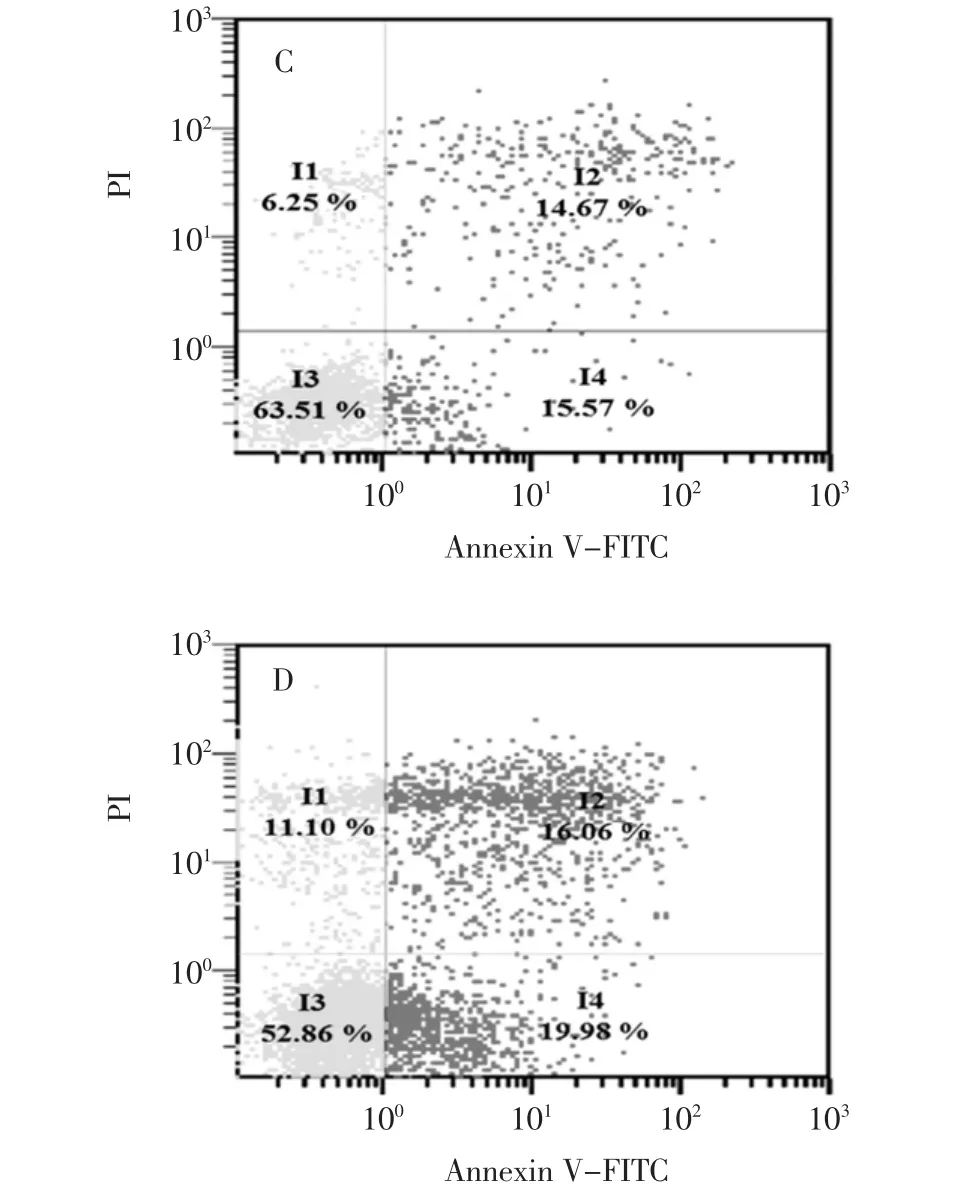
圖3 Annexin V-FITC/PI雙染的流式細胞術檢測細胞凋亡率Fig.3 Apoptosis rate of B16-F10 cells detected by flow cytometric analysis
2.3 黃皮果果核揮發油對B16-F10細胞凋亡的影響
Annexin V-FITC染色觀察B16-F10細胞凋亡情況見圖3。
細胞凋亡的檢測方法有很多中,各有其特點。流式細胞術檢測細胞凋亡,具有快速、靈敏度高、可以定量等優點。其中Annexin V-FITC/PI雙標記染色最為常用。磷脂酰絲氨酸(phasphatidylserine,PS)正常位于細胞膜的內側,但在細胞凋亡的早期,由于細胞膜失去對稱性,PS可從細胞膜的內側翻轉至細胞膜的表面,暴露在細胞外環境中。磷脂結合蛋白V(Annexin V)是一種鈣依賴的磷脂結合蛋白,它與PS高親和力特異性結合。熒光素FITC標記的Annexin V可作為探針檢測暴露在細胞膜外側的的PS,指示凋亡細胞,但壞死細胞PS也會顯露在外表使Annexin V-FITC結合成陰性,必須加入碘化丙啶(propidiun iodide,PI)才能區分壞死細胞[13-14]。碘化丙啶是一種核酸染料,它不能透過完整的細胞膜,但在凋亡中晚期的細胞和死細胞,PI能通過細胞膜而使細胞核著色。流式細胞儀分析結果顯示,與對照組(圖3A)比較,隨著EOK濃度的增加,凋亡比例也隨著增加,其誘導B16-F10細胞凋亡率分別為5.66%、30.34%、36.04%。這表明EOK能誘導B16-F10細胞凋亡。
2.4 黃皮果果核揮發油對B16-F10細胞線粒體膜電位(mitochondrial membrane potential,MMP)的影響
羅丹明123(rhodamine 123)是一種可透過細胞膜的陽離子熒光染料,是一種線粒體跨膜電位的指示劑。其在正常細胞中能夠依賴線粒體跨膜電位進入線粒體基質,熒光強度減弱或消失。而在凋亡發生時,線粒體膜完整性破壞,線粒體膜通透性轉運孔開放,引起線粒體跨膜電位(ΔΨm)的崩潰,Rh123重新釋放出線粒體,從而發出強黃綠色熒光,因此可以根據相對熒光信號的強度來衡量MMP的變化[15]。熒光染色法檢測B16-F10細胞線粒體膜電位水平見圖4。
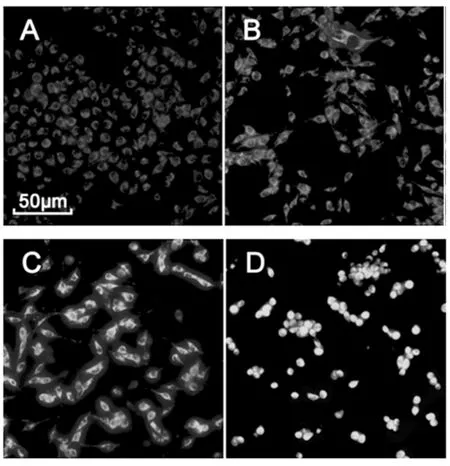
圖4 熒光染色法檢測B16-F10細胞線粒體膜電位水平Fig.4 Detection of mitochondrial membrane potential level of B16-F10 cells by fluorescent staining
從圖4中可以看出,EOK處理24 h后,與對照組比較,藥物處理組細胞內的熒光明顯增強,而且隨著濃度增大而增強,高濃度組所發熒光非常顯著,說明線粒體膜完整性可能已破壞,引起ΔΨm的崩潰,并隨藥物濃度的不同而使MMP出現不同程度的受損。結果表明EOK誘導細胞凋亡與抑制線粒體膜電位密切相關。
2.5 黃皮果果核揮發油對B16-F10細胞凋亡相關蛋白的影響
NF-κB是一類具有多向轉錄調節作用的核蛋白因子,在細胞胞漿內是以無活性形式存在,通過I-B激酶(IK)激活后,受抑制的NF-κB得以釋放,發生核移位,在核內積累并與特異性的B序列相結合啟動轉錄。核轉錄因子NF-κB的下調,可促使與抗凋亡相關的NF-κB靶基因如TNF受體相關因子1等表達減弱,從而促進凋亡。NF-κB也可調控Bcl-2家族中兩個抗凋亡蛋白:Bfl-1/A1、Bcl-X1的表達,也誘導Bcl-2和抑制Bax基因表達[16-17]。而Bcl-2與Bax這兩種蛋白參與構成線粒體通路,分別具有抑制和促進細胞凋亡的作用,Bax/Bcl-2蛋白比值決定了細胞的生存和死亡。凋亡通路相關蛋白Bcl-2/Bax/caspase 3被激活,Bax/Cleaved-caspase 3蛋白表達增加,而Bcl-2蛋白被抑制,是經典的線粒體凋亡途徑[18]。
EOK 對 B16-F10 細胞 NF-κB(P-P65)、NF-κB(P65)蛋白表達的影響結果見圖5。

圖5 EOK 對 B16-F10 細胞 NF-κB(P-P65)、NF-κB(P65)蛋白表達的影響Fig.5 Effect of EOK on NF-κB(P-P65)and NF-κB(P65)protein expression in B16-F10 cells
從圖5中可以看出,與對照組相比,隨著黃皮果果核揮發油濃度的增加,NF-κB(P-P65)與 NF-κB(P65)蛋白表達均下調,其中在濃度0.2 μL/mL作用下蛋白表達量有所減少(P<0.01);且對 NF-κB(P65)蛋白表達的抑制作用比對NF-κB(P-P65)蛋白表達的抑制作用更為明顯。同時檢測Bcl-2和Bax蛋白的表達情況,結果如圖6所示。
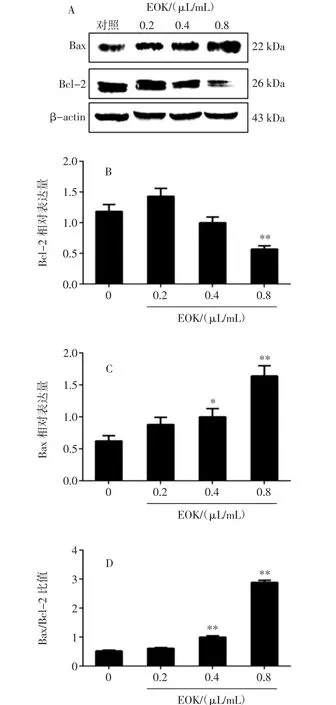
圖6 EOK對B16-F10細胞Bax、Bcl-2蛋白表達的影響Fig.6 Effect of EOK on Bax and Bcl-2 protein expression in B16-F10 cells
與對照組相比,隨著果核揮發油濃度的增大,Bax蛋白表達增多,其中0.4、0.8 μL/mL組尤為明顯(P<0.05或 P<0.01);而 Bcl-2 蛋白表達在 0.8 μL/mL 組減少尤為明顯(P<0.01)。通過統計,Bax/Bcl-2的比值增大,0.4、0.8 μL/mL組與對照組比較差異有統計學意義(P<0.01)。
對B16-F1細胞Cleaved-caspase 3蛋白表達的影響結果見圖7。

圖7 EOK對B16-F10細胞Cleaved-caspase 3蛋白表達的影響Fig.7 Effect of EOK on Cleaved-caspase 3 protein expression in B16-F10 cells
如圖7所示,黃皮果果核揮發油也能上調Cleaved-caspase 3蛋白的表達。與對照組相比,0.4、0.8 μL/mL 組差異有統計學意義(P<0.01)。這些結果表明,線粒體途徑參與黃皮果果核揮發油誘導B16-F10細胞的凋亡,其機制可能與抑制胞內NF-кB P65蛋白表達,降低其磷酸化水平,激活Bcl-2/Bax/caspase 3信號通路有關。
3 結論
水蒸氣蒸餾法提取的黃皮果核揮發油作用于小鼠黑色素瘤B16-F10細胞后,MTT法測定藥物濃度≥0.2 μL/mL時,黃皮果核揮發油對B16-F10細胞增殖有明顯的抑制作用。Annexin V-FITC/PI染色結果表明,在黃皮果核揮發油作用24 h后,0.8 μL/mL組凋亡細胞的比例高達36.06%。在羅丹明123染色檢測黃皮果核揮發油對B16-F10細胞線粒體膜電位有顯著影響,且隨著藥物濃度增大,熒光強度增強。蛋白免疫印跡結果表明,黃皮果核揮發油能下調NF-κB(PP65)、NF-κB(P65)、Bcl-2 的表達,同時上調 Bax、Cleaved-caspase 3的表達。因此,試驗結果表明:黃皮果果核揮發油以誘導細胞凋亡的方式抑制小鼠黑色素瘤B16-F10細胞增殖,其機制與抑制胞內NF-кB P65蛋白表達,降低其磷酸化水平,激活Bcl-2/Bax/caspase 3信號通路有關。