牦牛肉品質相關的去飽和脂肪酶1基因表達差異分析
謝鳳蓮,孫萬成,羅毅皓
(青海大學農牧學院,青海西寧810016)
牦牛是生長在青藏高原地區的一種特有牛種,這 里海拔高,氣候寒冷,因此造就了牦牛不同于普通牛種的獨特體質,并含有大量的營養成分和豐富的微量元素,特別是含有人體必需的脂肪酸,對人體的健康非常重要,但是牦牛肉比一般牛肉更粗糙且不好吃[1-2]。許多學者認為牦牛肉蛋白質含量高(22.13%),脂肪含量低(3.36%),其營養成分高于黃牛肉、豬肉、羊肉,屬“高蛋白、低脂肪”的優質肉[3-4]。去飽和脂肪酶1(stearoyl-CoA desaturase 1,SCD1)是合成單不飽和脂肪酸(monounsaturated fatty acid,MUFA)棕櫚油酸和油酸的關鍵酶,參與泌乳反芻動物肝臟中的脂肪酸生物合成,且SCD1基因在肝臟中高表達[5-6]。大量研究表明,SCD1基因過表達可以增加細胞內MUFA含量和脂質積累,而沉默SCD1基因導致油酸濃度和甘油三酯(triglyceride,TAG)積累的顯著降低[7]。牦牛SCD1基因全長序列為1 300 bp,編碼359個氨基酸[8],且缺乏SCD1基因的小鼠不能使飽和脂肪酸去飽和,并且避免飲食誘導的肥胖[9]。研究表明,牛乳中超過70%的共軛亞油酸(conjugated linoleic acid,CLA)都是經SCD1催化產生的,SCD1可能影響牛奶中SFAs/MUFAs比率、肌間脂肪沉積和成分,是改善牛奶和牛肉質量的主要候選基因,牛肉肌間脂肪中不飽和脂肪酸含量的提高對于改善牛肉品質和風味也有著重要影響[10]。也有相關研究表明,小鼠的SCD1基因敲除會導致小鼠體內的膽固醇丁酯和甘油三酯的缺乏,棕櫚酸、油酸的含量也存在著相應的下降趨勢,而棕櫚酸酯和硬脂酸的含量卻呈上升趨勢[11]。敲除小鼠SCD1基因,發現小鼠的耗能會增加,小鼠體內的脂肪沉積減少,并能夠加大脂肪酸氧化速度,減少極低密度脂蛋白的分泌,增加從而間接參與脂肪代謝和其生物合成[12]。因此,研究牦牛SCD1基因表達差異,可以探究SCD1基因的調控脂肪酸含量比例的能力,并對牦牛肉品質進行評估,為進一步改善牦牛肉品質提供可借鑒的理論依據。
1 材料與方法
1.1 材料與試劑
1月份、4月份、9月份在青海省西寧市城南馬家肴屠宰場,采集現殺的3頭公牦牛的肝臟、腎臟、結腸、背最長肌組織(采集樣品所用的手術刀、鑷子等嚴格滅菌),迅速裝于冷凍管中,保存在液氮罐中,帶回實驗室后,將樣品從液氮罐中取出,保存于-80℃冰箱中,備用。
移液槍和微量吸頭、核酸染料(4s red plus nucleic acid stain):上海生物工程技術股份有限公司;RNA提取試劑盒、TaKaRa反轉錄試劑盒、瓊脂糖、熒光定量染料(SYBR Green II):蘭州寶生物工程有限公司;牛硬脂酰輔酶A去飽和酶1(SCD1)酶聯免疫分析(enzyme linked immunosorbent assay,ELISA)試劑盒:南京翼飛雪生物科技有限公司。
1.2 儀器與設備
電熱鼓風干燥箱(DHG-9070A):上海一恒科學儀器有限公司;冷凍離心機(2-16KL):德國SiGMA公司;PCR 儀(Gene AMP PCR System 9700):美國 ABI公司;NanoDrop One/Onec超微量分光光度計(AZY1603147):基因有限公司;電泳儀(JY600):北京君意東方電泳設備有限公司;凝膠成像分析儀(WD-9413A):北京市六一儀器廠;熒光定量儀(CFX96):美國BIO-RAD公司;酶標儀(352型):芬蘭 Labsystems Multiskan MS;洗板機(AC8):芬蘭 Thermo Labsystems;隔水式恒溫培養箱(GNP-9080型):上海精宏實驗設備有限公司。
1.3 方法
1.3.1 引物設計
在NCBI數據庫中搜索SCD1基因mRNA序列(GenBank登錄號為AY241933),通過核心序列設計5'和3'端特異性引物,利用Primer Premier 5.0軟件設計引物,引物由生工生物工程(上海)股份有限公司合成。引物信息見表1。

表1 引物信息Table 1 Primer information
1.3.2 樣品總RNA的提取和cDNA的合成
組織樣品的RNA提取參照試劑盒說明書進行操作。使用Nanodrop One/Onec超微量分光光度計測定RNA樣品的OD值(260 nm吸光度值與280 nm吸光度值之比,反映核酸的純度)和濃度(ng/μL),并在電泳凝膠成像儀上拍照檢測RNA的完整性。將提取到的牦牛組織樣品的總RNA進行反轉錄,主要參考TaKaRa反轉錄試劑盒進行,采用20 μL反轉錄體系,進行PCR擴增得到cDNA。反轉錄反應條件如下:37℃,15 min(反轉錄反應);85℃,5 s(反轉錄酶的失活反應)。
1.3.3 SCD1基因實時熒光定量聚合酶鏈式反應
以合成的牦牛組織樣品cDNA為模板,按TaKaRa試劑盒推薦方法在冰盒上進行操作。加入引物SCD1F1-SCD1R1進行實時熒光定量聚合酶鏈式反應(real-time fluorescent quantitative polymerase chain reaction,RT-PCR),同時選擇內參 β-actin F1-β-actin R1進行RT-PCR作為對照。兩步法PCR擴增標準程序。
1.3.4 酶聯免疫吸附測定(enzyme linked immunosorbent assay,ELISA)反應
ELISA反應按照ELISA試劑盒,應用雙抗體夾心法測定標本中牛硬脂酰輔酶A去飽和酶1(SCD1)水平。用純化的牛硬脂酰輔酶A去飽和酶1(SCD1)抗體包被微孔板,制成固相抗體,往包被單抗的微孔中依次加入硬脂酰輔酶A去飽和酶1(SCD1),再與辣根過氧化物酶(horseradish peroxidase,HRP)標記的 SCD1抗體結合,形成抗體-抗原-酶標抗體復合物,經過徹底洗滌后加底物 3,3',5,5'-四甲基聯苯胺(3,3',5,5'-tetramethylbenzidine,TMB)顯色。TMB在 HRP酶的催化下轉化成藍色,并在酸的作用下轉化成最終的黃色。顏色的深淺和樣品中的硬脂酰輔A去飽和酶1(SCD1)呈正相關。用酶標儀在450 nm波長下測定吸光度(OD值),通過標準曲線計算樣品中牛硬脂酰輔酶A去飽和酶1(SCD1)濃度。
1.3.5 數據處理與統計學分析
利用SPSS 24.0軟件分析試驗數據,計量數據用“平均值±標準差”表示,采用ANOVA對試驗結果進行差異顯著性分析,P<0.05表示差異顯著。
2 結果與分析
2.1 提取的樣品總RNA檢測
提取出的牦牛肝臟、腎臟、結腸、背最長肌樣品的總RNA在質量分數1.2%瓊脂糖凝膠上的電泳結果見圖1。

圖1樣品總RNAFig.1 Sample RNA
由圖1可以看到28 S、18 S、5 S三條亮帶,且28 S條帶亮度大概是18 S條帶亮度的2倍。
2.2 SCD1基因cDNA的合成
圖2由提取的總RNA反轉錄后合成cDNA,再通過PCR擴增成DNA得到的電泳圖。

圖2 SCD1基因cDNA的合成Fig.2 SCD1 genes cDNA synthesis
本試驗應用DL2 000的Marker可以看出目的基因在100 bp~250 bp之間。
2.3 牦牛SCD1基因熒光定量分析
不同月份牦牛不同組織間SCD1基因熒光定量見表2。
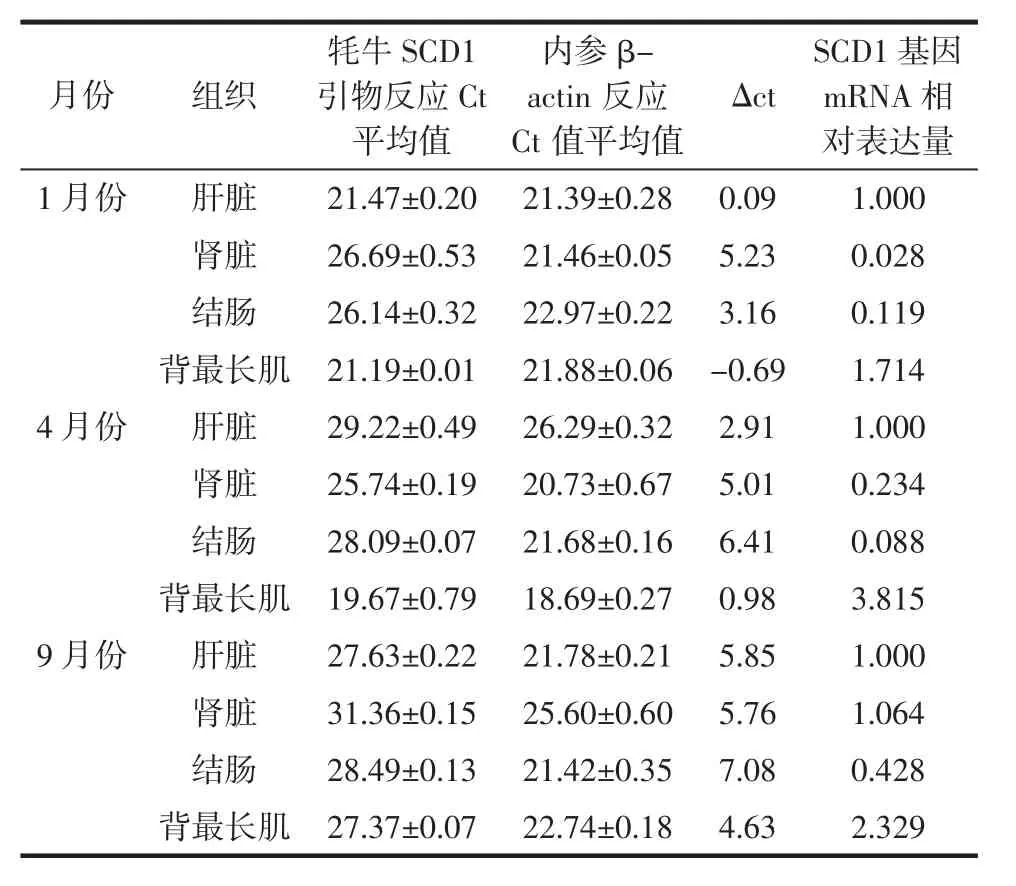
表2 牦牛SCD1基因熒光定量Table 2 Fluorescence quantification of SCD1 gene in yak
通過比較閾值法(2-ΔΔCt)進行相對定量。循環次數(cycle times,Ct)為樣品中PCR擴增反應的熒光信號到達設定的域值時所經歷的循環數。以牦牛肝臟樣品作為對照樣,將其2-ΔΔCt值設為1進行閾值比較,根據公式計算:
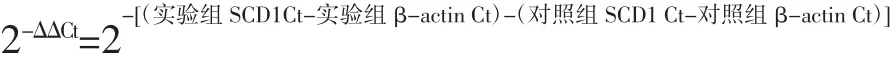
由上述公式計算得到的結果可以得到不同月份SCD1基因相對定量的拷貝數(見圖3)。

圖3 牦牛SCD1基因mRNA相對表達量Fig.3 Relative mRNA expression of yak SCD1 gene
由表2和圖3可得以每個月份的牦牛肝臟為對照組,1月份、4月份、9月份牦牛SCD1基因表達量在牦牛肝臟、結腸、腎臟、背最長肌4個組織中均有表達,其中背最長肌組織中mRNA相對表達量最高,且1月份牦牛SCD1基因在各個組織的表達量都低于4月份和9月份,且組織間SCD1基因表達量差異顯著(P<0.05)。
2.4 牦牛SCD1蛋白含量分析
不同月份牦牛不同組織間SCD1蛋白含量見表3。

表3 牦牛SCD1蛋白含量Table 3 SCD1 protein content of yak (U/L)
同組織不同月份的牦牛SCD1蛋白含量見圖4。

圖4 牦牛SCD1蛋白含量Fig.4 SCD1 protein content of yak
由表3和圖4可得,以肝臟為對照組,1月份、4月份、9月份牦牛SCD1蛋白含量在背最長肌中的普遍高于對照組,1月份牦牛SCD1基因在各個組織的蛋白含量都低于4月份和9月份,且組織間SCD1蛋白含量差異顯著(P<0.05)。
ELISA試驗結果與熒光定量PCR結果基本一致,相互印證。因此,牦牛SCD1基因在牦牛肝臟、腎臟、結腸和背最長肌4個組織中均有表達。以牦牛肝臟為對照組,不同月份間,牦牛SCD1基因在背最長肌組織中的表達量和蛋白含量普遍最高,1月份牦牛4個組織中SCD1基因表達量和蛋白含量都較低,不同環境會影響SCD1基因表達。
3 結論與討論
本研究發現,以牦牛肝臟為對照組,SCD1基因在牦牛肝臟、腎臟、結腸、背最長肌4個組織中均有表達,且SCD1基因表達量和含量在背最長肌組織中最高,差異顯著(P<0.05)。說明牦牛SCD1基因不同月份不同組織存在差異性,SCD1基因表達雖然影響肉品質,但是其不是唯一調控肌間脂肪含量的因素。1月份牦牛SCD1基因表達量和SCD1蛋白含量都低于9月份和4月份。青藏高原1月份的氣候較4月份和9月份冷,草地枯黃,牦牛飼料缺乏,這可能是導致1月份牦牛SCD1基因表達較低的緣由,說明牦牛SCD1基因的表達可能會受到氣候、飼料的影響,且在寒冷季節SCD1基因表達量可能會降低,同時降低了SCD1蛋白含量。有相關研究發現,SCD1的表達和酶活性受生長發育時期、牛品種、營養、激素、外部環境等諸多因素的影響[13-15],高碳水化合物飲食、胰島素、過氧化物酶和膽固醇直接影響SCD1基因轉錄[16]。SCD1基因表達水平高,會導致脂肪儲存和肥胖,反之,敲除SCD1基因,減少脂肪堆積,并使脂肪酸氧化從而保護飽和脂肪引起的肥胖[17]。也有研究表明,SCD1基因表達量與背最長肌的C16:1、C18:1和UFA含量呈正相關,與MUFA含量呈正相關,與PUFA含量呈負相關,該基因是肉品質評定的候選指標之一[18]。因此進一步研究SCD1基因在牦牛中的表達差異以及相關轉錄因子對肌間脂肪共同調控機理,可以試圖去揭示牦牛高蛋白、低脂肪的機理,為改善牦牛肉營養品質提供理論依據。