微電子加工行業含銅廢硝酸處理工藝研究
王 梨,王小赫,賀 明,古月圓,吳丹丹,吳 旭,吳小龍,唐 文,黃莉莉,王 瑩,黃夢茹
(1.華中科技大學環境科學與工程學院,武漢 430074;2.湖北永紹科技股份有限公司,湖北 潛江 433122)
在微電子加工行業的電鍍工藝中,人們會采用蝕刻液腐蝕電路板上多余的銅箔,隨著蝕刻過程的進行,蝕刻液中的銅離子不斷增多,當蝕刻液中的銅離子的含量達到一定濃度時,蝕刻液腐蝕銅的效率就會逐漸下降直至失效,從而成為蝕刻廢液排出[1]。鍍件的清洗、除油、活化、除銹和退鍍等過程都會產生相應的刻蝕廢液,廢液中的重金屬銅離子具有較大的毒性,根據我國的排放標準,銅的排放濃度低于0.5 mg/L,含銅刻蝕廢酸液必須作為危廢處理處置[2]。傳統蝕刻液的處理工藝主要包括化學沉淀法、吸附法、電解法、離子交換法、氧化還原法和中和法等,這些處理工藝各有利弊[3-6]。其中,電解法的應用較普遍,設備的自動化程度高,可實現銅金屬的回收,不僅有良好的環境效益,還可獲得一定的經濟價值,是刻蝕廢液的主要處理方法。
本研究采用湖北永紹科技股份有限公司提供的含銅廢硝酸,該廢液主要是清洗鍍件時產生的。傳統刻蝕廢液的成分主要是氯化銅,Cu2+濃度高達150 g/L,而此次研究的廢液與傳統的刻蝕廢液不同,其主要成分是硝酸銅,且Cu2+濃度僅有33.14 g/L。由于廢液中Cu2+濃度相對較低,硝酸根可發生還原反應,使得文獻中的工藝都無法直接采用,因此有必要研究工藝參數對電解過程的影響。
為了最大程度從含銅廢硝酸中回收銅,本文研究了不同電壓、不同電流下電解銅隨時間變化的電流效率和沉積層的品質,包括其微觀形貌和抗拉強度,并且探討了影響銅沉積的影響因素,為擬開發處理設備的工藝優化提供理論依據。
1 試驗
1.1 試驗儀器及藥品
儀器:CS150 電化學工作站(武漢科斯特儀器股份有限公司),TM3030 臺式掃描電子顯微鏡(Scanning Electron Microscope,SEM,日本株式會社日立新技術),5V6A 充放電測試儀(新威),萬分之一電子精密天平(上海卓精電子科技有限公司),電子萬能試驗機QL-5W(廈門群隆儀器有限公司),紫外可見分光光度計,pH 計(上海雷磁),自制銥鉭鈦陽極,自制銅陰極(工作面積為6.5 cm×3.5 cm),不銹鋼陰極(工作面積為4.0 cm×2.0 cm)。
藥品:含銅廢硝酸(湖北永紹科技股份有限公司提供),純水,五水合硝酸銅(分析純),濃HNO3(質量濃度65%~68%),無水硫酸鈉(分析純),無水硫酸銅(分析純)。
1.2 分析方法
電沉積過程中的Cu2+濃度用紫外分光光度計測量;掃描電子顯微鏡用于分析沉積層的品質形貌,電子萬能拉力試驗機測量銅板抗拉強度;電化學工作站用于研究電沉積的反應過程,電沉積前后的質量變化由分析天平測量,電沉積過程的庫倫效率根據公式計算得到。其中,M是電解出的銅板質量,g;q是銅的電化摩爾質量,1.186 g/(A·h);Q是電解所需的電量,A·h。
2 試驗結果與分析
2.1 電壓對電沉積的影響
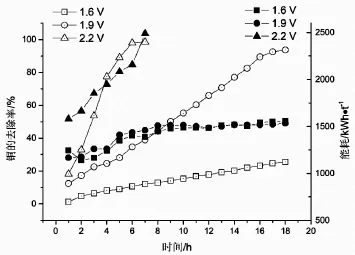
圖1 不同電壓條件下Cu 去除率和能耗隨時間的變化
電解液400 mL,電極距1.0 cm,在不同的電壓條件下,電解銅過程中的銅的去除率和能耗隨時間的變化如圖1所示。由圖1可以看出,向電極板施加一定電壓,隨著電壓的增加,銅沉積的速度加快,而且在沉積前期,銅的去除率隨時間呈線性增加,在后期由于溶液中的銅離子太低,沉積速率降低,使得銅的去除率趨于平穩,從電解結果看來,銅的電解去除率可以達到98%。
隨著電解過程的進行,整體的電耗慢慢升高,2.2 V條件下能耗最高,電解結束時,其能耗高達2 600 kW·h/t,1.6 V 和1.9 V 條件下,電沉積相同質量的銅的能耗差異不大,至電解終點,能耗約為1 500 kW·h/t,從經濟角度出發,應選擇1.9 V 作為沉積電壓。
2.2 電流對電沉積的影響
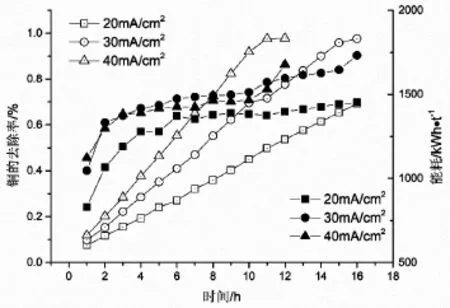
圖2 不同電流密度條件下Cu 去除率和能耗 隨時間的變化
電解液400 mL,電極距1.0 cm,在不同的電流密度條件下電解銅過程中的銅的回收率和能耗隨時間的變化如圖2所示。同樣地,電流密度越大,銅的沉積速度越快;電解前期,一定電流密度下單位時間內,銅的回收率相同,表明Cu2+濃度并不影響銅的去除率,在電解后期,銅的去除率達98%左右。
在能耗方面,隨著電解過程的進行,銅離子濃度降低,能耗先增加,在電解4 h 后趨于平緩,當電解液中的銅離子濃度極低時,能耗迅速增加。20 mA/cm2條件下的能耗最低,在電解過程中能耗都不超過 1 500 kW·h/t,電解的電流密度為30 mA/cm2和40 mA/cm2時能耗差別不大,在電解終點能耗最大為1 732 kW·h/t。
2.3 電沉積層形貌分析
將不同操作條件下沉積的陰極銅照片進行整理,如圖3所示。從表觀看,光澤感依次是(a)>(b)> (c),(d)>(e)>(f);顏色從深到淺依次為 (c)>(b)>(a),(f)>(e)>(d)。其中(a)、(b)、(d)、(e)沉積的陰極銅為完整的銅板,(c)、(f)表面形成了疏松粗糙的銅顆粒,顏色也為深褐色,依據相關研究,原因主要是硝酸體系在高電流密度下電解時,硝酸根離子會在陰極放電,導致電解液中氮氧化物的累積,使陰極銅結晶不致密,同時硝酸根放電消耗氫離子,使區域pH 升高,導致氧化銅或氧化亞銅等銅的氧化物生成,顏色會變成紅褐色。

圖3 不同電流密度和沉積電壓下陰極銅的表面形態
圖4為陰極銅在不同沉積時間條件下的微觀形貌。圖5為不同沉積條件下陰極銅結晶的平均粒徑。在電沉積初期,圖4(a)最光滑致密,銅結晶的平均粒徑為4.41 μm;其次為圖4(c)、圖4(g)、圖4(i),其平均粒徑分別為10.10 μm,10.90 μm,13.69 μm,且都是平整的結晶層;圖4(e)形成了明顯的球狀顆粒,顆粒均勻,粒徑達24.33 μm;圖4(k)的沉積表面上會形成明顯凸起的塊狀顆粒,平均直徑達48.31 μm。隨著沉積過程的進行,銅結晶層的粒徑都在增加,在30 mA/cm2下(見圖4(j))可以明顯發現在銅結晶變成顆粒狀且粗糙,開始形成了尖錐狀的銅枝晶;在 2.2 V 和40 mA/cm2條件下(見圖4(f)、圖4(l)),銅結晶變成疏松、易脫落的尖錐狀支晶;其余沉積條件下,銅表面變得更加平整,結合的更牢靠。
綜上所述,低電流或低電壓有利于銅的電沉積效果,且控制電流密度操作性較強,結合電沉積的能耗和沉積速度考慮,應選擇20~30 mA/cm2作為沉積電流密度。


圖4 陰極沉積銅的SEM 照片
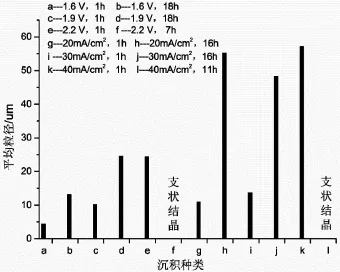
圖5 不同沉積條件下銅結晶的平均粒徑
2.4 抗拉強度測試
電流密度提高意味著過電位增大,會導致Cu結晶速度加快,也會有利于晶核的形成。用工作面積為2 cm× 4 cm 的不銹鋼電極做陰極,在400 mL 原液中電沉積銅,測量其抗拉強度。由圖6可知,銅的抗拉強度隨電流密度的減小而改善。常溫下回收銅的抗拉強度在200~250 MPa 時,才具備資源化回收價值。本次試驗的樣品,在20 mA/cm2和22.5 mA/cm2的條件下沉積的陰極銅符合>200 MPa 的要求。本項目由于處理產率的要求,低于20 mA/cm2的電流密度,沉積速度較小,可將22.5 mA/cm 作為該含銅廢酸液的沉積電流。
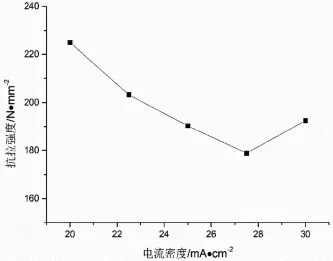
圖6 不同電流密度下陰極銅的抗拉強度
2.5 硝酸根的影響
根據Bruning 和Shriver 等學者的研究,硝酸根離子還原反應的標準電極電位比二價銅離子還原反應的高[7-8]。在二價銅離子存在的條件下,較高的電極電位使硝酸根離子可能發生還原反應,因此在銅離子電解沉積的電流效率可能會受到影響。由能斯特方程可知:

硝酸根離子還原成亞硝酸的反應式為:
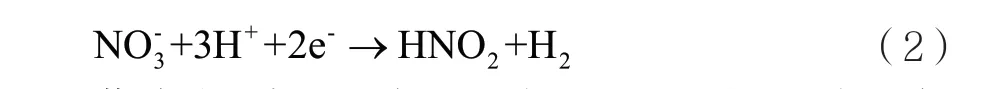
若硝酸根離子活度是1,在25℃下,對于這個反應:
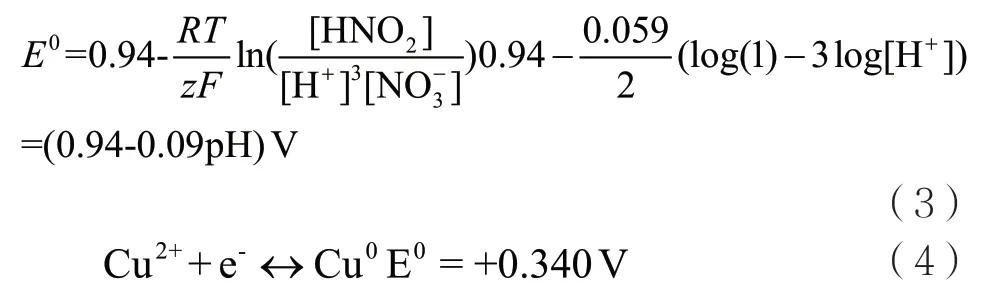
根據式(3)和式(4),當pH 值越來越低時,硝酸根離子還原反應的電勢就會越來越高。因此,當硝酸根離子的活度系數和濃度越來越高時,該反應的平衡電勢也會越來越高。這些表明,在陰極表面硝酸根離子還原反應發生在銅離子還原反應之前或者同時發生。除此之外,銅離子對硝酸根的還原反應有催化作用,這種催化作用對銅的電沉積是極其不利的[9]。
另外,根據Filimonov 和Shcherbakov 的相關研究可知,銅在硝酸根離子存在的酸性環境下還能夠被化學還原,反應方程式如下[10]:
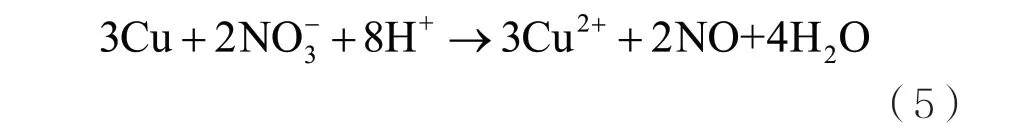
顯然,式(2)和式(5)都會消耗電解質中的質子,使電解質溶液的pH 值上升,這樣銅離子將會以多孔銅氧化物氧化銅(CuO)或氧化亞銅(Cu2O)的形式沉積在陰極表面上。
圖7為電沉積過程中銅的庫倫效率隨時間的變化,由此可知,其庫倫效率不超過50%。綜上所述,硝酸根的還原反應是銅的庫倫效率降低的主要原因。因此,在后續研究中,有必要進一步優化工藝條件。考慮到將銅回收后的硝酸還可能回到退鍍或者清洗工藝中使用,接下來的研究可以尋找適當的添加劑,以減少硝酸根的消耗同時減少其對銅沉積的影響。
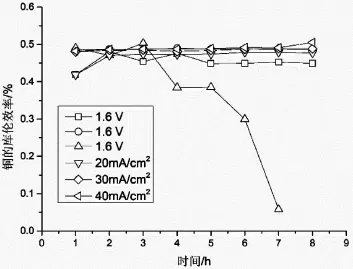
圖7 電沉積過程中庫倫效率隨時間變化
3 結論
采用電解法,含銅廢硝酸中銅的去除率可達98%。22.5 mA/cm2是通過電沉積處理該種含銅廢硝酸液較合適的電流密度,該電流密度下,電沉積的能耗低,約為1 500 kW·h/t,沉積層平整,基本無瘤狀結晶。電沉積過程中銅的庫倫效率低于50%,硝酸根的還原反應是影響其電沉積效果的主要原因。后續研究可以尋找適當的添加劑,以減少硝酸根的消耗,降低其對銅沉積的影響。

