不同載氣氣氛下煤樣熱解特性及其動力學參數研究
王小華,趙洪宇,宋 強,李玉環,舒新前
(1.中國礦業大學(北京) 化學與環境工程學院,北京 100083;2.北京科技大學 土木與資源工程學院,北京 100083;3. 內蒙古工業大學 能源與動力工程學院,內蒙古 呼和浩特 010000)
煤熱解是在隔絕空氣或惰性氣氛條件下加熱,發生一系列物理、化學變化的復雜反應過程[1,2]。熱解所獲得產品豐富,既包含高值的可燃煤氣和相對清潔的固體燃料,又包含由多種芳香烴化合物組成的焦油等基礎化工原料。而包括煤的熱解特性、熱解動力學、加氫液化和加催化劑等附加條件的熱解一直都是研究熱點[3-5]。由于熱解動力學研究所獲得的參數可為煤的熱解過程提供反應時間、轉化率、熱解速度、供熱要求等工程設計所需的基礎數據。因此,對于煤熱解過程中熱解動力學參數的研究就顯得尤為重要。針對煤在不同熱解條件下動力學參數分布規律國內外學者也展開了多參數條件下的的基礎和應用研究,獲得了很多研究成果。例如,蔡連國[6]等通過煤程序升溫與等溫熱解特性及動力學比較研究發現,等溫熱解過程中CO2和CO的析出先于CH4和H2,微型流化床等溫快速熱解的揮發分氣體總量析出活化能小于程序升溫熱解的活化能。劉欽甫[7]等通過煤熱解氣體主產物及熱解動力學分析證實,隨著煤化程度增大,熱解反應活化能逐漸降低,其熱效應強度和發生熱解反應的能力逐漸降低。邱朋華[8]等通過堿及堿土金屬對準東煤熱解特性及動力學影響分析發現,原煤和脫灰煤樣品的熱解活化能均隨轉化率的增大而升高。但公開報道的文獻更多地集中于反應器類型、原料以及反應參數對熱解動力學參數的影響,熱解反應氣氛的變化對反應過程中的動力學參數的影響缺乏深入探討。因此,基于目前的研究基礎,從載氣氣氛差異對煤樣熱解特性層面上探討以模擬熱解氣作為載氣對煙煤進行熱重分析的熱轉化過程中的動力學參數變化規律是值得深入研究的課題。
為此,本文選用來自陜西榆林(代號:SY)的煙煤,采用熱重分析儀(TG)研究了在模擬熱解氣氛下對煤樣熱解特性及動力學參數的影響,分析了產生差別的深層次原因,擬為固定床熱解煙煤制備高值燃料的工業放大提供基礎數據。
1 實驗材料與方法
1.1 實驗樣品
將原煤煤樣在實驗室進行粉碎和篩分,得到小于1mm的篩下物,然后將上述所得煤樣進行研磨和再次篩分,所得篩下物煤樣裝入密封袋并貼標簽,儲藏在冰箱中。采用國標GBT212—2008對實驗煤樣進行工業分析和元素分析,實驗結果見表1。
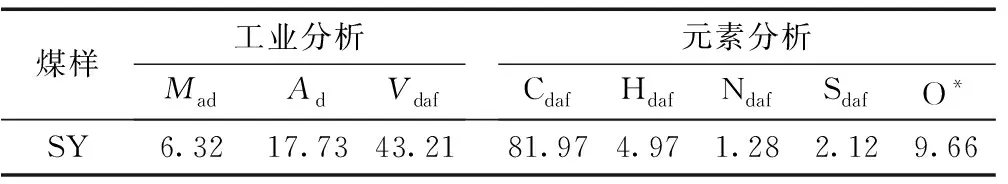
表1 煤樣工業分析和元素分析 %
注:*為差減法計算。
1.2 TG分析
采用日本精工電子納米科技有限公司生產的TGA熱重分析儀,實驗時取實驗樣品質量為15mg左右置于熱重分析儀的三氧化二鋁坩堝內,載氣分別為N2、CH4、CO2、H2以及CO2+CH4(體積分數各為50%),流量為100mL/min。待通入將體系內的空氣被置換后,以30℃/min的升溫速率將樣品由室溫加熱到1000℃。四級桿質譜儀與上述熱重分析儀通過不銹鋼毛細管相連接,用來分別不同氣氛下氣相產物釋放規律。質譜離子電壓為100eV,通過電子碰撞電離析出的氣體產物,并對具體質荷比的離子流數據進行分析。所得電信號(離子流強度)經過最大離子流強度和 樣品重量歸一化后進行比較。
1.3 動力學
煤的程序升溫熱解實驗的動力學處理方法比較常用的有Doyle[9]和Coats-Redfern’s法[10]法等。本實驗選用Coats-Redfern’s法處理TG數據。動力學計算方法在以前的研究中已經有所描述[10],這里不在重述。
2 結果與討論
2.1 煤樣熱重分析
煤樣在不同熱解氣氛下熱重分析結果如圖1所示。由圖1可知,HL煤樣的熱解大致可分為三個階段,第一階段溫度區間為室溫~388℃;第二階段為388~605℃,第三階段為605~1000℃。在熱解反應第一階段,煤樣在不同熱解氣氛下均出現微小失重,這主要是由于煤吸附的小分子的脫附和一些易發生反應的官能團的分解析出[11]。在400℃之前,除了在H2氣氛下煤樣失重率較大外,達到18.34%,在其他熱解氣氛下,煤樣失重率相差較小,達到12%左右,這說明在煤樣大規模發生熱解反應之前,熱解氣氛對于煤樣中揮發分的析出影響不大。在熱解反應第二階段,是快速失重階段,是煤的熱解反應的主要階段,此時五種氣氛下的失重率也相差不大,達到40%左右,通過DTG曲線可知,在480℃左右出現最大失重速率峰,失重速率由小到大依次為0.12(CH4)< 0.17(N2)< 0.20(CO2+CH4)<0.21(CO2)< 0.26(H2)mg/min。這主要是由于在此溫度段煤樣發生大規模的解聚和分解反應,煤樣黏結形成半焦,并在此過程中釋放大量氣相產物。在熱解反應的第三階段,大部分能發生反應的化學鍵在這一階段斷裂,包括大分子中的橋鍵斷裂生成自由基,芳香核的脂肪側鏈斷裂生成揮發性氣體和焦油以及部分含氧官能團的斷裂。N2、H2以及CH4氣氛下煤樣的失重速率逐漸降低,而在含有CO2氣氛下熱解的煤樣的失重速率迅速增大,這主要是由于當熱解溫度高于600℃時,煤樣與CO2發生氣化反應,使煤樣失重率迅速增大。而H2氣氛下煤樣失重率較大,這可能是由于在較高熱解溫度下H2與煤中某些碳結構發生加氫反應形成揮發分析出,進而導致煤樣失重率增大。由于CO2濃度不同,因此導致單獨CO2氣氛下氣氛下的煤樣的失重速率大于CO2+CH4氣氛。
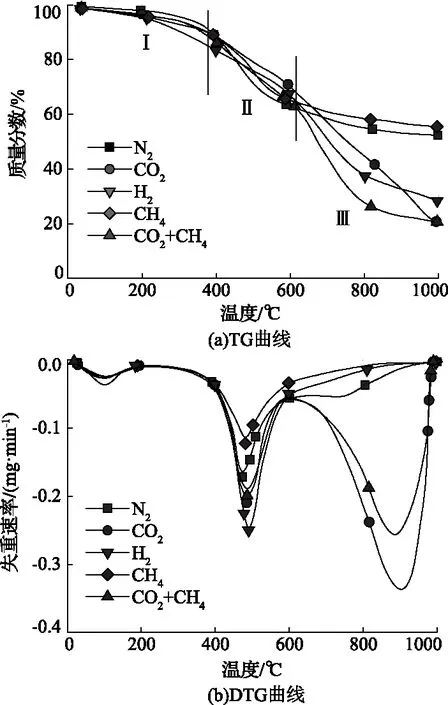
圖1 煤樣在不同熱解氣氛下熱重分析
2.2 氣體產物釋放規律
不同熱解氣氛下熱解氣體產物釋放規律如圖2所示。由圖2(a)可知,不同熱解下氣體產物CH4的釋放規律基本相同,隨著熱解溫度的升高,釋放強度逐漸增大。N2、CO2+CH4混合氣氛下達到最大釋放強度在505℃左右,而在H2、CH4和CO2氣氛下CH4最大析出強度峰向高溫段推移,且CO2氣氛下CH4最大析出溫度推移最多,達到597.68℃。這可能是由于CH4主要來自氫化芳香族官能團的分解,而在CO2氣氛下煤熱解產率的含氫自由基首先與含氧自由基反應,形成水產物,相當于“延遲”了芳香族官能團中亞甲基與含氫自由基的反應。
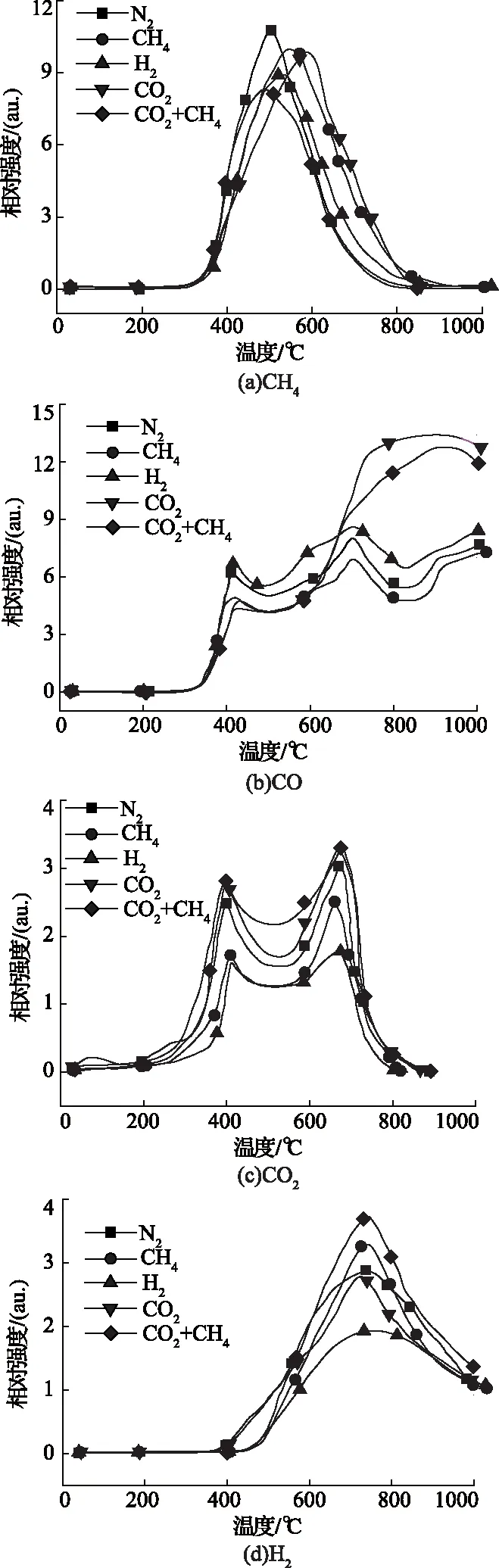
圖2 煤樣在不同氣氛下氣體產物釋放規律
對比圖2(b)和(c)可知,當熱解溫度低于600℃時,不同熱解氣氛下熱解氣體產物CO和CO2釋放規律相似,這主要是由于在較低的熱解溫度下,CO和CO2主要是由羧基和羧基化合物分解產生;而在高溫條件下,這兩種氣體主要是從醚結構、醌類以及含氧雜環化合物的分解。而由圖2(b)可以看出,在CO2和CO2+CH4混合氣氛下在熱解溫度大于600℃時,熱解氣相產物CO釋放強度迅速增大,且CO2+CH4混合氣氛下CO的釋放強度小于CO2氣氛下。這主要是由于當熱解溫度大于600 ℃時,煤樣與CO2發生氣化反應釋放CO,CO2+CH4混合氣氛下CO2氣體分壓小于單獨CO2氣氛下的分壓。
由圖2(d)可知,隨著熱解溫度升高,H2析出強度增大,CO2+CH4混合氣氛下H2析出強度最大,而在H2氣氛下熱解產物H2析出強度最小,這主要是由于CO2+CH4混合氣氛下CO2和CH4發生重整反應,釋放出甲基、亞甲基以及含氫自由基[12],而這些自由基與煤樣本身熱解產生的含氫自由基反應形成H2,進而導致CO2+CH4混合氣氛下H2析出強度最大。
2.3 動力學分析
在本文的研究中,用Coats-Redfern 積分法對不同氣氛下煤樣熱解過程中熱解反應初始階段(Ⅰ)、熱解反應第二階段(Ⅱ)以及熱解反應第三階段(Ⅲ)的動力學參數進行計算。以在N2氣氛熱解為例,ln[G(x)/T2]與1/T關系如圖3所示,反應動力學參數見表2。在本研究中,根據轉化率x分別計算出每個熱解階段的動力學參數。由表2可以看出,在N2和CO2氣氛下采用一級反應(n=1)和二級反應(n=2)可以更好的表示煤的熱解過程,此時R2>0.99。而在CO2氣氛下,在熱解反應第二階段和第三階段,則采用二級反應(n=2)和三級反應(n=3)可以更好的描述煤的熱解過程,這主要是由于在CO2氣氛下煤樣與CO2發生氣化反應過程中涉及的反應較多,這與前人的研究結果相一致[13]。在H2氣氛下,在熱解反應第一階段,采用一級反應(n=1)可以更好的表示煤的初級熱解過程,此時R2>0.99;而隨著反應的進行,熱解揮發分釋放過程中,H2與揮發分中的自由基發生反應,使自由基得到電子形成穩定態。由于熱解過程中,析出的揮發分中自由基種類較多,反應過程較為復雜,因此采用三級反應(n=3)可以更好的表示煤的熱解過程,此時R2>0.99。
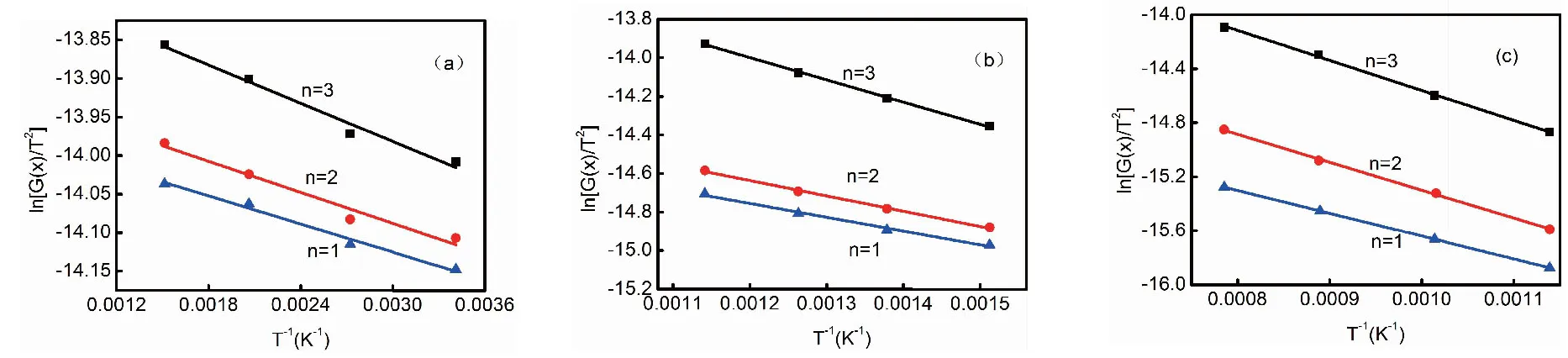
圖3 煤樣在N2下不同熱解階段的 ln[G(x)/T2]與1/T關系曲線
在CH4氣氛下,由于CH4在相對較低的熱解溫度下(<600℃)性質較為穩定。因此,在熱解反應第一階段和第二階段均可采用一級反應(n=1)進行描述熱解過程;而隨著熱解溫度升高,在熱解反應第三階段,CH4發生分解,形成甲基和含氫自由基,在熱解過程過程中,這些自由基與煤熱解揮發分形成的自由基反應。因此可采用三級反應(n=3)進行描述該熱解反應過程[14]。而在CO2+CH4混合氣氛下,在熱解反應初始階段可采用一級反應(n=1)描述熱解過程,這與前人在CH4氣氛下對煤樣進行脫水的動力學研究結果相一致。而隨著熱解反應溫度的升高,在第二熱解反應和第三熱解反應階段,采用三級反應(n=3)描述熱解過程更為合適,這主要是由于在混合氣氛下,CH4和CO2發生重整反應過程中釋放出含氫自由基,這些自由基參與了煤熱解揮發分中自由基形成穩定化合物的反應進程[15]。
3 結 論
1)在煤樣發生熱解反應之前,熱解氣氛對于煤樣中揮發分的析出影響不大。在480 ℃左右出現最大失重速率峰,失重速率由小到大依次為0.12(CH4)< 0.17(N2)<0.20(CO2+CH4)<0.21(CO2)<0.26(H2)mg/min。
2)不同熱解氣氛下,熱解氣體產物CO和CO2釋放規律相似;在CO2和CO2+CH4混合氣氛下在熱解溫度大于600℃時,熱解氣相產物CO釋放強度迅速增大,且CO2+CH4混合氣氛下CO的釋放強度小于CO2氣氛下。
3)在N2和CO2氣氛下采用一級反應(n=1)和二級反應(n=2)可以更好的表示煤的熱解過程。由于在混合氣氛下,CH4和CO2發生重整反應過程中釋放出含氫自由基,在第二熱解反應和第三熱解反應階段,采用三級反應(n=3)描述熱解過程更為合適。

