TFB1M在結直腸癌中的表達及意義
楊世榮 陳艷琴 白翔宇 甘露 何顯力
結直腸癌發病率和死亡率在世界范圍內分別位居第三和第二位[1]。大多結直腸癌患者確診時已處于中晚期,患者預后差異較大。但目前結直腸癌發病及進展的機制尚不完全清楚,可用于預測患者預后的標志物亦有限。線粒體是一種能量供應的重要細胞器,參與ATP合成,可調控細胞氧化還原狀態,介導細胞信號轉導、細胞凋亡和生物合成代謝等[2]。大量研究證實,線粒體功能異常幾乎在所有腫瘤進展中發揮關鍵調控作用[3-6]。線粒體轉錄因子 B1(mitochondria transcription factor B1,TFB1M)是線粒體轉錄起始因子,在調控線粒體氧化磷酸化相關蛋白質合成中發揮重要作用,已被證實在多種實體腫瘤中表達異常[7-8],但在結直腸癌中的作用尚不明確。本研究通過檢測結直腸癌組織中TFB1M的表達并利用癌癥基因組圖譜(the Cancer Genome Atlas,TCGA)公共數據庫的結直腸癌患者轉錄組數據及臨床樣本信息,分析TFB1M表達與患者預后的相關性,同時在結直腸癌細胞中調控TFB1M的表達后觀察其對細胞增殖的影響,探討TFB1M與結直腸癌的關系,為結直腸癌患者預后預測及治療尋找新的靶點。
1 材料與方法
1.1 主要材料及試劑
人結直腸癌細胞株SW620和HCT116購自ATCC細胞庫。胎牛血清購自中國BBI Life Sciences公司,青鏈霉素混合液購自中國索萊寶公司,DMEM培養基購自中國瑞博公司,BCA蛋白定量試劑盒購自中國碧云天公司,蛋白Marker購自美國Thermo Fisher公司,MTS檢測試劑盒購自美國 Promega公司,β-actin抗體和兔二抗購自中國北京天德悅公司,TFB1M抗體購自美國OriGene公司,攜帶TFB1M干涉、過表達質粒的慢病毒購自中國上海吉瑪基因公司。
1.2 組織樣本來源
收集2015年1月至2019年1月于空軍軍醫大學唐都醫院手術治療的112例結直腸癌患者的臨床資料。所有患者術前均未經任何抗腫瘤治療,其癌組織及相應癌旁正常組織標本均經病理檢查確診,并由2位病理學醫師診斷及復核。所有組織樣本取下后立即液氮冷凍,-80℃冰箱保存。本研究獲得空軍軍醫大學唐都醫院醫學倫理委員會批準,所有患者均簽署知情同意書。中位隨訪時間為28個月,總生存期定義為手術日至患者死亡或末次隨訪的時間。
1.3 免疫組織化學法檢測TFB1M的表達
組織標本經10%中性福爾馬林緩沖液固定,常規脫水、浸蠟、石蠟包埋,4 μm厚連續切片。石蠟切片常規烤片、脫蠟后用檸檬酸鈉進行抗原高壓修復,山羊血清室溫封閉,滴加稀釋的TFB1M抗體(1∶800),4℃孵育過夜,兔二抗室溫孵育1 h,DAB顯色,蘇木素復染,中性樹膠封片。以PBS代替一抗為陰性對照。細胞染色強度評分:無染色計0分,黃色計1分,棕黃色計2分,棕褐色計3分。細胞陽性率評分:0~9%計0分,10%~25%計1分,26%~50%計2分,51%~75%計3分,76%~100%計4分。陽性綜合評分為染色強度評分與陽性細胞率評分的乘積:≤3分為低表達,>3分為高表達。
1.4 TCGA數據分析
利用Bioconductor/TCGAbiolinks函數包從TCGA(http://tcga-data.nci.nih.gov/tcga/) 數據庫下載 575 例結直腸癌患者的mRNA表達二代測序數據及相應的臨床信息。以基因表達中位值(5.8)分組,>5.8為TFB1M高表達組,≤5.8為TFB1M低表達組。
1.5 細胞培養和慢病毒轉染
人結直腸癌細胞SW620和HCT116用含10%胎牛血清和1%青鏈霉素混合液的DMEM培養基于37℃、5%CO2培養箱中培養。胰蛋白酶消化處于對數生長期細胞,以5×104/孔接種于6孔板,實驗分為4組:shCtrl組轉染陰性干涉質粒慢病毒,shTFB1M組轉染TFB1M干涉質粒慢病毒,EV組轉染含空載質粒慢病毒,TFB1M組轉染含TFB1M過表達質粒的慢病毒。待細胞貼壁后進行慢病毒轉染:960 μL無血清DMEM培養基+40 μL感染增強液+5 μL病毒原液(病毒濃度為1×108/mL),10 h后更換含血清培養基。轉染48 h后用熒光倒置顯微鏡觀察轉染效率,采用嘌呤霉素(濃度為5 ng/mL)進行病毒轉染抗性篩選。
1.6 Western blot檢測TFB1M的表達
RIPA裂解液裂解細胞后提取細胞蛋白,BCA法檢測蛋白濃度,調節蛋白濃度并添加5×蛋白上樣緩沖液,100℃水浴10 min后上樣,10%聚丙烯酰胺分離凝膠電泳,轉至PVDF膜。用含5%脫脂奶粉的TBST室溫封閉,添加一抗TFB1M(稀釋比例為1∶1 000),4 ℃孵育過夜;二抗β-actin(稀釋比較為1∶3 000)室溫孵育1 h,TBST洗滌液清洗,然后采用熒光成像進行定量檢測,Image J軟件分析條帶,以β-actin蛋白條帶灰度值為參照。
1.7 MTS法檢測細胞增殖能力
胰蛋白酶消化對數生長期的慢病毒穩定轉染SW620和HCT116細胞,以2×103/孔細胞密度接種至96孔板,設5個復孔及陰性對照,待細胞貼壁后加入20 μL/孔MTS工作液,置于37℃、5%CO2細胞培養箱中孵育1 h。利用酶標儀于490 nm波長處檢測各孔吸光度值,記錄為起始數據(0 h),同樣方法分別于 24 h,48 h,72 h,96 h再次檢測,根據記錄數據繪制細胞增殖曲線。
1.8 統計學方法
采用SPSS 16.0軟件進行統計學分析,計量資料以均數±標準差(±s)表示,兩組比較采用獨立樣本t檢驗;采用Kaplan-Meier法計算生存率,兩組生存曲線比較采用Log-rank檢驗,Cox等比例風險回歸模型分析TFB1M表達水平與總生存期的關系,計算風險比(HR)及其對應的95%可信區間(CI)。shCtrl組和shTFB1M組細胞增殖能力的差異,采用重復測量方差分析。以P<0.05為差異有統計學意義。
2 結果
2.1 TFB1M在結直腸癌組織及癌旁正常組織中的表達
免疫組織化學法檢測結果顯示,TFB1M主要染色于細胞質,癌旁正常結腸上皮細胞大部分呈中至強染色,結直腸癌細胞呈部分弱染色。結直腸癌組織及其癌旁正常組織中TFB1M的陽性表達評分分別為(3.79±1.66)分和(8.14±1.82)分,差異有統計學意義(P<0.01),見圖 1。
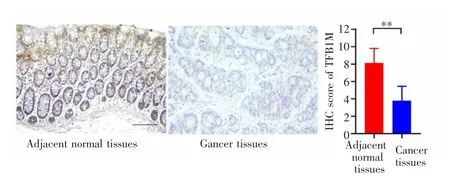
圖1 TFB1M在結直腸癌組織及癌旁正常組織中的表達(SP×200)Fig.1 Expression of TFB1M in colorectal cancer tissues and adjacent normal tissues(SP×200)
2.2 基于TCGA數據庫分析TFB1M表達與結直腸癌患者臨床特征及預后的關系
TCGA公共數據庫數據分析顯示,TFB1M在Ⅲ+Ⅳ期患者癌組織中的表達較Ⅰ+Ⅱ期患者顯著降低(P=0.010),而不同年齡、性別患者TFB1M表達差異無統計學意義(P>0.05),見表 1。Kaplan-Meier生存分析顯示,TFB1M高表達患者和低表達患者的中位生存時間分別為99個月和79個月,兩組生存曲線比較差異有統計學意義(P=0.038),見圖2。

表1 TCGA數據庫中TFB1M表達與結直腸癌患者臨床特征的關系Tab.1 The relationship between the expression of TFB1M and clinical features of patients with colorectal cancer of TCGA

圖2 TCGA數據庫中TFB1M表達與結直腸癌患者預后的關系Fig.2 The relationship between expression of TFB1M and prognosis of patients with colorectal cancer of TCGA
2.3 基于TCGA數據庫的單因素和多因素分析
基于TCGA數據庫的單因素Cox模型分析結果顯示,TFB1M mRNA表達水平、年齡、TNM分期與結直腸癌患者術后總生存期有關(P<0.05),多因素Cox模型分析顯示,年齡、TNM分期和TFB1M mRNA表達水平是影響結直腸癌患者術后總生存期的獨立因素(P<0.05),見表 2。

表2 TCGA數據庫中結直腸癌患者術后總生存期的單因素和多因素分析Tab.2 Univariate analysis and multivariate analysis of postoperative overall survival in patients with colorectal cancer of TCGA
2.4 基于臨床樣本分析TFB1M表達與結直腸癌患者臨床特征及預后的關系
不同年齡、性別的結直腸癌患者TFB1M表達差異無統計學意義(P>0.05),但TFB1M在Ⅲ+Ⅳ期患者中的表達較Ⅰ+Ⅱ期患者顯著降低,差異有統計學意義(P=0.005),見表 3。Kaplan-Meier生存分析顯示,TFB1M高表達患者和低表達患者的中位生存時間分別為33個月和23個月,兩組生存曲線比較差異有統計學意義(P=0.008),見圖 3。
2.5 基于臨床樣本的單因素和多因素分析
單因素Cox模型分析發現,TFB1M蛋白表達水平(P=0.002)、年齡(P=0.005)和 TMN 分期(P<0.001)與結直腸癌患者總生存期有關。多因素Cox模型分析顯示TFB1M表達水平是影響結直腸癌患者總生存期的獨立因素(P=0.029)。見表4。
2.6 慢病毒轉染結直腸癌細胞SW620和HCT116后TFB1M的表達水平
Western blot檢測結果顯示,SW620細胞和HCT116細胞中,shTFB1M組TFB1M表達均較shCtrl組顯著降低(0.32±0.03 vs 0.93±0.12,P<0.001;0.17±0.05 vs 0.56±0.11,P<0.001),而 TFB1M 組 TFB1M 的表達均顯著高于 EV 組(1.49±0.19 vs 0.94±0.08,P<0.001;1.63±0.08 vs 0.62±0.06,P<0.001),見圖4。說明TFB1M干涉和過表達結直腸癌細胞SW620和HCT116構建成功。
2.7 干涉/過表達TFB1M對結直腸癌細胞增殖能力的影響
MTS實驗檢測結果顯示,SW620細胞和HCT116細胞中,shTFB1M組的細胞增殖能力均較shCtrl組顯著增強(F=80.6,P<0.001;F=532.6,P<0.001),而 TFB1M組細胞增殖能力均較EV組下降(F=130.2,P<0.001;F=55.0,P=0.002),見圖 5。

圖3 TFB1M表達與結直腸癌患者預后的關系Fig.3 The relationship between expression of TFB1M and prognosis of patients with colorectal cancer

表3 TFB1M表達與結直腸癌患者臨床特征的關系Tab.3 The relationship between the expression of TFB1M and clinical features of patients with colorectal cancer

表4 影響結直腸癌患者術后總生存期的單因素和多因素分析Tab.4 Univariate analysis and multivariate analysis of postoperative overall survival in patients with colorectal cancer

圖4 Western blot檢測轉染后SW620和HCT116細胞中TFB1M蛋白的表達Fig.4 Expression of TFB1M in SW620 and HCT116 cells after lentivirus transfection were detected by Western blot

圖5 MTS法檢測干涉/過表達TFB1M后結直腸癌細胞SW620和HCT116的增殖能力Fig.5 The proliferation of SW620 and HCT116 cells after interference/overexpression of TFB1M detected by MTS
3 討論
結直腸癌的發生是遺傳因素和環境因素共同作用的復雜過程[9]。結直腸癌進展過程中,細胞能量代謝變化和活性氧等信號轉導發揮著重要調控作用[10]。線粒體是細胞重要的能量代謝樞紐,也是活性氧和活性氮的重要來源,在腫瘤進展各個階段可通過代謝重編程、分裂融合、氧化還原穩態、氧化應激信號傳導等方式影響腫瘤細胞生長和生存。線粒體DNA(mtDNA)具有獨立的環狀雙鏈DNA,由線粒體RNA聚合酶(mtRNAP)、線粒體轉錄因子 A(TFAM)、TFB1M、線粒體轉錄因子B2(TFB2M)組成的轉錄起始復合物可參與mtDNA上各種基因的轉錄調控,從而影響線粒體功能發揮[8]。TFB1M作為轉錄起始復合物的重要組成部分,其表達異常可直接影響細胞線粒體的功能發揮[11]。研究發現與TFB1M功能相似的其他線粒體轉錄因子,如TFAM 在腎細胞癌[12]和肺癌[13]等多種腫瘤中發揮重要作用。在結直腸癌中,TFAM的雜合性缺失可導致腸上皮細胞線粒體功能異常、活性氧(reactive oxygen species,ROS)蓄積,進而促進小鼠腸道自發成瘤[14]。同樣在微衛星不穩定結直腸癌中,TFAM框移突變也可通過降低mtDNA拷貝數而誘導結直腸癌細胞對順鉑等化療藥物抵抗[15]。以上研究提示線粒體相關轉錄因子在惡性腫瘤發生進展中發揮著重要作用。
本研究收集結直腸癌患者手術切除樣本及臨床資料,免疫組織化學法檢測證實TFB1M在結直腸癌組織中表達下調,結合TCGA公共數據庫中結直腸癌組織表達譜數據和臨床樣本信息分析TFB1M與患者臨床病理特征的關系,結果發現兩組數據中TFB1M在Ⅲ+Ⅳ期患者中的表達均較Ⅰ+Ⅱ期患者顯著降低,且TFB1M低表達患者術后總生存期顯著低于高表達患者,多因素Cox回歸分析發現TFB1M是影響患者總生存的獨立因素,說明TFB1M可能參與結直腸癌發生,且TFB1M低表達患者預后不良。本研究進一步在細胞水平研究TFB1M與結直腸癌的關系,通過慢病毒轉染法分別在結直腸癌SW620和HCT116細胞中干涉和過表達TFB1M,結果發現干涉TFB1M可顯著促進結直腸癌SW620和HCT116細胞的增殖能力,而過表達TFB1M則抑制其增殖能力,初步證實TFB1M表達異常可能通過影響線粒體功能而對結直腸癌細胞增殖發揮調控作用。既往有研究報道TFB1M缺失可導致細胞線粒體功能異常,進而引起活性氧蓄積[16]。而ROS與腫瘤發生進展密切相關,可引起細胞中包括DNA在內的大分子損傷,是體內誘導細胞癌變的重要危險因素[17-18]。TFB1M在結直腸癌中表達降低是否通過引起ROS蓄積,進而促進抑癌基因突變和促癌基因活化導致細胞增殖能力增強仍有待進一步探討。
本研究通過公共數據分析和臨床樣本驗證,以及體外細胞實驗證實TFB1M在結直腸癌中低表達,且低表達者預后較差,干涉TFB1M可促進結直腸癌細胞增殖,TFB1M可能是結直腸癌潛在的預后評估標志物和治療靶點。但本研究納入臨床樣本量有限,TFB1M在結直腸癌中表達異常及其與患者預后的相關性,以及在結直腸癌發生發展中的具體作用仍需擴大臨床樣本量及動物模型進一步研究。

