隱丹參酮對順鉑耐藥肺癌細胞磷酸戊糖途徑相關蛋白的影響及機制探討
譚國耀,洪偉鵬,張蕾,曹霖,王黛菲,金晶
(中山大學藥學院,廣東 廣州 510006)
肺癌是一種起源于支氣管黏膜或腺體的惡性腫瘤,其發病率和死亡率居高不下,且增長迅速,對人類的生存和健康構成巨大威脅。雖然目前肺癌的檢測和治療手段在不斷進步,但是據統計,患者的5年生存率仍然不足15%[1]。目前,肺癌的常用治療手段包括化療、放療、手術和分子靶向治療,其中以順鉑等為代表的傳統化療藥物仍然是治療肺癌各個階段的重要藥物[2]。但是隨著患者疾病的進展,患者往往會對這些化療藥物產生一定的耐藥性。因此,尋找有效的逆轉耐藥、增加患者對化療藥物敏感性的治療方式顯得非常重要。
磷酸戊糖途徑(pentose phosphate pathway,PPP)是葡萄糖代謝的主要途徑之一,由氧化分支和非氧化分支構成,主要產物包括NADPH、磷酸核糖以及其他四碳、五碳、七碳化合物,影響細胞的脂質、核酸的合成以及其他代謝途徑,是一條具有多功能的重要代謝途徑[3]。大量的研究表明,多數腫瘤細胞中PPP的活性異常,PPP的異常改變直接影響了腫瘤細胞的存活、增殖和衰老。除此之外,研究還發現PPP受到包括癌基因蛋白、腫瘤抑制因子和細胞內代謝物等多種因素的影響[4]。因此PPP對于腫瘤的發生發展具有非常重要的作用。
隱丹參酮(cryptotanshinone,CTS)是傳統中藥丹參中的一種脂溶性的有效成分,最初因其抗心血管疾病的功效引起研究者的關注。而近年來,關于CTS抗腫瘤的研究逐漸增多,大量研究發現,CTS可以通過引起癌細胞周期阻滯、抑制癌細胞增殖、誘導癌細胞凋亡和抑制腫瘤血管生成和遷移等機制來發揮抗腫瘤效果。因此,CTS在抗癌上有著廣闊的應用前景。
本研究初步探討CTS對A549/CDDP細胞PPP相關蛋白表達的影響及其可能的機制,為進一步開展CTS的抗腫瘤作用機制研究提供思路,并為CTS用于肺癌治療提供理論基礎和實驗依據。
1 材料與方法
1.1 藥物與試劑 CTS(中國藥品生物制品檢定所);胎牛血清(美國Gibco公司);青霉素鏈霉素溶液、DMEM培養基、0.25%胰蛋白酶-EDTA(美國Hyclone公司);CCK-8試劑盒(日本同仁化學研究所);Trizol試劑、逆轉錄、SYBR green試劑(日本Takara公司);RIPA細胞裂解液、BCA蛋白濃度檢測試劑盒(美國Thermo Fisher公司);ECL化學發光液(北京Engreen公司);兔抗G6PD、PGD、TKT、GAPDH抗體(美國Cell Signaling Technology公司);兔抗TALDO1(上海生工生物工程股份有限公司);兔抗NRF2抗體(美國Abcam公司)。
1.2 細胞 人肺癌A549細胞和順鉑耐藥A549/CDDP細胞由中國醫學科學院中國協和醫科大學腫瘤研究所饋贈。
1.3 儀器 二氧化碳培養箱(美國Thermo Fisher公司);低溫高速離心機(德國Eppendorf公司);PCR儀(德國Eppendorf公司);實時熒光定量PCR系統(美國Applied Biosystems公司);電泳、電轉系統(美國Bio-Rad公司);ImageQuant LAS 4000曝光成像儀(美國General Electric公司);多功能酶標儀(美國Thermo Fisher公司)。
1.4 方法
1.4.1 A549細胞和A549/CDDP細胞的培養 A549細胞和A549/CDDP細胞接種于含有10%胎牛血清、1%青霉素-鏈霉素的DMEM培養基中,置于37 ℃、5% CO2培養箱中培養、傳代。當細胞處于對數生長期時,可用于實驗。
1.4.2 CCK-8法測細胞存活率 將處于對數生長期的A549細胞和A549/DDP細胞分別接種于96孔板中,每孔100 μL,培養24 h。給藥分組如下:空白對照組,50 μmol·L-1CDDP組,2.5 μmol·L-1CTS組,2.5 μmol·L-1CTS合用50 μmol·L-1CDDP組,每組設4個復孔,每孔加入100 μL。用不含血清的DMEM培養基稀釋藥物,使其終濃度分別為上述分組所示,空白對照組為含相同濃度DMSO的DMEM培養基。培養48 h后,將孔中液體吸出,另設4個空白復孔,每孔加入100 μL含10% CCK-8的無血清DMEM培養基,培養1 h后,置于搖床上低速震蕩30 s,使孔內顏色分布均勻。檢測波長為450 nm的吸光度值(optical density,OD),細胞存活率=(實驗組OD - 空白孔OD)/(對照組OD-空白孔OD)×100%。
1.4.3 qPCR檢測mRNA表達 取處于對數生長期的A549細胞和A549/CDDP細胞接種于12孔板,待細胞融合度為90%左右終止細胞培養。分別提取兩種細胞的總RNA,按照說明書的步驟逆轉錄成cDNA,以cDNA為模板,qPCR檢測PPP相關的G6PD、PGD、TKT、TALDO1的mRNA表達水平,以ACTB作為內參。引物序列見表1。
1.4.4 Western blot檢測蛋白表達 A549細胞和A549/CDDP細胞不經藥物處理或經不同濃度CTS處理48 h后,終止培養。棄去培養基,PBS洗滌2次,棄去殘余的PBS,每孔加入100 μL裂解液,置于冰上裂解30 min,刮取孔內細胞及裂解液收集于1.5 mL EP管中,超聲10 s,于4 ℃ 16 000 g離心20 min,獲得細胞總蛋白。進行蛋白定量后,加入適量的5×SDS-PAGE上樣緩沖液,沸水浴變性10 min。按每孔25 μg總蛋白計算上樣量,進行電泳操作,電泳分離后,電轉至PVDF膜上,用5%脫脂牛奶室溫封閉1 h,加入一抗G6PD、PGD、TKT、TALDO1、NRF2、AKT和GAPDH ,4 ℃孵育過夜,TBST洗膜3次,每次7 min,加入二抗,室溫孵育1 h,TBST洗膜3次,每次7 min,顯影。使用Image J軟件分析結果。

表1 qPCR引物序列
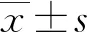
2 結果
2.1 A549細胞和A549/CDDP細胞PPP相關基因mRNA及蛋白表達水平的差異 如圖1所示,與A549細胞相比,順鉑耐藥A549/CDDP細胞G6PD、GPD、TKT和TALDO1的mRNA水平明顯升高(P<0.001);而如圖2所示,G6PD(P<0.001)、PGD(P<0.001)和TALDO1(P<0.05)的蛋白表達水平明顯上升,表明兩種細胞在PPP代謝上存在著差異,A549/CDDP細胞PPP代謝可能更加旺盛。
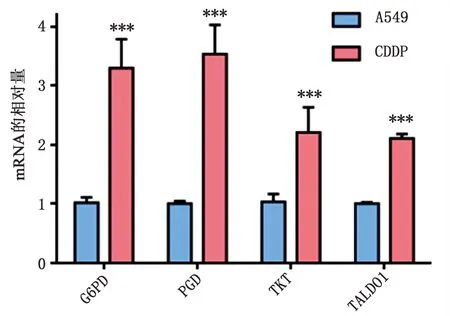
圖1 A549細胞和A549/CDDP細胞PPP相關基因mRNA表達水平

圖2 A549細胞和A549/CDDP細胞PPP相關蛋白表達水平
2.2 CTS對順鉑處理A549/CDDP細胞后細胞存活率的影響 如圖3所示,CTS能夠明顯降低順鉑處理A549/CDDP細胞后細胞的存活率(P<0.05),而對順鉑處理A549細胞后的存活率影響不明顯,表明CTS能增加A549/CDDP細胞對順鉑的敏感性,從而增加順鉑對A549/CDDP細胞的殺傷效果。
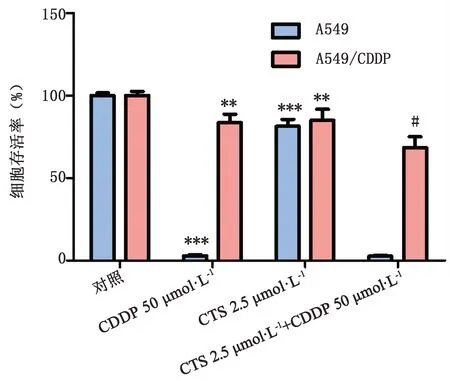
圖3 CTS對順鉑處理后細胞存活率的影響
2.3 CTS對A549/CDDP細胞PPP相關蛋白表達水平的影響 如圖4所示,CTS處理后,A549/CDDP細胞內TKT蛋白表達水平顯著下調(P<0.001),且呈現出一定的劑量依賴性,而G6PD、PGD和TALDO1蛋白表達水平變化不明顯,表明CTS對A549/CDDP細胞中PPP相關蛋白TKT的表達具有一定的抑制作用。
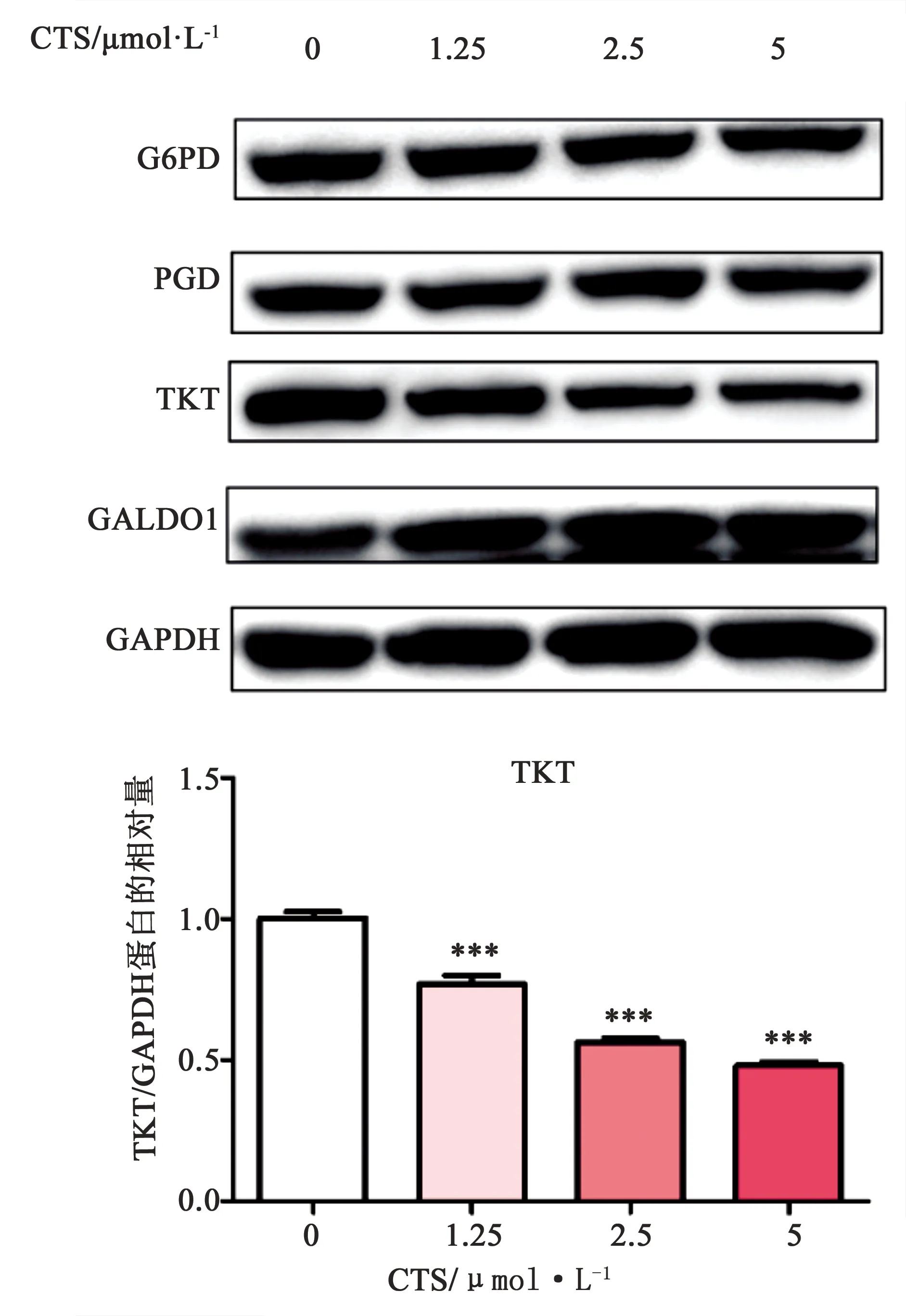
圖4 CTS對A549/CDDP細胞PPP相關蛋白表達的影響
2.4 CTS對A549/CDDP細胞AKT、NRF2蛋白表達水平的影響 如圖5所示,CTS能夠明顯下調A549/CDDP細胞AKT的蛋白表達水平(P<0.05),且這種調節作用具有一定的劑量依賴性;此外,當CTS濃度超過2.5 μmol·L-1時,能夠明顯下調A549/CDDP細胞NRF2的蛋白表達水平(P<0.001)。
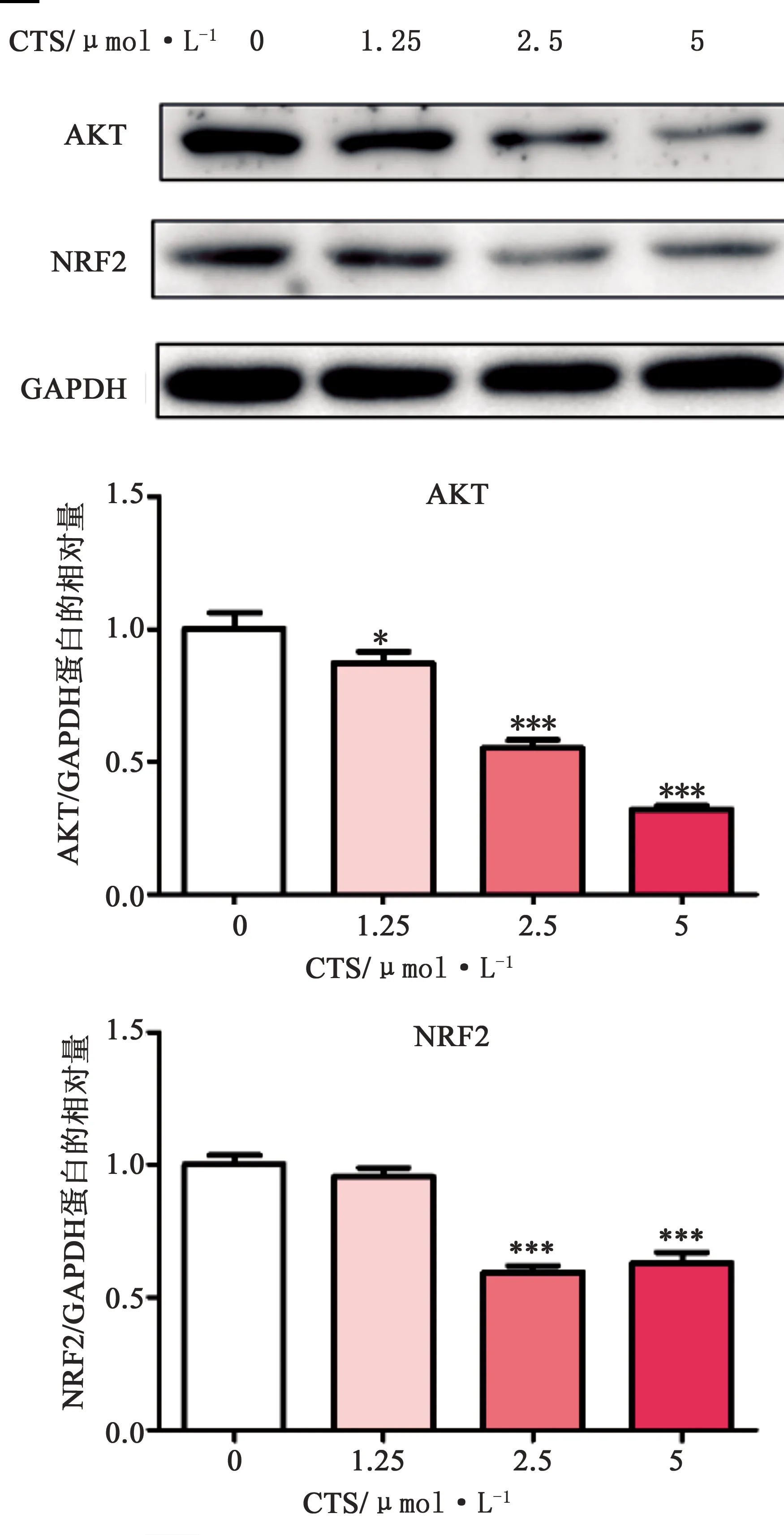
圖5 CTS對A549/CDDP細胞AKT、NRF2蛋白表達的影響
3 討論
磷酸戊糖途徑,也稱為磷酸葡萄糖酸途徑,是葡萄糖分解代謝的主要途徑之一。大量的研究表明,PPP對腫瘤細胞生長增殖具有重要的調控作用[5]。PPP主要包含氧化分支和非氧化分支,G6PD是葡萄糖進入PPP氧化分支中的第一個限速酶,也是控制PPP速率和活性的關鍵酶,PGD則催化G6PD的催化產物氧化脫羧,生成核酮糖-5-磷酸進入非氧化分支。而TKT和TALDO1是非氧化分支中的兩個關鍵酶,調節PPP兩個分支的活性和速率平衡[6]。而研究發現,順鉑耐藥A549/CDDP細胞中上述PPP相關蛋白表達升高,提示順鉑耐藥的產生可能與PPP相關蛋白的表達升高有關。
CTS是傳統中藥丹參中的一種有效成分,在抗炎、抗氧化和抗心血管疾病中均有較好的藥理作用。在腫瘤治療方面,研究發現,CTS可以通過上游靶點影響細胞增殖,引起周期阻滯或者誘導凋亡[7-8];另外,CTS可以抑制腫瘤血管的生成并抑制腫瘤的遷移[9-10]。除此之外,CTS在逆轉耐藥或者抗癌藥物的增敏上也具有一定的作用,研究發現,CTS可以通過下調腫瘤細胞中P-gp的表達,是細胞內的藥物外排減弱,從而增強化療藥物如阿霉素等的治療效果,有效逆轉腫瘤細胞株的耐藥性[11]。本研究發現,CTS可以增加順鉑耐藥A549/CDDP細胞對順鉑的敏感性,從而使細胞的存活率降低。
近年來的研究表明,多種致癌途徑參與了癌細胞代謝調控。PI3K/AKT通路調控細胞生長和生存,NRF2是維持氧化還原穩態的關鍵調控因子,對包括侵襲性增殖在內的癌癥的惡性表型的維持具有重要的調控作用。研究表明,活躍的PI3K/AKT通路增強NRF2的核累積,激活PPP相關基因的表達,促進細胞代謝活動從而促進癌細胞的增殖[12]。此外,AKT還能通過磷酸化TKT,顯著增強其酶活性,增強PPP非氧化分支代謝PPP,從而對癌細胞的生長具有非常重要的作用[13]。研究發現,CTS可以顯著下調A549/CDDP細胞中TKT的蛋白表達水平,同時CTS還可以顯著下調A549/CDDP細胞中AKT和NRF2的蛋白表達水平,提示CTS很有可能通過下調AKT和NRF的表達,從而抑制PPP相關蛋白TKT的表達,抑制耐藥細胞相關的代謝途徑,從而使耐藥細胞對順鉑的敏感性增加,從而對耐藥細胞的生長和增殖起到抑制作用。
綜上所述,CTS能夠增加順鉑耐藥A549/CDDP細胞對順鉑的敏感性,其機制可能通過抑制AKT和NRF2的表達從而抑制PPP相關蛋白TKT的表達,抑制細胞的PPP代謝,從而增加細胞對順鉑的敏感性,使細胞生長受到抑制。本研究為開展CTS的抗腫瘤相關機制研究提供思路,并為CTS用于肺癌治療提供理論基礎和實驗依據。

