GST pull-down結合質譜篩選豬圓環病毒2型ORF4潛在互作蛋白
林翠,唐雯,顧金燕,2,金玉蘭,董偉仁,廖敏,周繼勇
1 浙江大學 動物科學學院 農業部動物病毒學重點實驗室,浙江 杭州 310058
2 南京農業大學 免疫研究所,江蘇 南京 210000
豬圓環病毒2型 (PCV2) 是斷奶仔豬多系統衰竭綜合征 (Post-weaning multisystemic wasting syndrome,PMWS) 的主要病原[1]。該病流行范圍廣、傳播速度快,是嚴重影響養豬業發展的重要傳染病之一[2]。PCV2屬于圓環病毒科圓環病毒屬,是迄今發現的能在哺乳動物細胞內自主復制的最小動物病毒,病毒粒子直徑約為17 nm,無囊膜,基因組為單鏈環狀DNA[3]。PCV2基因組全長1 766–1 768 nt,預測含有11個開放閱讀框(Open reading frame, ORF)[4]。目前僅5個orf的編碼產物被證實,orf1編碼的Rep和Rep’蛋白,是病毒的復制酶[5];orf2編碼衣殼蛋白Cap,是病毒的結構蛋白,也是病毒引起宿主免疫應答的主要抗原[6-7];orf3、orf4和orf5編碼的蛋白非病毒復制所必需,前兩者與病毒誘導的細胞凋亡相關[8-9],后者可能與內質網壓力及NF-κB的激活相關[10]。
前期研究報道,ORF4蛋白的缺失不僅影響病毒誘導的細胞凋亡水平,還影響了宿主體內的免疫細胞數量[9],提示ORF4蛋白與病毒致病力密切相關。Gao等對比orf4缺失毒與野毒感染情況下病毒各蛋白轉錄水平,發現缺失毒感染后orf3轉錄水平顯著高于野毒,從而推測ORF4蛋白通過降低orf3轉錄量間接抑制凋亡誘導[11]。Lv等通過酵母菌雙雜交試驗篩選出4個與ORF4結合的宿主蛋白,利用激光共聚焦、免疫共沉淀及GST pull down試驗證實重鏈鐵蛋白 (Ferritin heavy chain,FHC) 與ORF4蛋白結合[12]。深入探究發現FHC與ORF4結合致使胞內FHC濃度減少,隨后抑制活性氧簇 (Reaction oxygen species,ROS) 的大量聚集,最終拮抗凋亡[13]。最近,本實驗室研究發現ORF4具有核質雙重定位特征,定位胞漿的ORF4蛋白與線粒體內膜蛋白腺嘌呤易位體 3 (Adenine nucleotide translocator 3,ANT3) 結合激活線粒體凋亡通路,從而誘導細胞凋亡[14]。現今,對ORF4的研究主要與凋亡相關,該蛋白的其他特性及功能仍不甚明了。因此,探討并揭示ORF4的胞內互作蛋白有助于對ORF4功能的研究。文中通過GST pull-down聯合質譜技術,對細胞中與ORF4互作的潛在蛋白進行篩選和鑒定。嘗試尋找ORF4參與病毒感染的具體通路,為ORF4蛋白的生物學功能及其作用機制研究奠定基礎。
1 材料與方法
1.1 生物材料及主要試劑
PCV2 HZ0201株 (AY188355) 由本實驗室分離、鑒定并保存[4];HEK293T cells (ATCC,CRL-11268) 購自ATCC細胞庫并由本實驗室傳代保存;克隆宿主菌DH5α由本實驗室保存;質粒pGEX-4T-1購自GE Healthcare Life Biosciences公司;pCMV-N-Flag真核表達載體及pDsRed2-Mito購自Clontech Laboratories公司;UNIQ-10柱式病毒基因組DNA抽提試劑盒購自生工生物工程(上海) 股份有限公司;ClonExpress?II One Step Cloning Kit購自南京諾唯贊生物科技有限公司;Flag鼠單抗購自Sigma-Aldrich公司;GST鼠單抗購自杭州華安生物技術有限公司;ORF4鼠單抗6A5由本實驗室保存;FITC標記羊抗鼠IgG (H+L)購自美國KPL公司;DAPI購自Roche Life Science公司;谷胱甘肽瓊脂糖珠 (GST) 購自Santa Cruz Biotechnology公司。
1.2 pCMV-N-Flag-GST真核表達載體改造及pCMV-N-Flag-GST-ORF4重組質粒構建
1.2.1 pCMV-N-Flag-GST真核表達載體改造
以pCMV-N-Flag質粒為骨架構建含Flag以及GST雙標簽的重組質粒用于后續研究。首先,使用Hind Ⅲ酶切載體pCMV-N-Flag,回收備用,同時以原核表達載體pGEX-4T-1為模板擴增gst片段,再通過同源重組方法將gst片段插入至pCMV-N-Flag載體多克隆位點 (MCS) 中Hind Ⅲ下游,且保證不影響Hind Ⅲ下游MCS的使用。擴增gst的引物序列為:GST-上游引物:5′-CAAG GACGACGATGACAAGCTTATGATTAGTGTACA CCACC-3′,GST-下游引物:5′-CGAATTCGGGCCTCCATGGCCATTATATCAGCAGAATTTC-3′ (下劃線部分為同源重組臂)。
1.2.2 構建pCMV-N-Flag-GST-ORF4重組質粒
使用病毒基因組抽提試劑盒提取的PCV2 HZ0201的基因組為模板,引物:ORF4-上游引物:5′-CGGAATTCGGATGACGTGTACATTAGTCTT CC-3′,ORF4-下游引物:5′-CCCTCGAGTCAGGG ACAACGGAGTGACCTGTC-3′ (下劃線部分為酶切位點),PCR擴增獲得orf4片段,利用EcoRⅠ、XhoⅠ雙酶切改造過的pCMV-N-Flag-GST載體及orf4目的片段,連接后轉化DH5α感受態,陽性克隆經測序完全正確后,提取質粒用于后續研究。
1.3 細胞培養及細胞轉染
長滿單層的293T細胞,使用0.05%胰酶消化1–2 min,待細胞間隙變大后,使用含2%血清的培養基終止消化,并按1∶2的比例傳代到指定的培養皿內,加入含10%胎牛血清的DMEM培養基,置于37 ℃、5% CO2培養箱中培養12–16 h,待細胞長滿70%–80%,即可用于轉染。轉染過程參見說明書。轉染后繼續培養24 h用于后續試驗。
1.4 總蛋白提取、SDS-PAGE和免疫印跡
收集并裂解細胞樣品。首先,棄掉培養基,加入預冷PBS潤洗3次,最后一次加入PBS后將細胞收集到1.5 mL EP管內,3 000 r/min離心5 min,棄上清,加入90 μL的細胞強裂解液 (主要成分為2% SDS、1% Triton X-100) (以六孔板為例),并將細胞沉淀吹懸后完全裂解,隨后按比例加入4×蛋白上樣緩沖液,混勻煮沸10 min,12 000 r/min離心10 min,取上清上樣。
按照《精編蛋白質科學實驗指南》[15]中的方法配制12%聚丙烯酰胺凝膠,將待檢樣上樣電泳,80 V、30 min將樣品壓成線后再以120 V恒壓電泳至條帶充分分離,結束電泳。通過半干轉印法將蛋白轉移到0.45 μm硝酸纖維素膜 (Nitrocellulose filter membrane,簡稱NC膜) 上,NC膜經5%脫脂乳封閉處理后進行抗體孵育,并顯色。其中孵育的一抗包括抗Flag鼠單抗 (1∶2 000),GST鼠單抗 (1∶4 000),ORF4鼠單抗 (1∶200),對應的二抗為HRP標記的羊抗鼠二抗 (1∶8 000)。
1.5 激光共聚焦顯微鏡試驗
細胞傳代后接種到共聚焦小皿內,待長滿40%–50%,將DsRed-mito分別與pCMV-N-Flag-GST和pCMV-N-Flag-GST-ORF4共轉染細胞。轉染24 h后,使用4%多聚甲醛,室溫固定細胞20 min,0.2% Trinton X-100透化細胞2 min,經5%脫脂奶封閉后,孵育一抗Flag鼠單抗,并用FITC標記的羊抗鼠二抗 (1∶200) 指示蛋白,DAPI (10 μg/mL) 室溫染核10 min指示細胞核,洗滌加入PBS,使用蔡司LSM780激光共聚焦顯微鏡觀察。
1.6 GST pull-down試驗
分別收集轉染pCMV-N-Flag-GST及pCMVN-Flag-GST-ORF4細胞樣品 (約1×107個細胞),加入1 mL NP40裂解液 (PMSF終濃度1 mmol/L),冰浴裂解細胞30 min,12 000 r/min離心10 min,取上清;隨后向上清中加入GST瓊脂糖珠50 μL,4 ℃混懸儀孵育4 h,1000 r/min離心5 min后棄上清,再加入1 mL的PBS洗滌4次,最后一次洗滌后,棄上清并加入45 μL PBS,同時加入15 μL的4×蛋白上樣緩沖液,煮沸5 min,12 000 r/min離心10 min,取上清,進行SDS-PAGE (12%凝膠) 分離蛋白。
1.7 銀染試驗
GST pull-down樣品經SDS-PAGE分離后,將聚丙烯酰胺凝膠轉入固定液 (V無水乙醇∶V冰乙酸∶V雙蒸水= 4∶1∶5) 中室溫固定30 min;雙蒸水清洗后轉入敏化液 (醋酸鈉68 g,硫代硫酸鈉3.14 g,無水乙醇0.3 L,加入雙蒸水定容至1 L) 孵育30 min,隨后雙蒸水漂洗3次;再將凝膠放入銀染液 (硝酸銀2.5 g,37%甲醛100 μL,雙蒸水配平至1 L)中避光孵育25 min,雙蒸水淋洗后加入顯色液 (無水碳酸鈉25 g,甲醛0.4 mL,硫代硫酸鈉0.0314 g,加入雙蒸水后定容至1 L) 孵育3–7 min,以終止液 (5%冰乙酸) 終止顯色,雙蒸水洗滌后使用ImageScanner Ⅲ 掃描儀掃描凝膠并保存圖片。選擇實驗組與對照組之間差異顯著的條帶進行質譜鑒定。
2 結果與分析
2.1 pCMV-N-Flag-GST質粒的構建
以pGEX-4T-1質粒為模板經PCR擴增gst基因片段,獲得約700 bp產物,與預期gst片段分子大小吻合 (圖1A)。將目的片段按同源重組的方法插入pCMV-N-Flag載體中,pCMV-N-Flag載體以及經改造后的 pCMV-N-Flag-GST的圖譜見圖1B。經過測序驗證,插入的gst序列位于pCMV-N-Flag載體中Hind Ⅲ 限制性內切酶位點下游且序列完全正確。
2.2 ORF4重組質粒構建及融合蛋白表達
以PCV2 HZ0201基因組為模板經PCR擴增獲得orf4片段,如圖2A所示。經雙酶切后插入到改造成功的pCMV-N-Flag-GST載體中。將構建成功的pCMV-N-Flag-GST及pCMV-N-Flag-GSTORF4瞬時轉染到293T細胞中,轉染24 h后收集細胞,制備蛋白樣品。12%聚丙烯酰胺凝膠電泳及Western blotting后,分別使用Flag鼠單抗、GST鼠單抗以及ORF4鼠單抗檢測融合蛋白的表達,結果如圖2所示,Flag-GST融合蛋白分子量約為30 kDa,與預計大小一致,能夠被Flag及GST標簽抗體識別,但無法與ORF4抗體反應;Flag-GST-ORF4蛋白分子量約為37 kDa,能同時與3種抗體反應。該結果表明上述構建的重組質粒轉染后可成功表達。

圖1 pCMV-N-Flag-GST載體構建Fig.1 The construction of pCMV-N-Flag-GST.(A) Amplification of gst gene by PCR.(B) The schematic showing that fragment coding GST was cloned into pCMV-N-Flag vector (a), resulting in pCMV-N-Flag-GST recombinant plasmid (b).
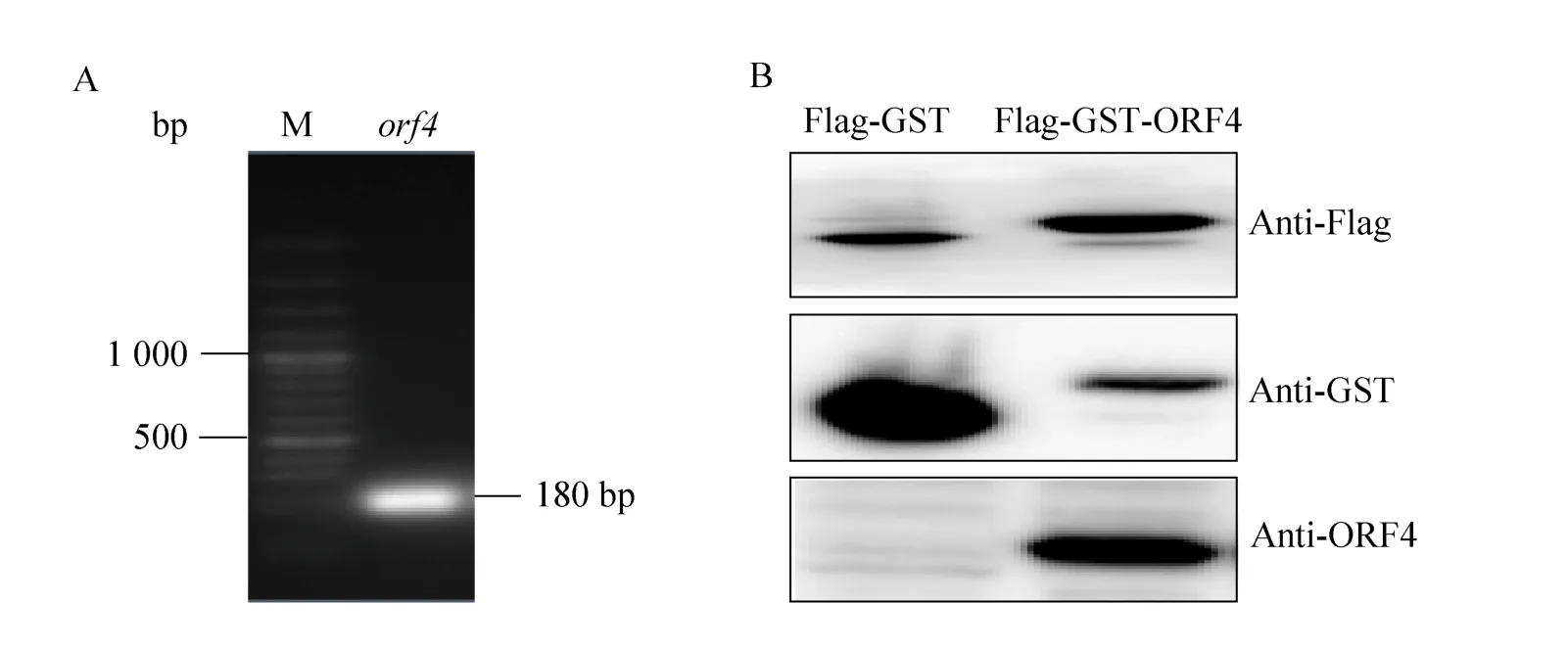
圖2 目的基因擴增及重組質粒表達Fig.2 Amplification of orf4 gene and analysis of the expression of the recombinant plasmids.(A) PCR amplification of orf4 gene.(B) Western blotting analysis of recombinant Flag-GST and Flag-GST-ORF4 proteins with various antibodies.
2.3 ORF4融合蛋白定位分析
ORF4蛋白分子量僅有6.5 kDa,與大標簽融合后有可能會影響蛋白定位。根據前期研究發現ORF4蛋白定位于線粒體,為了檢測GST標簽蛋白是否會影響ORF4的胞內定位,將pCMV-N-Flag-GST與pCMV-N-Flag-GST-ORF4分別與pDsRed2-Mito共轉293T細胞,轉染24 h后,進行間接免疫熒光試驗,通過激光共聚焦顯微鏡觀察熒光分布。結果如圖3所示,pDsRed2-Mito在細胞內呈紅色熒光并以點狀或桿狀分布于胞質內,指示線粒體;pCMV-N-Flag-GST轉染細胞后呈綠色熒光,在胞質中呈彌散分布;pCMV-N-Flag-GST-ORF4轉染后呈綠色點狀分布,與線粒體存在共定位。上述結果表明融合蛋白并沒有改變ORF4蛋白的定位,重組質粒可用于后續實驗。
2.4 GST pull-down及銀染結果
分別收集轉染的細胞樣品,一部分樣品裂解后直接進行SDS-PAGE和Western blotting實驗,檢測結果如圖4A顯示,實驗表明質粒轉染后可正常表達1、3、5泳道;一部分裂解樣品中加入GST瓊脂糖珠進行pull-down試驗,顯示融合GST標簽的蛋白能與GST瓊脂糖珠成功結合2、4、6泳道。所有蛋白經過12%聚丙烯酰胺凝膠電泳分離后進行銀染。如圖4B所示,與Flag-GST經GST pull-down捕獲的蛋白條帶相比,Flag-GST-ORF4兩個重復樣品中,在170 kDa以上,70–50 kDa、35–40 kDa處均有1條差異性條帶,在40–55 kDa處有2條差異性條帶,對差異性條帶進行割膠回收和質譜分析。
2.5 質譜分析結果
以得分高于40為篩選標準,如表1所示,共篩選到5個潛在與ORF4互作的蛋白,它們分別是絲氨酸/蘇氨酸蛋白磷酸酶6催化亞基、α心肌蛋白、肌動蛋白、SEC-14樣蛋白5和肌球蛋白myosin 9。其中分數相對較高蛋白有肌動蛋白和myosin 9,兩者均與細胞骨架調節相關,這預示著ORF4蛋白很可能與細胞骨架有關聯。這一發現為后續ORF4蛋白特性及功能的研究提供指向性及理論依據。
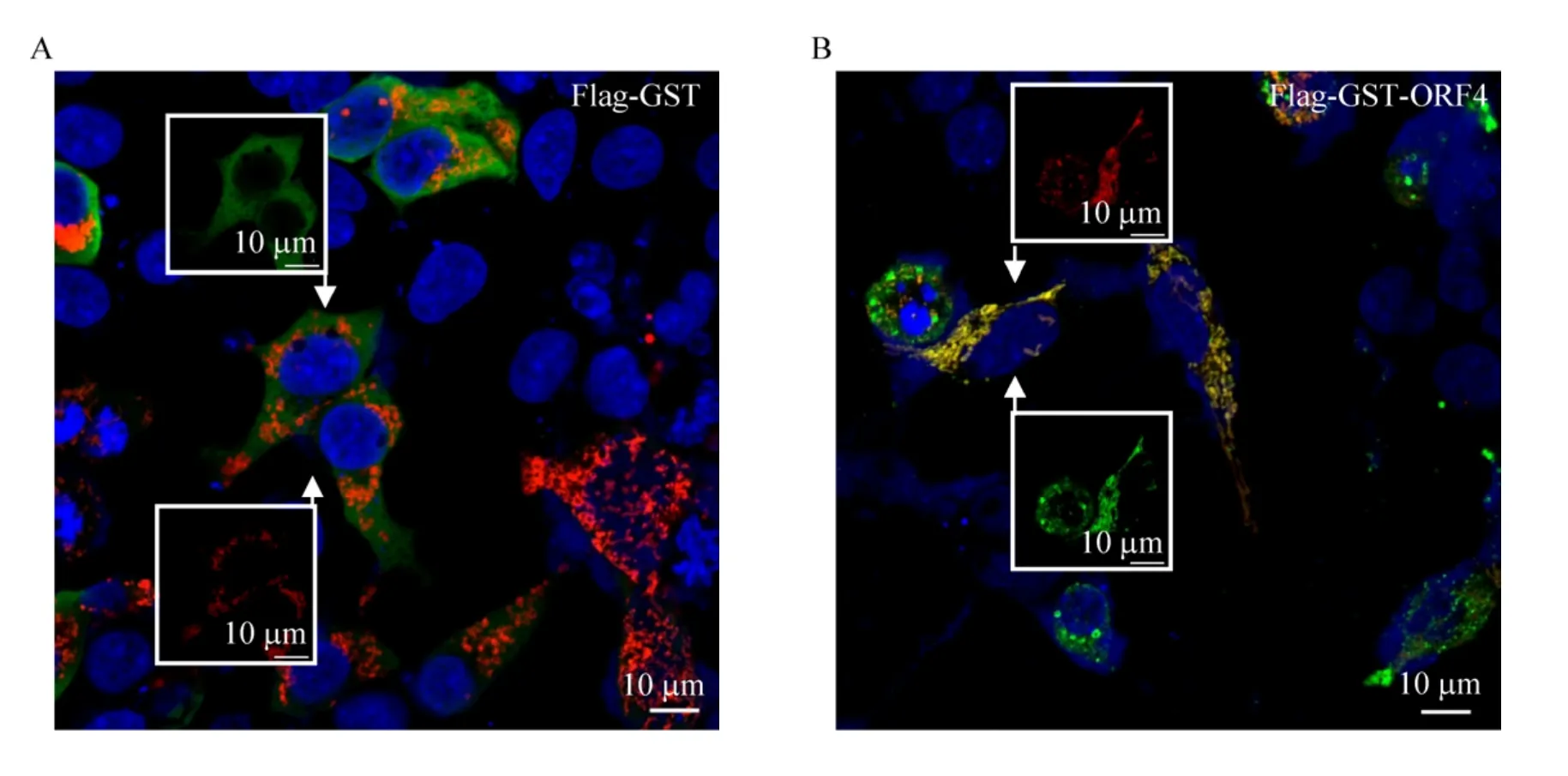
圖3 激光共聚焦顯微鏡分析Flag-GST (A) 與Flag-GST-ORF4 (B) 的亞細胞定位Fig.3 Subcellular localization of Flag-GST (A) and Flag-GST-ORF4 (B) were examined by laser scanning confocal microscope.Flag-GST or Flag-GST-ORF4, green; mitochondria, red; nucleus, blue.
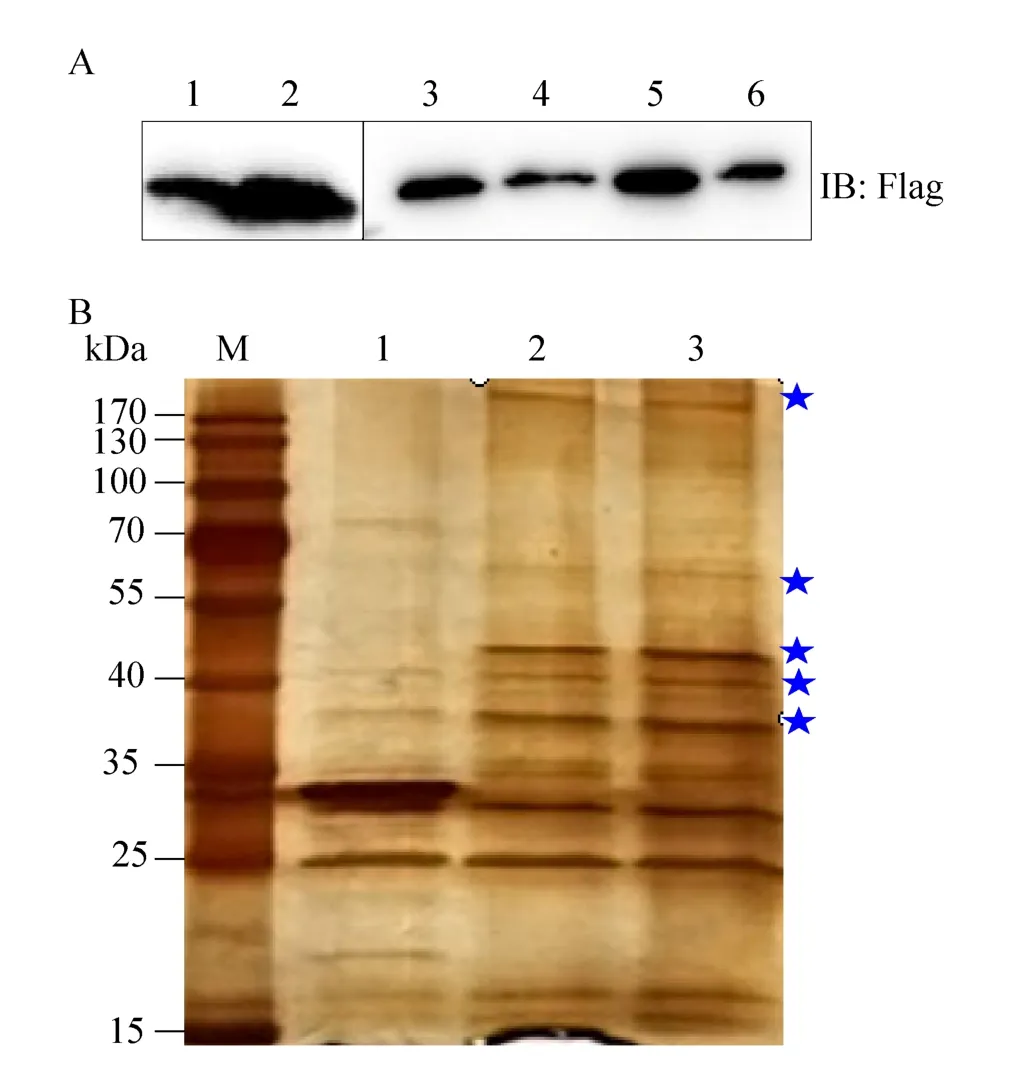
圖4 GST pull-down樣品免疫印跡及銀染結果Fig.4 Immunoblotting and silver staining results of GST pull-down samples.(A) Lane 1: lysate of Flag-GST;lane 2: the Flag-GST samples after GST pull-down; lane 3, 5: lysates of Flag-GST-ORF4 samples, they are two separate experiments; lane 4, 6 are the Flag-GST-ORF4 samples after GST pull-down, corresponding to 3 and 5 samples.(B) M: marker; lane 1: silver staining of Flag-GST pull down sample; lane 2, 3: silver staining of the two separate Flag-GST-ORF4 pull down assays samples. Differential bands.
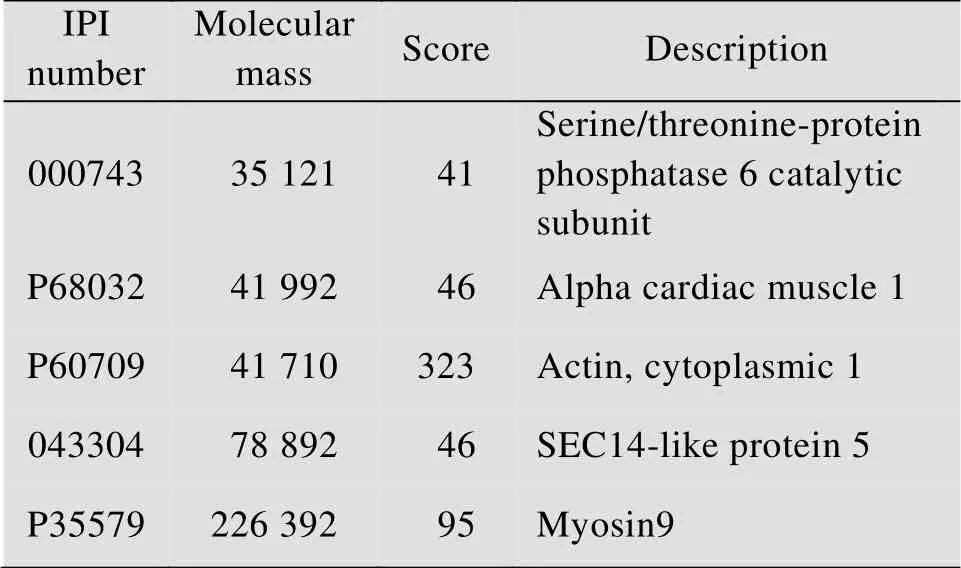
表1 GST pull-down結合質譜鑒定出潛在與ORF4互作的蛋白Table 1 Potential intercropping proteins with ORF4 indentified by GST pul-down combined with mass spectrometry
3 討論
豬圓環病毒ORF4蛋白是近幾年發現的蛋白,其相關功能的研究還處于初步探索階段。迄今為止,人們對ORF4蛋白在病毒感染中到底發揮何種作用知之甚少。病毒蛋白通常與宿主蛋白相互作用來發揮其生物學功能,因此,探尋宿主細胞內與ORF4的潛在互作蛋白可為后續ORF4功能的研究奠定基礎。研究利用了真核表達的Flag-GST-ORF4蛋白進行GST pull-down試驗來捕獲與ORF4蛋白互作的宿主蛋白。將gst融合到pCMV-N-Flag載體上,使用真核表達的GST融合蛋白進行試驗,而非使用原核表達的GST融合蛋白,更有效地篩選出哺乳動物細胞內可能與ORF4結合的蛋白;利用該篩選方法較傳統的原核GST pull-down可信度更高,已有文獻通過此種方法成功篩選到了與流感病毒PB1-F2互作的兩個蛋白[16]。
本研究利用上述的方法篩選到5種宿主蛋白,其中actin與myosin 9的分值明顯高于其余幾種蛋白,預示著它們與ORF4互作的可能性很大。Actin (肌動蛋白) 是一種重要的細胞骨架蛋白,幾乎所有的真核細胞內均含有肌動蛋白。該蛋白對真核細胞的存活至關重要,它為細胞形態維持提供了內部機械支撐,在細胞內部形成微絲,為細胞內物質的運輸提供重要通道,并且也是細胞運動的驅動源[17]。而myosin 9蛋白是肌球蛋白超家族中的一員,也是細胞骨架重要組成成分。該家族蛋白是與肌動蛋白actin結合的分子馬達蛋白,可調節actin的作用,與肌絲結合后被活化,活化后蛋白具有ATP酶活性,水解ATP后產生化學能,從而推動肌絲活動或產生張力[18]。此外,myosin 9還參與細胞內許多重要的生理過程,例如細胞骨架重組、肌動蛋白纖維運動、蛋白轉運等[19]。近年來很多研究報道細胞骨架,特別是肌動蛋白微絲對病毒運輸起著很重要作用。病毒侵入細胞后,為實現有效復制,首先需要將自身遺傳物質輸送到核內或特定的內膜系統膜上。在高度復雜的細胞內部,蛋白大分子若單純依靠擴散運輸效率極低。因此,大部分的病毒會利用細胞骨架或細胞內運輸通道來實現胞內運輸[20-21]。很多病毒通過這種方式進行胞內運輸,例如桿狀病毒利用肌動蛋白微絲實現病毒基因組由胞質到胞核的過程[22];本實驗室前期也證明了圓環病毒可通過病毒衣殼蛋白 (cap) 劫持宿主細胞原有的微管運輸系統進行核靶向運輸活動[23]。此外,本實驗室也分析了豬圓環感染后的宿主免疫組織基因表達譜,結果顯示解聚因子confilin1和肌動蛋白結合蛋白 (DSTN) 的非磷酸化活性形式發生了上調表達,這提示PCV2感染可能促進了肌動蛋白actin的解聚和重排,利于病毒入侵與運輸[24]。肌動蛋白參與不同細胞的運動過程是基于微絲的組裝及肌球蛋白myosin的活化[25],病毒可利用actin或actin結合蛋白來實現自身的運輸過程[26-27]。有文獻報道myosin IIA與HIV病毒gB蛋白結合后促進病毒入侵[28]。根據本文研究結果,我們推測ORF4蛋白與myosin結合,調節actin的作用從而間接影響病毒的運輸過程;而與actin結合很可能直接影響著細胞骨架的排列,進而調控病毒的運輸。這為后續研究ORF4蛋白是否影響細胞骨架以及病毒的入侵與運輸提供了有利的依據。另外,也有研究表明小GTP酶Ras蛋白通過 cAMP/PKA信號通路來調控線粒體功能,而actin參與調控小GTP酶Ras蛋白[29-30]。藥物處理使actin穩定性下降,可誘發細胞凋亡[31]。因此,actin與細胞凋亡息息相關,本實驗室已發表數據顯示ORF4定位線粒體并且與豬圓環病毒誘導線粒體凋亡相關[14]。然而,ORF4是否還能通過結合actin來間接發揮其誘導線粒體凋亡有待進一步研究。后續研究我們將深入闡明ORF4在病毒感染中發揮的作用,嘗試揭示影響病毒感染的潛在機制。

