賁門胃底癌中CIP2A mRNA 表達與HER-2 基因的擴增及其意義
張洪蘭 陳昊 張春芳 張昶 齊冬雪 李偉 劉新麗 劉華
連云港市第一人民醫院1病理科,2中心實驗室(江蘇連云港222002)
賁門胃底癌陽性體征出現較晚,不易完整手術切除,多年來預后一直不見明顯改善[1],該類胃癌發生率近年呈現不斷增高的趨勢。錯過最佳手術期,只能化療,而普通化療療效不明顯且副作用大,靶向化療是目前效果最明顯的治療方法。因此,進一步闡明賁門胃底癌的發生、發展和轉移的分子機制,尋找有效的靶標及相關的調節因子,對于提高該類胃癌的療效具有重要的臨床意義。
蛋白磷酸酶2A(PP2A)的癌性抑制因子(cancerous inhibitor of protein phosphatase2A,CIP2A)是一種近年來被發現的癌基因,可在后轉錄水平上調c-Myc 蛋白表達;癌基因HER-2(human epidermal growth factor receptor 2,HER-2)作為表皮生長因子受體家族成員之一,其介導的信號通路PI3K∕Akt∕mTOR 可增強c-Myc 的蛋白翻譯[2];而原癌基因c-Myc 是具有激活和抑制雙重作用的轉錄因子,在胃癌的發生及進展中起關鍵的調控作用[3]。從目前的研究現狀來看,國內外罕見賁門胃底癌福爾馬林固定石蠟包埋(formaldehyde fixed paraffinembedded,FFPE)組織CIP2A mRNA 水平的回顧性研究,其與HER-2 基因在c-Myc 蛋白共調控方面是否存在著協同作用,未見類似報道。本研究應用半定量RT-PCR 方法檢測CIP2A mRNA 表達,熒光原位雜交(FISH)方法檢測HER-2 基因擴增,探討二者及其與各臨床病理參數之間的關系,為賁門胃底癌的診斷、治療和預后提供一定的依據,同時了解CIP2A 的分子調控機制。
1 資料與方法
1.1 標本收集 收集2016年5月至2017年4月間連云港市第一人民醫院手術切除的47 例賁門胃底癌石蠟包埋組織,所有病例均為進展期癌,均為RT-PCR 實驗成功者(實驗均在組織包埋成蠟塊的1年內進行)。其中男27 例,女20 例:年齡22~73(中位年齡58)歲。進展期胃癌依據WHO 分類,分為管狀腺癌、乳頭狀腺癌、低分化腺癌(未分化癌)等;分級分3 級,包括高分化、中分化和低分化。本組病例包含管狀腺癌22 例,乳頭狀腺癌3 例,低分化腺癌22 例。賁門胃底癌的臨床分期依據2016年10月國際抗癌聯盟及美國聯合會(UICC∕AJCC)發布的第8 版胃癌TNM 分期法,TNMⅠ期5 例,Ⅱ期14 例,Ⅲ期17 例,Ⅳ期11 例。腫瘤分化程度:高分化7 例,中分化10 例,低分化30例。另選取對應癌旁組織47 例。
1.2 主要試劑及RT-PCR 引物 HER-2 基因擴增FISH 方法檢測試劑盒購自廣州安比平有限公司;環保脫蠟液購自無錫市江源實業技貿總公司;High Pure Paraffin RNA Isolation Kit 石蠟組織總RNA 提取試劑盒,購自美國Roche 公司;Prime-ScriptTMRT reagent Kit 反轉錄試劑盒和2×Taq PCR Mastermix 購自TaKaRa 公司;CIP2A 引物序列同文獻[4],并在NCBI 網站進行了BLAST 驗證,證實為CIP2A 特異的引物:P1:5′-TACGAATTCATGCGACGGCTGCTGATC-3′(forward);P2:5′-TACCTCGAGGGAGAAGGCGAACTGTCCGA-3′(reverse),擴增產物307 bp。以β-actin 基因表達產物為內參照設計PCR 引物,序列如下:P1:5′-ATCGTGCGTGACATAAGGAGAAG-3′(forward);P2:5-AGGAAGGAAGGCTGGAAGAGTG-3′(reverse),擴增產物197 bp,由上海生工公司合成。
1.3 方法
1.3.1 CIP2A mRNA 提取、擴增及定量 參照以往研究[5-6]FFPE組織中RNA 提取、擴增并加以改進的方法:(1)脫蠟及洗滌:取FFPE組織,切片,每片厚度5 μm,共10 片,放入1.5 mL 無菌EP 管,加入1 mL 環保脫蠟液57 ℃恒溫水浴常規脫蠟3 次,100%乙醇洗滌,離心,除上清,共3 次,室溫空氣干燥。(2)RNA 提取:按照FFPE組織總RNA 試劑盒說明操作提取總RNA,用50 μL 1‰DEPC 水溶解。(3)RNA 質量檢測:取1 μL 樣本用紫外分光光度計檢測吸光值(A值)及濃度(ng∕μL)(確保無DNA和蛋白污染,OD260∕OD280= 2.0±0.2,OD260∕OD230≥1.7)。(4)RT-PCR:采用反轉錄試劑盒,取1 μg 總RNA 為模板,在10 μL 擴增反應體系中以Oligo dT Primer 為引物,逆轉錄合成cDNA。取cDNA 2 μg 為模板,在25 μL 擴增反應體系中進行擴增,產物檢測采用瓊脂糖凝膠電泳法。(5)擴增產物半定量分析:應用GeneSnap 軟件系統分析擴增條帶。將CIP2A 基因與β-actin 基因擴增條帶吸光度的比值(CIP2A∕β-actin)計為CIP2A 基因的相對表達量。
1.3.2 HER-2 基因擴增檢測 依照試劑盒提供的標準操作方法,將標本置于全自動組織脫水程序18 h 后石蠟包埋,以4 μm 厚度切片,70 ℃烤片2 h 待用。預處理:新型環保透明脫蠟液脫蠟,水化;置于預熱至100 ℃的滅菌純化水20 min,室溫干燥;胃蛋白酶液消化。變性及雜交:吸取10 μL探針液至組織區域,85 ℃變性5 min 37 ℃雜交過夜(12 h)。次日,37 ℃洗液Ⅰ和Ⅱ洗滌,滴加DAPI,封片。避光孵化15~20 min 后,熒光顯微鏡下觀察結果。
1.4 統計學方法 采用SPSS 17.0 統計軟件進行統計學分析。計量資料以均數±標準差表示,組間比較采用t檢驗,雙變量相關性分析采用非連續變量Spearman 相關性分析。
2 結果
2.1 CIP2A mRNA 在賁門胃底癌及癌旁組織中的轉錄水平 分析47例賁門胃底癌及其癌旁FFPE組織中CIP2A mRNA 的轉錄水平,結果顯示,賁門胃底癌組織中CIP2A mRNA 的陽性檢出率為74.5%(35∕47),高于癌旁組織中的檢出率27.7%(13∕47,P=0.000,圖1)。根據GeneSnap軟件系統分析擴增條帶,計算CIP2A mRNA的相對轉錄水平。t檢驗結果顯示,35例賁門胃底癌組織中CIP2A基因的平均轉錄水平為0.49±0.09,13 例癌旁組織中平均轉錄水平為(0.09±0.02),差異有統計學意義(P<0.05)。
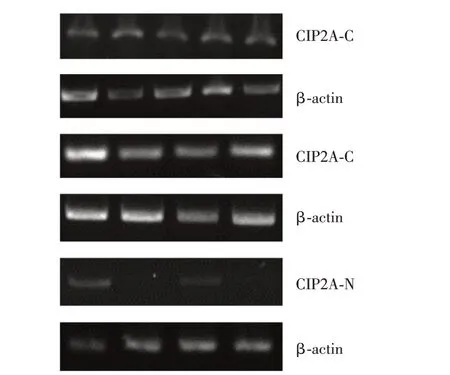
圖1 賁門胃底FFPE組織中CIP2A 基因RT-PCR 產物的電泳結果Fig.1 Electrophoresis results of CIP2A gene RT-PCR products in FFPE tissue of cardia-fundal carcinoma
2.2 賁門胃底癌組織中CIP2A mRNA 表達與臨床病理特征的關系 筆者采用楊雪等[4]研究中提到的統計學方法,將該組賁門胃底癌病例分為CIP2A mRNA 高轉錄水平組(≥0.49)22 例和低轉錄水平組(<0.49)25 例。結合臨床資料,分析CIP2A mRNA 的轉錄水平與賁門胃底癌臨床病理參數之間的相關性。結果顯示,CIP2A mRNA 的轉錄水平與腸型胃癌、較高的分化程度、腫瘤浸潤深度、TNM 分期、血管癌栓及神經侵犯相關,差異有統計學意義(P<0.05,表1)。
2.3 賁門胃底癌組織中HER-2 基因的擴增與臨床病理特征的關系 47 例賁門胃底癌患者中,HER-2 基因擴增者9 例,占19.1%(圖2)。結合臨床資料,分析HER-2 基因擴增與賁門胃底癌臨床病理參數之間的相關性。結果顯示,HER-2 基因的擴增與腸型胃癌、較高的分化程度及神經侵犯相關,差異有統計學意義(P<0.05,表1)。
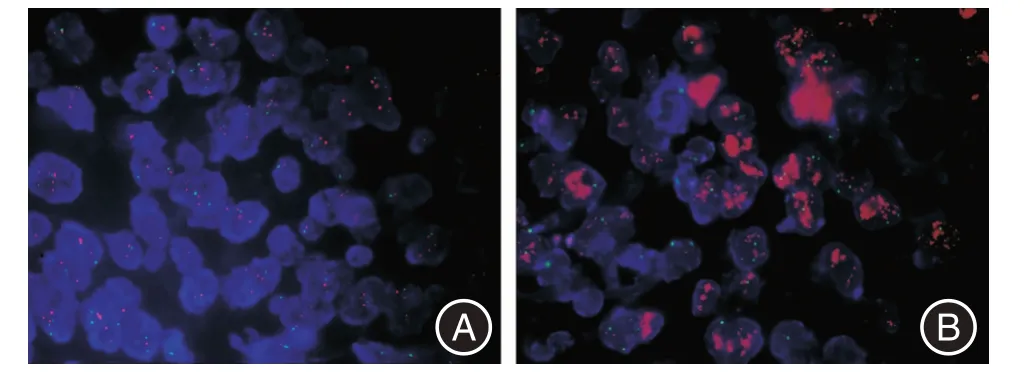
圖2 賁門胃底癌組織中HER-2 基因擴增Fig2 Amplification of HER-2 in cardia-fundal carcinoma
2.4 賁門胃底癌組織CIP2A mRNA 表達與HER-2 基因擴增的擴增的關系 CIP2A mRNA 與HER-2基因擴增表達呈正相關性(r= 0.410,P= 0.004)。其中CIP2A mRNA 高轉錄組,CIP2A 陽性表達率36.36%(8∕22);CIP2A mRNA 低轉錄組,CIP2A 陽性表達率為4.00%(1∕25,表2)。
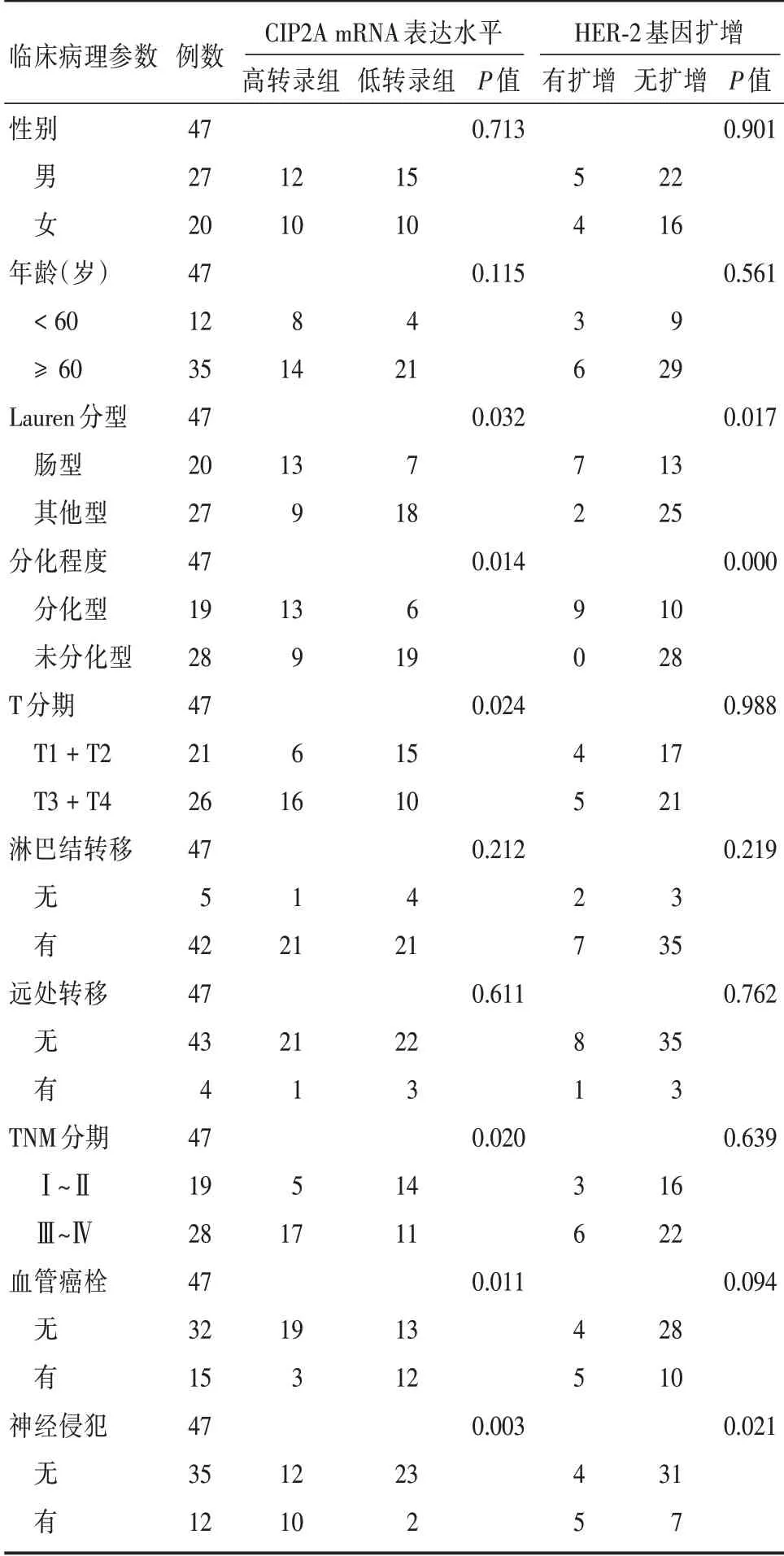
表1 賁門胃底癌組織中CIP2A mRNA 表達和HER-2 擴增與臨床病理特征的關系Tab.1 Expression of CIP2A mRNA and HER-2 amplification in cardia-fundal carcinoma and its relationship with clinicopathological characteristics
3 討論
胃癌是世界上常見的惡性腫瘤之一,病死率較高。手術切除是目前比較有效的治療方法,但賁門胃底部癌的生存率依舊很低,因為很多患者在確診時已失去手術機會。TNM 分期是判斷胃癌預后的重要指標,但很多分期相同的患者,預后也出現明顯差異[7]。因此,個體化分子靶向治療是晚期胃癌的重要治療手段,多基因檢測在未來的腫瘤治療中將成為主流。 CIP2A 是近年被發現的一種新的癌基因,體外實驗發現其在維持和促進細胞惡性轉化、增殖和體內腫瘤形成方面起關鍵作用[8-9]。因其能夠抑制蛋白磷酸酶2A(PP2A)的磷酸化活性而得名,它通過直接與癌轉錄因子c-Myc 結合,抑制PP2A 的B56α調節亞基對c-Myc 62 位絲氨酸的脫磷酸化作用,從而穩定c-Myc 蛋白的二元磷酸化結構,抑制其泛素化水解。同時,KHANNA 等[10]在胃癌AGS 細胞、腸型胃癌MKN-28和人纖維肉瘤HT1080 細胞中應用c-Myc RNA 干擾技術后發現CIP2A 蛋白和CIP2A mRNA 表達水平顯著降低,說明c-Myc 作為癌轉錄調節因子可以上調CIP2A 的表達,二者形成了一個正反饋環路。CIP2A 在人體腫瘤乳腺癌[11]、頭頸部鱗癌[12]、肝癌[4]、腦膠質瘤[13]、非小細胞肺癌[14]、胃癌[15]等組織中存在高表達,且與腫瘤的惡性臨床病理參數和不良預后相關。

表2 賁門胃底癌組織中CIP2A mRNA 表達水平及HER-2基因擴增的關系Tab.2 Relationship between CIP2A mRNA expression and HER-2 gene amplification in cardia-fundal carcinoma例
HER-2 受體是人表皮生長因子受體家族成員之一,定位于人類17q21,蛋白從結構上分為胞外區、跨膜區和胞內區,后者具有酪氨酸激酶活性,與表皮生長因子受體具有同源性。其參與了多種信號通路,主要包括Ras∕MAPK 途徑、P13K∕Akt 途徑、PLCr 途徑和STAT 途徑。HER-2 可通過多種途徑參與c-Myc 基因表達,其中P13K∕Akt∕mTOR 信號通路最為明確,它可作用于c-Myc mRNA 5′非翻譯區(5′UTR)的引導序列(PL2),PL2 含有內部核糖體進入位點(IRES),因而可增強c-Myc mRNA 的蛋白翻譯[2]。HER-2 基因擴增可致HER-2 蛋白高表達,導致細胞惡性轉化及腫瘤進展見于多數人類惡性腫瘤如乳腺癌、胃癌、卵巢癌、肺癌等[16]。
c-Myc 是轉錄因子家族成員之一,具有多個功能域,在轉錄過程中起到重要的調節作用。c-Myc蛋白的N-端含有轉錄活化功能域,C-端部位含有亮氨酸拉鎖結構和HLH 結構,必要時形成異質二聚體抑制轉錄。眾所周知,c-Myc 表達與細胞增殖狀態有關,增殖期c-Myc 高水平表達,休眠期c-Myc低水平表達,這也是惡性腫瘤作為高增殖體高度表達c-Myc 的重要原因。c-Myc 表達水平的調節是相當復雜的,mRNA 和蛋白具有較短的半衰期,受多點調節控制,包括起始、轉錄延長、翻譯和mRNA、蛋白質的加工。CIP2A 和HER-2 作為c-Myc 表達后轉錄水平調節的典范,二者在c-Myc 調節上是否存在一定的關聯。本研究結果顯示,賁門胃底癌組織中CIP2AmRNA 與HER-2 基因擴增表達呈正相關性(r=0.410,P=0.004),提示CIP2A和HER-2 在c-Myc 表達后轉錄水平調節上存在一定的協同作用,HER-2 可通過某種途徑上調CIP2A表達。
本研究結果顯示賁門胃底癌CIP2A mRNA 陽性檢出率為74.5%(35∕47),低于LI 等[8]研究中的CIP2A mRNA 陽性檢出率,可能與FFPE組織RNA降解增多和蛋白交聯提取率較低相關,但目前的RNA 提取試劑盒對于保存1年內的蠟塊還是有較強的臨床應用價值的。癌組織CIP2A mRNA 的相對轉錄水平為0.49,癌旁組織CIP2A mRNA 的相對轉錄水平為0.09,二者差異有統計學意義,說明CIP2A 作為一種癌基因存在于胃癌組織中;且CIP2A mRNA 過表達與腸型、分化型、較大的TNM分期、較深的浸潤深度、癌栓及神經侵犯相關,提示CIP2A 在某些特殊類型的胃癌中高表達,并與腫瘤的侵襲、轉移等較差的預后指標相關。與張洪蘭等[17]應用免疫組化方法檢測賁門胃底癌組織中CIP2A 蛋白表達的研究結論一致,該研究還證實CIP2A 表達與患者的總生存率相關且為獨立的預后危險因素,因此檢測CIP2A 基因的高表達更有助于賁門胃底癌惡性程度的判斷、評估預后和提供準確的治療靶點。另外,賁門胃底癌HER-2基因擴增者占19.1%(9∕35),HER-2 擴增與腸型胃癌、較高的分化程度及神經侵犯相關,與況麗萍等[18]應用免疫組化方法檢測胃癌中HER2 表達的結論一致,提示HER-2 基因擴增與患者較差的預后因素不完全相關,不能作為胃癌患者獨立的預后指標,或許HER-2 在對c-Myc 后轉錄水平和CIP2A 的調節在胃癌發生發展中發揮著更重要的作用。
值得注意的是,本研究發現CIP2A 和HER-2表達呈正相關,二者高表達與賁門胃底癌較高的分化程度和腸型胃癌相關,與LI 等[8]和HER-2 研究全國合作組[19]的研究結論一致,提示二者在腫瘤的去分化中部分丟失,且可能與腸型胃癌特定的細胞亞群相關。這是CIP2A 區別于其他癌基因的兩大特點,故筆者推測CIP2A 在賁門胃底癌的發生發展中扮演著一種有異于一般癌基因的角色,同時受到HER-2 基因的正調節,它必將成為一種特殊的腫瘤治療靶點,同時有研究證實CIP2A高表達還與胃癌患者順鉑耐藥相關[20]。

