胃腸術后短肽型腸內營養的應用價值和護理
葉瑛
胃腸手術患者在術后早期接受營養支持,可對其并發癥的發生進行控制,為其術后康復奠定基礎[1]。胃腸手術患者,其術后消化系統相關吸收能力會降低,且手術會對其造成較大的傷害,其消耗熱量增加,患者在手術后較長時間難以正常飲食,較易出現營養不良的情況,從而增加其出現相關并發癥的發生率[2-3]。為探究胃腸手術后早期對短肽型腸內營養以及相關護理的價值,本文以2016年1月—2018年1月的100例胃腸手術患者為研究對象,分別為其實施PN營養支持以及短肽型腸內營養支持,分析其營養支持的結果,總結短肽型腸內營養支持的應用價值,報道如下。
1 資料與方法
1.1 資料
以2016年1月—2018年1月胃腸手術患者100例為研究對象,隨機分組。實驗組中,50例患者年齡35~68歲,年齡均值為(60.21±6.50)歲,其中重癥胰腺炎12例,結腸癌10例,胃癌18例,食管癌10例,男性患者30例,女性患者20例。對照組中,50例患者年齡37~70歲,年齡均值為(60.35±7.20)歲,其中重癥胰腺炎11例,結腸癌13例,胃癌15例,食管癌11例,男性患者31例,女性患者19例。
兩組胃腸手術患者資料對比,差異無統計學意義(P>0.05),表明兩組之間的可比性較好,且本研究已被倫理委員會批準。
1.2 方法
對照組胃腸手術患者在術后早期接受PN營養支持,即手術后3 d,給予患者全合一營養液進行PN支持,其每天的熱量為25~ 30 kcal/kg。
實驗組胃腸手術患者在術后早期則接受短肽型腸內營養支持,即手術后第3 d,給予患者短肽制劑伊肽素干預,初始熱量每天為700 kcal,若患者在1~2 d內未出現腹瀉等情況,則可逐漸增加熱量為每天25~30 kcal/kg。在營養支持的過程中,加強營養管的護理,以保證腸內營養的實施。在營養支持前,應通過適宜溫度的開水沖洗營養管,避免營養管出現堵塞的情況。加強營養管的關注,避免其出現營養管脫落或移位。同時合理對短肽型腸內營養劑的溫度進行控制,保持循序漸進的原則實施腸內營養干預。在腸內營養支持結束后,加強患者口腔及鼻腔的清理,確保其處于潔凈的狀態。定時對營養管清洗,防止其出現污染,以此對感染的發生進行控制。
1.3 觀察指標
對兩組營養支持2周后的營養狀況、免疫功能以及感染發生情況作觀察分析。
營養指標:主要包括實際體重/理想體重(WT/IBW)、三頭肌皮皺厚度(TSF)、上臂中部肌肉周長(MANC)、血清清蛋白(ALB)、轉鐵蛋白(TRF)、前清蛋白(PA)。
免疫功能指標:主要包括補體C3、IgA、IgM、IgG。
1.4 數據處理
數據通過SPSS 21.0軟件作統計學處理,其中感染發生率等計數資料通過卡方檢驗,采用[n(%)]表示,而免疫指標(補體C3、IgA、IgM、IgG)水平、營養指標(WT/IBW、TSF、MANC、ALB、TRF、PA)水平等計量資料以 t檢驗,采用(±s)表示。若P<0.05,則為差異有統計學意義。
表1 營養狀況 (±s)
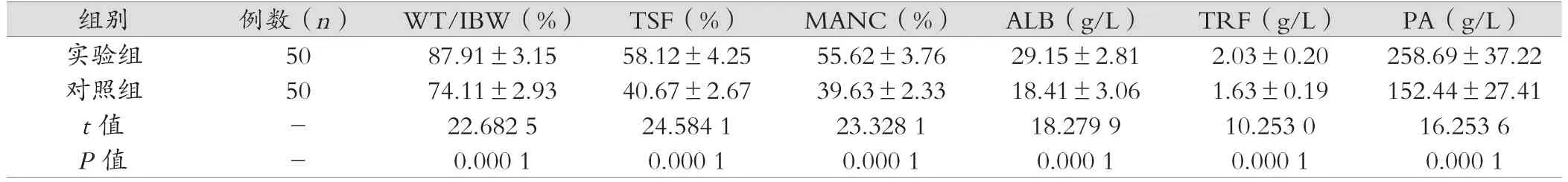
表1 營養狀況 (±s)
實驗組 50 87.91±3.15 58.12±4.25 55.62±3.76 29.15±2.81 2.03±0.20 258.69±37.22對照組 50 74.11±2.93 40.67±2.67 39.63±2.33 18.41±3.06 1.63±0.19 152.44±27.41 t 值 - 22.682 5 24.584 1 23.328 1 18.279 9 10.253 0 16.253 6 P值 - 0.000 1 0.000 1 0.000 1 0.000 1 0.000 1 0.000 1
表2 免疫功能指標水平(±s)
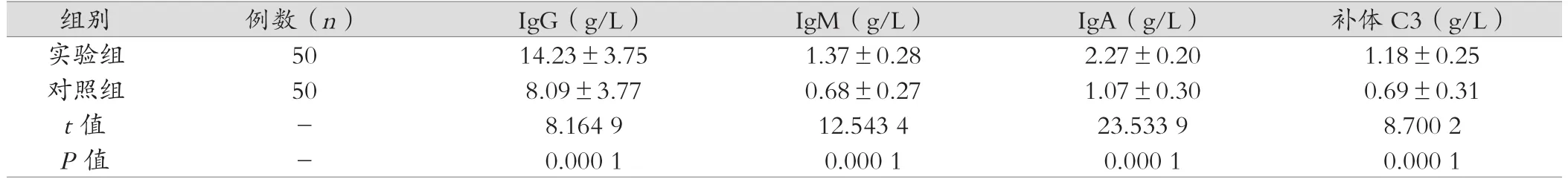
表2 免疫功能指標水平(±s)
實驗組 50 14.23±3.75 1.37±0.28 2.27±0.20 1.18±0.25對照組 50 8.09±3.77 0.68±0.27 1.07±0.30 0.69±0.31 t值 - 8.164 9 12.543 4 23.533 9 8.700 2 P值 - 0.000 1 0.000 1 0.000 1 0.000 1
2 結果
2.1 營養狀況
實驗組干預后的營養狀況優于對照組(P<0.05)。如表1。
2.2 免疫功能指標水平
實驗組胃腸手術患者干預后的免疫功能指標水平均優于對照組,差異具有統計學意義(P<0.05)。具體如表2。
2.3 感染發生情況
實驗組胃腸手術患者中,6例患者出現了感染的情況,其感染發生率為12.00%;對照組胃腸手術患者中,16例出現了感染情況,其感染發生率為32.00%。實驗組感染的發生率較對照組低(χ2=5.827 5,P=0.016)。
3 討論
伊肽素是短肽型腸內營養劑的一種,其氮源是由蛋白質、多肽、三肽、二肽、氨基酸組成(由深海魚蛋白肽水解物、乳清蛋白、氨基酸互補構成)。必需氨基酸模式參照ARE標準:生物利用度高,易于機體吸收,在迅速糾正負氮平衡的同時緩解機體氮的丟失。其與其他營養劑相比,具有操作簡單、均衡、營養完善等優點[4-5],其以短肽作為氮源,不需要消化分解即能夠被患者的腸上皮細胞所吸收[6],即使患者的胃腸功能處于受損狀態,也可通過小腸進行吸收,且其滲透壓較低,患者的耐受性較好,可對患者的蛋白質代謝改善,將其蛋白儲備增加,從而改善其營養狀態[7-8]。伊肽素的低脂配方能有效減輕脂肪瀉,其還含有高量的膠原蛋白肽,有利于傷口的愈合。
本研究顯示,接受短肽型腸內營養干預的實驗組胃腸手術患者,其干預后的營養狀況優于PN營養支持的對照組;且實驗組胃腸手術患者干預后的免疫功能指標水平均優于對照組,實驗組感染的發生率較對照組低。表明短肽型腸內營養干預的應用,不僅可改善患者的營養狀態,且可提高患者的免疫功能,更好對感染的發生進行控制。
腸內營養是營養支持方法的一種,其可以對患者的相關營養狀況改善,使得患者疾病更好的康復[9-10]。早期為胃腸手術患者實施腸內營養,能夠對其腸黏膜屏障功能和腸黏膜結構的完整性維持,對腸蠕動、黏膜生長等促進,以此提高患者的腸道功能以及免疫力[11]。為患者實施腸內營養支持過程中,配合有效的護理干預,則可提高營養支持的效果[12]。
綜上所述,短肽型腸內營養應用于胃腸手術患者術后早期,有著較高價值,可改善患者的營養狀況,提高其免疫功能,同時配合有效的護理干預,則可對腸內營養支持的順利實施進行保證,減少感染等的發生率,對胃腸手術患者預后的改善,有積極的意義。

