多層組學在植物逆境及育種中的研究進展
熊強強,魏雪嬌,施 翔,方加海,陳小榮,賀浩華
(江西農業大學農學院/作物生理生態與遺傳育種教育部重點實驗室/江西省超級稻工程技術研究中心/雙季稻現代化生產協同中心,江西南昌330045)
植物在生長發育過程中會受到各種不利的生物和非生物因素的影響,已經成為制約植物生長發育、影響植物產量和質量的關鍵因素,如病蟲侵害、水分脅迫、溫度(高、低溫)脅迫和鹽脅迫等。植物感受到這些逆境信號通過信號轉導過程調節細胞內相關抗逆基因、蛋白的表達[1-3],調整自身的狀態來適應不利環境,最終以代謝產物形式響應環境變化和遺傳修飾,生物體的表型是代謝物水平最終的表現[4-5]。當前,單純研究某一層次生物分子(基因組、轉錄組、蛋白組或代謝組等)的變化,如通過Gene ontology(GO)分析基因、蛋白功能及相互作用網絡,或通過Metabo-Analyst分析小分子代謝產物的相互關系并找尋生物標志物等,已經很難滿足系統生物學越來越高的研究期望。因此,綜合多組學數據對生物過程從基因、轉錄、蛋白和代謝水平全面的深入的闡釋已成為研究的熱點,從而更好的對生物系統進行全面了解[6-8]。
組學(omics)技術是隨著系統生物學的發展而迅速發展起來的,它的運用為系統生物學提供了大量的實驗數據和先進的技術方法,并且對系統生物學的發展提供了較為新穎的研究思路,大大加速了系統生物學的發展腳步。系統生物學(systems biology)是研究一個生物系統中所有組成成分的構成,以及在特定條件下這些組分間的相互關系的學科,整合分析生物系統在生物或非生物等相關因素的干擾下一定時間內的動力學過程及其規律[9-11]。多層組學是一個由左至右、由上而下的系統整合過程,即在深入研究基因、RNA、蛋白質和代謝產物上的一種系統分析和分子調控網絡的整合(圖1),同時結合GO功能分析、代謝通路富集、分子互作等生物功能分析,系統全面地解析生物分子功能和調控機制。不同分子層次的組學數據進行整合分析一方面可以相互驗證,另一方面也有助于相互補充、拓展認識。
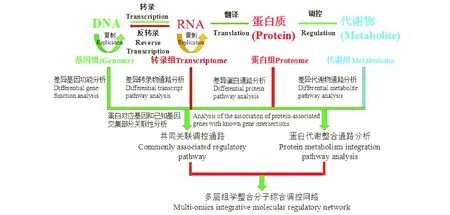
圖1 多層組學分子調控網絡Fig.1 Multi-omics molecular regulatory network
近年來,以基因組學、轉錄組學、蛋白質組學和代謝組學為代表的組學分析方法正逐步在植物逆境脅迫及新品種培育上應用,國內外研究人員均取得了許多突破性的研究成果。本文較為詳細地介紹了基因組學、轉錄組學、蛋白質組學和和代謝組學聯合分析在植物響應逆境脅迫、基因功能研究及輔助育種中的最新應用和研究成果,并總結和評述了多層組學整合分析的未來發展趨勢。
1 多層組學簡介
多層組學主要包括基因組學、轉錄組學、蛋白質組學和代謝組學。通過對基因組、轉錄組、蛋白組和代謝組數據進行整合分析,可獲得相關變化信息,富集和追索到變化最大、最集中的通路,然后對基因到RNA、蛋白質,再到代謝小分子,進而對整體變化物質分子進行綜合分析,包括原始通路的分析及新通路的構建,反映出組織器官功能和代謝狀態,從而對生物系統進行全面的解讀。多層組學主要的分析內容和方法主要包括差異基因功能分析、差異mRNA生物信息分析(GO,pathway)、差異蛋白生物信息分析(GO,pathway,PPI)和差異代謝物生物信息分析(pathway)。進一步分析通常包括兩個方面的內容,一是對共同關聯的pathway進行整合分析。另一方面,是對將差異代謝物,代謝物直接相關的調控酶、基因和差異蛋白及相關代謝通路通過omicsbean或者cytoscape軟件,構建基因、蛋白質、代謝物、及相關代謝通路的互作網路圖。
基因組學(Genomics)是研究生物基因組和如何利用基因的一門學問。用于概括涉及基因作圖、測序和整個基因組功能分析的遺傳學分支。基因組(genome)是指細胞或生物體的一套完整的單倍體遺傳物質,是所有不同染色體上全部基因和基因間的DNA的總和[12-13]。
轉錄組學(transcriptomics)是指某一特定生理條件下從RNA水平研究基因表達的情況,即生物樣本內全部轉錄本的RNA序列的測序,是研究細胞表型和基因功能的一個重要手段[14-15]。
蛋白質組學(proteomics)是以蛋白質組為研究對象,利用各種技術手段來研究蛋白質組的一門新學科,研究細胞、組織或生物體蛋白質組成及其變化規律的科學[16-17]。蛋白質組(proteome)是由一個細胞、一個組織或一種生物的基因組所表達的全部相應的蛋白質[18]。
代謝組學(metabolomics)的概念來源于代謝組,代謝組是指某一生物或細胞在一特定生理時期內所有的低分子量代謝產物,代謝組學則是對某一生物或細胞在一特定生理時期內所有低分子量代謝產物同時進行定性和定量分析的一門新學科[19-20]。
2 多層組學在植物響應逆境脅迫中的應用
隨著擬南芥[21]、水稻[22]、大麥[23]、小麥[24]全基因組序列的完成,加速了多層組學在植物上的研究,利用系統生物學方法深入研究其響應環境變化、病蟲侵害及其生長發育的機制,以適應在逆境環境中的生存具有重大意義。本文就近年來多層組學在植物研究中的應用進行分類綜述(表1)。
2.1 響應非生物脅迫
自然界普遍存在非生物脅迫因素,它們可以使植物產量和品質下降。植物在感受到脅迫信號后從基因、mRNA、蛋白質水平,最終到代謝物的差異積累來響應脅迫,對來自不同層次的組學實驗結果,包括基因組、轉錄組、蛋白組、代謝組以及各層次的修飾組學研究數據等,進行整體變化物質分子綜合分析,通過多層組學根據網絡協同調控邏輯對植物遭遇干旱[25-26]、鹽[27-28]、溫度[29-30]和重金屬[31]有助于闡明水稻響應脅迫的分子機理。
Shu等[25]對干旱條件下水稻葉片轉錄組、蛋白質組及代謝組進行聯合分析,研究認為干旱期間儲存物質的能耗增加,從碳水化合物和脂肪酸到氨基酸方向的能量和物質的轉移和利用增加。Chmielewska等[26]分析兩種基因型(敏感型、耐旱型)大麥葉片和根蛋白質組和代謝組的數據,揭示了器官(根、葉片)的特異性變化,同時發現干旱敏感和耐受大麥品系響應水分虧缺的差異性。在水稻響應鹽脅迫研究中,Wang等[27]以水稻鹽敏感株系IR64和耐鹽PL177為材料,在外源脫落酸情況下,結合幼苗期芽和根轉錄組和代謝組數據分析,在兩種水稻基因型中,鹽脅迫條件下,許多初級代謝產物發生變化和器官特異性的發生,外源ABA通過選擇性的降低Na+在根部的積累,增加K+在芽的積累來提升水稻對鹽脅迫的耐性,結合轉錄組和代謝組數據篩選出幾個耐鹽候選基因,為提高水稻的耐鹽性提供理論參考依據。Ye等[28]以狗牙根(Bermudagrass)為材料,研究干旱和鹽脅迫的生理,并結合蛋白質組學和代謝組學的比較分析。生理上分析,干旱和鹽脅迫下滲透調節物質積累,活性氧簇(ROS)水平和抗氧化酶活性發生了較大的變化;組學結果分析,鑒定了77個涉及光合作用,氧化戊糖磷酸,糖酵解和氧化還原代謝途徑的蛋白質,其中,36個蛋白質受到兩種處理的共同調控,而另外40個蛋白質和13個蛋白質分別被干旱和鹽調控。氨基酸,有機酸,糖和糖醇等37種代謝物的含量受干旱和鹽處理的調控,其中18個調控代謝物涉及碳和氨基酸代謝途徑,此研究為了解狗牙根對非生物脅迫響應的潛在分子機制和代謝穩態提供新的見解。Zhang等[29]以9311和日本晴為材料,結合代謝組和轉錄組數據行分析,結果發現處理期間代謝差異集中于抗氧化作用,而恢復期間抗寒相關代謝物的誘導在耐寒品種日本晴中更為活躍,衰老相關化合物僅在冷敏感品種9311中積累,揭示了水稻響應低溫脅迫和恢復過程的代謝動態模式及活性氧主導的水稻適應低溫環境機制。Wienkoop等[30]對擬南芥在高溫脅迫下淀粉和棉子糖類物質的代謝變化進行的研究,闡述了高溫下擬南芥的代謝途徑以及相關酶類的活性變化。同時也表明代謝組學與其他組學相結合,能更全面地對生物現象進行闡述,例如,呼吸作用、光合作用和蛋白質合成等過程的代謝網絡的變化,蛋白質組學和代謝組學相結合可以更深入分析蛋白質及代謝物的變化趨勢,進而研究溫度脅迫機制。在對萊茵衣藻鎘濃度脅迫中,Jamers等[31]結合轉錄組和代謝組研究0,8.1,114.8 μmol/L鎘對萊茵衣藻生長速率的影響,鎘脅迫48 h和72 h后檢測轉錄和代謝物譜發現,114.8 μmol/L鎘脅迫下,對萊茵衣藻生長影響顯著。轉錄組中,參與氧化應激防御機制的基因顯著增加。代謝組中,涉及谷胱甘肽合成途徑的代謝物(一種重要的抗氧化劑防御)也受到影響,鎘在轉錄水平比代謝水平影響更顯著,同時說明前者對鎘脅迫具有更高的敏感性。
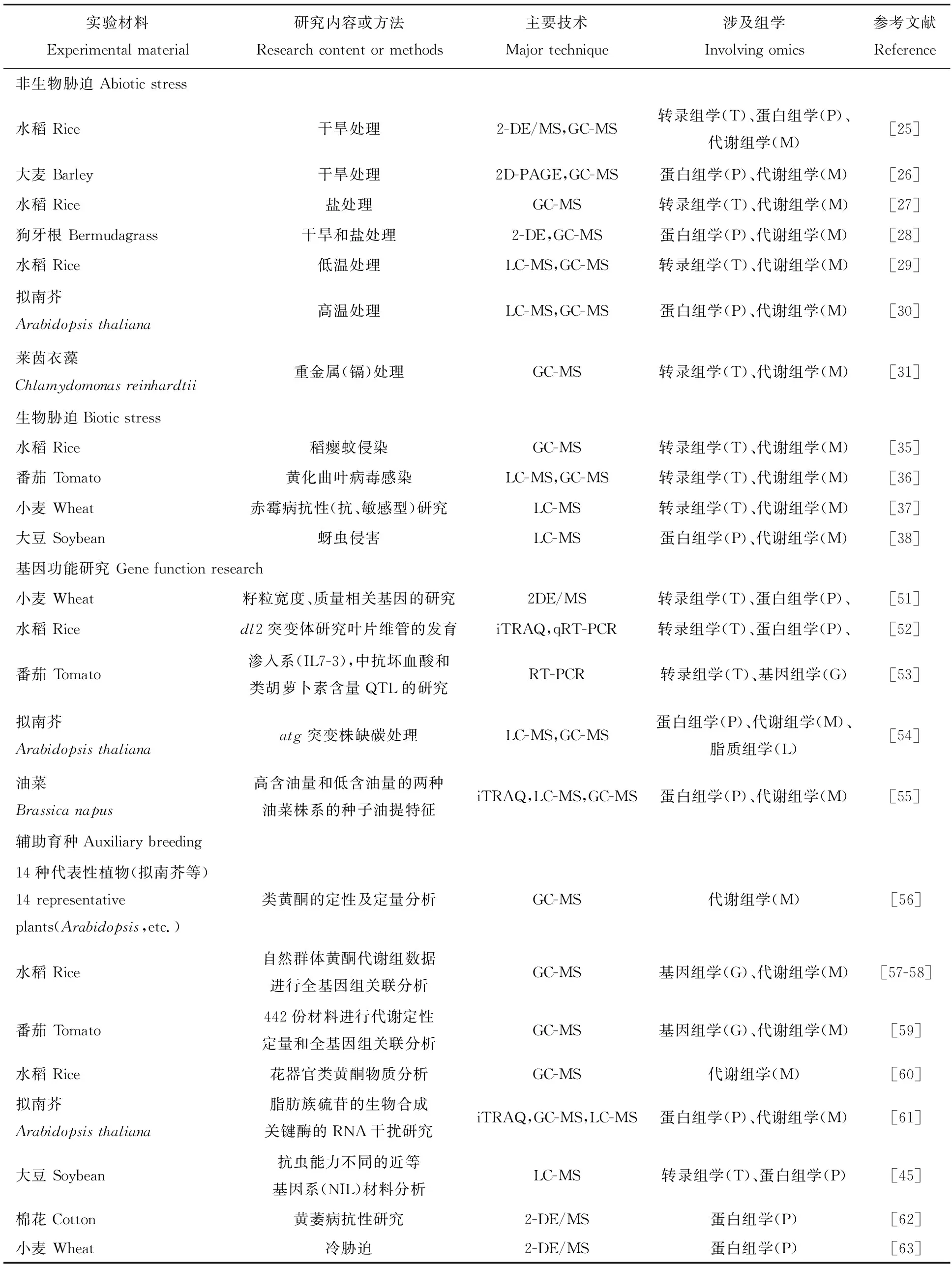
表1 多層組學在植物研究中的應用
T:轉錄組學;P:蛋白組學;M:代謝組學;L:脂質組學
T:transcriptomics;P:proteomics;M:metabolomics;L:lipomics
2.2 響應生物脅迫
由單基因遺傳而使植物產生抗性,部分已經成功克隆并轉移到植物中以提高抗性[32]。多基因遺傳較為復雜,尚未得到很好的開發用于植物改良[33],如水稻(Oryzasativa)稻瘟病[34],小麥(Triticumaestivum)[35]和大麥(Hordeumvulgare)[36]鐮刀菌枯萎病、小麥白粉病[37],馬鈴薯晚疫病(Solanumtuberosum)[38]和番茄(SolanumlycopersicumL.)中的細菌斑點[39],植物響應生物脅迫主要通過產生一系列生物化學物質抵抗病原體攻擊,利用基因組學、轉錄組學、代謝組學和蛋白質組學用來提取系統信息,結合生物信息學分析揭示宿主-病原體相互作用的靶向植物抵抗生物脅迫的幾種機制[40-41],多層組學聯合分析方法提供了可以與由單基因或多基因控制的生物脅迫抗性相關的一系列生物化學物質的檢測。
在稻癭蚊侵染水稻組織的研究中,Agarrwal等[42]運用轉錄組和代謝組綜合分析水稻和昆蟲互作反應,鑒定出7 000多個差異表達基因和80個差異性代謝物,基因芯片分析碳(C)和氮(N)代謝的失調引起C/N轉變,四吡咯的合成上調和葉綠素合成及光合作用的下調,綜合結果顯示,參與脂質過氧化(LPO)的基因表達上調,并且一個LPO標記代謝物(壬二酸)在過敏反應中出現積累,這一積累正好和昆蟲取食點中更多GABA(神經遞質和昆蟲拒食劑)積累吻合。研究揭示了宿主中無毒癭蚊(GMB1)侵擾后的轉錄組和代謝組的廣泛重編程,這些重編程會產生有活性氧(比如單線態氧)的產生和釋放誘導的過敏反應,并導致脂質過氧化介導的細胞死亡。因此,水稻施用過敏反應作為一種手段來限制昆蟲幼蟲的營養供應,同時積累GABA,這些都可能導致幼蟲死亡。為了更好的了解番茄對黃化曲葉病毒的抗性,以抗性和易感番茄為材料,Sade等[43]運用轉錄組和代謝組相結合的方法,分析黃化曲葉病毒感染和對照1,3,7,14 d后在抗性和易感植物葉片中的代謝物的變化,揭示了抗性和易感植物之間特定代謝物水平的顯著差異性,氨基酸、多胺、酚類和吲哚類代謝物的豐度發生了實質性改變,這些代謝物均導致防御化合物的合成。整合代謝組和轉錄組數據突出了抗性和易感植物響應黃化曲葉病毒(包括苯丙素、色氨酸、煙酸鹽、尿素和多胺途徑)的不同調控途徑。研究表明感染后,水楊酸生物合成途徑是抗性植物中重要的防御介質。在小麥赤霉病抗性研究中,Dhokane等[44]通過代謝組學和轉錄組學研究了攜帶抵抗型(R-RIL)和敏感型(S-RIL)等位基因(QTL-Fhb2)的重組自交系以發現候選基因。通過R-RIL和S-RIL代謝組分析,檢測出豐度較高的代謝產物有苯丙素、木質素、甘油、脂肪酸、黃酮類、萜類化合物。通過轉錄組分析,找到了幾種受體激酶、調節轉錄因子、信號轉導、霉菌毒素的解毒和抗病相關基因。通過側翼標記序列分析QTL-Fhb2,結合代謝組和轉錄組數據,鑒定出確定了4-香豆酸、輔酶A生成酶、胼胝質合成酶、堿性螺旋-環-螺旋轉錄因子、谷胱甘肽硫轉移酶、ABC轉運蛋白-4和肉桂醇脫氫酶為QTL-Fhb2區域內抗性基因。從而得出結論,QTL區域上的一些基因是通過加固細胞壁結構以減少病原體在穗軸的傳播,其他一些基因通過降低脫氧雪腐鐮刀菌烯醇(赤霉病毒素)的毒性以提高抗性,從而降低疾病的嚴重程度。在大豆抗蚜蟲侵害能力研究中,Brechenmacher等[45]在蚜蟲危害后48 h內,通過轉錄組和蛋白組學技術對Rag2位點不同的近等基因系(NILs)進行分析。比較Rag2和rag2株系共鑒定出3 445個蛋白,396個差異蛋白參與細胞壁代謝、糖代謝和應激反應。轉錄組分析發現抗性和敏感品系中有2 361個基因有明顯的差異調節,Rag2株系中上調表達的蛋白參與細胞壁構建、次生代謝、激素代謝等脅迫條件下的信號傳遞和轉錄反應等生物學過程。Rag2株系下調表達的蛋白參與光合作用和碳代謝。研究發現,位于Rag2位點上的兩個基因(一個功能未知、一個是線粒體蛋白酶)在抗性基因型材料上顯著提高,一個位于Rag2位點內的假定NBS-LRR抗性基因在兩個株系間沒有差異表達,但是另一個位于Rag2位點邊緣的NBS-LRR基因卻出現差異,筆者推斷該基因可能是一個控制蚜蟲抗性的候選基因。宿主-病原體相互作用研究中利用代謝組學來了解植物的生物學功能[46],植物育種[47]以及研究宿主與病原體的相互作用[48]已有較多報道。同時,蛋白質組學已被廣泛用于研究宿主-病原體相互作用[49-50]。筆者著重于結合不同組學技術,解譯生物脅迫對植物響應機制,并鑒定出可用于育種的候選基因。
2.3 基因功能研究
基因、RNA和蛋白的差異變化可能在觀察生物體表型上沒有明顯的改變,但一般會引起下游代謝物的顯著變化[4]。因此,可通過分析基因、RNA和蛋白變化前后的代謝物差異來研究基因功能,明確相關基因在轉錄和翻譯過程中的不同調控作用,從而了解基因和蛋白調節下游代謝產物。
小麥TaGW2-6A的編碼區等位基因變異與籽粒的寬度和重量密切相關,但遺傳機制尚不清楚。因此,為了獲得小麥籽粒發育過程中由TaGW2-6A調控的關鍵功能,Du等[51]對TaGW2-6A等位基因變異材料進行轉錄組和蛋白組分析。轉錄組結果顯示TaGW2-6A的等位變異在幾個數量級上顯著不同,每個TaGW2-6A等位變異在開花后6 d(DAA)到達第一個轉錄高峰期,但是插入TaGW2-6A等位變異到達第二個峰值時比正常類型早,即12DAA而不是20DAA。有關水稻葉片維管的脈絡發育調節中,Peng等[52]利用水稻突變體(dl2)探討葉維管形成和分化過程中的蛋白組和轉錄組變化。研究發現有3 172個蛋白質和能匹配到基因的9865230個標簽,141個蛋白質和98個mRNA在dl2突變體和野生型之間差異表達,差異表達mRNA和差異表達的蛋白相關分析顯示在mRNA和蛋白質之間表達相關性不高,說明轉錄和翻譯過程中有不同的調控作用。通過分析了差異表達蛋白所參與的過程和代謝途徑,發現一些關鍵蛋白的上調或下調證實維管束分化是一個活躍的過程。研究結果表明,葉維管系統的發育和生理過程是一個全面調控、復雜的過程。在利用基因組學資源鑒定番茄果實調控抗氧化物含量的候選基因研究中,Calafiore等[53]通過建立潘那利野生番茄滲入系(IL7-3),導入能增加抗壞血酸和類胡蘿卜素含量的QTL,分別在果實發育的3個階段測量了IL7-3中抗壞血酸和類胡蘿卜素的含量,查找了番茄基因參考序列和最近發布的潘那利野生番茄基因參考序列,通過分析CAPS標記,鑒定出了控制抗壞血酸積累的6個候選基因和一個控制類胡蘿卜素的候選基因,并進行了qRT-PCR驗證。最后,通過28個物種特異性的標記對7個亞漸滲系進行了基因分型,采用代謝物含量進行評估,分析證明9-順式-環氧類胡蘿卜素加雙氧酶和一種L-抗壞血酸氧化酶同系物的基因的表達量顯著提高,這些基因與抗壞血酸和類胡蘿卜素的積累相關,結果表明,結合番茄遺傳、基因組資源和生物信息學工具解析控制抗壞血酸和類胡蘿卜素積累QTL的這種方法是可行的。在對擬南芥自噬相關基因(ATG)研究中,Avin-Wittenberg等[54]利用黃化的擬南芥幼苗作為缺碳的模式系統,結合代謝組學、脂質組學和蛋白組學分析,缺碳條件下,atg突變株幼苗比野生型幼苗生長遲緩的內在原因,野生型和atg突變株顯著的差別表明,在碳饑餓時自噬作用對細胞代謝的整體影響和一些能量喪失,導致了形態學上的表型變化。多層組學數據的結合,不僅使實驗結果得到相互驗證,更是對研究結果的充分補充說明。在對不同油菜株系含油量區別研究中,Gan等[55]采用超微結構觀察結合蛋白組學和比較基因組分析研究了高含油量(55.19%)和低含油量(36.49%)的兩種油菜株系的種子油提特征及蛋白組差異,發現高含油量株系的油體排列更加緊密,鑒定出119個差異表達蛋白(包含32個油體蛋白),這些蛋白主要參與與油體形成、脫水及蛋白的儲存和防御等生物過程。研究還發現了與含油量相關的QTL區間內包含一些差異蛋白相對應的基因。并通過在擬南芥中表達全場cDNA的方式對一個編碼貯藏蛋白的基因的功能進行了深入分析。
2.4 輔助育種
隨著高通量測序技術的發展,基因組學、轉錄組學、蛋白組學和代謝組學等多組學研究技術已經廣泛應用于農學研究的各個領域,同時它們之間也存在一定的關聯性。運用相應的技術手段對植物體內所有基因、蛋白以及小分子代謝物進行全面的定性定量分析,然后對不同組學數據進行關聯分析,并與植物的各種重要性狀直接相關,從而為植物遺傳改良實踐提供新思路。
植物的生長發育過程中會產生大量的代謝物,其中類黃酮、硫苷、氨基酸、維生素、酚類、萜類等代謝物與品質、抗性等有密切的關系。類黃酮是一類廣泛分布在植物界的次生代謝產物,在植物的發育、花色的形成、植物微生物互作以及應對各種生物、非生物脅迫反應發揮重要作用。Peng等[56]對14種代表性植物中類黃酮的定性及定量分析揭示:單子葉(尤其是鴨跖草類)植物中存在大量的氧糖基黃酮,而擬南芥等大量積累氧糖基黃酮醇。同時對水稻自然群體中所檢測的黃酮代謝組數據[57-58]進行全基因組關聯分析(GWAS),確定了4個控制氧糖基黃酮自然變異的位點。結合體外生化實驗及對轉基因植株的代謝譜分析,鑒定出兩個主效基因:黃酮-5-氧糖基轉移酶(F5GlcT)和黃酮-7-氧糖基轉移酶(F7GlcT)。F5GlcT和F7GlcT強弱功能等位變異組合的分布與水稻品種在不同紫外強度下的地理分布顯著相關,且其超量表達均能顯著提高植株對紫外的耐受性,從而揭示了水稻氧糖基黃酮自然變異的生化基礎及其在紫外耐受性方面的作用,為作物遺傳改良實踐提供了新資源。結合相同的技術,對番茄育種過程中的代謝變化進行全面解讀,對442份材料進行代謝組分析,發現茄堿的自然變異受到5個主要遺傳位點控制,且這些位點在馴化及改良過程中受到強烈選擇。對其中效應最大的位點是位于10號染色體上包含P450氧化還原酶、酰基轉移酶和糖基轉移酶的一個基因簇進行體外實驗,發現糖基轉移酶(Solyc10g085230)外顯子上發現一個點突變造成提前終止,顯著降低栽培番茄果實中茄堿物質的含量。通過兩個主效的位點,能夠將主要茄堿含量降低80%。Zhu等[59]研究表明粉果育種是選擇了在轉錄因子SlMYB12的啟動子區域一個導致低水平轉錄的變異,從而造成粉果番茄中營養因子類黃酮含量大幅下降。另外,研究還表明番茄育種過程中對果重基因的選擇及野生漸滲片段對代謝組的影響,首次揭示了育種過程中代謝組變化的“搭車效應”。該研究通過多組學手段對育種過程進行全景式的分析,其大數據資源也將促進番茄營養、健康品質改良研究。水稻花器官由于類黃酮物質的積累而顯現不同的顏色。Sun等[60]以穎殼著色為例,比較系統地從遺傳、分子、代謝、進化等水平闡述了調控水稻著色的C-S-A基因模型,解析類黃酮著色的遺傳機制及其基因調控網絡。在C-S-A 基因系統中,有三種類型的基因參與調控類黃酮的著色,其中C1編碼R2R3-MYB轉錄因子,決定顏色的產生;S1編碼bHLH轉錄因子,發揮組織特異著色的功能;A1編碼二氫黃酮醇還原酶(DFR),負責花青素的合成。其中,C1和A1是顏色形成的關鍵因子,共同決定了顏色能否形成以及形成何種顏色。為了解植物硫苷代謝的分子網絡,Chen等[61]對擬南芥中脂肪族硫苷的生物合成關鍵酶進行RNA干擾(RNAi),并對其中兩個RNAi的株系進行了蛋白組學和代謝組學的綜合分析。經過整合分析之后發現了細胞通路過程和硫苷代謝之間的緊密分子關系,筆者結合蛋白組學和代謝組學描繪了一個新的硫苷代謝的分子調控網絡,從原因和結果兩個層面綜合闡述硫苷合成酶RNAi之后的系統變化,為進一步了解硫苷調控機制奠定了基礎,有助于后續增強植物抗性和質量,并應用于植物育種中。在對大豆蚜蟲的研究中,Brechenmacher等[45]采用抗蟲能力不同的近等基因系(NIL)材料為研究對象,應用LC-MS/MS技術和RNA測序技術分析了不同材料受蚜蟲危害后轉錄組和蛋白組的差異,對差異表達的生物分子的功能分析較為全面的了解了大豆抗蚜蟲危害的分子機理。另外,通過與NIL位點的綜合分析,發現了一些可能與抗性相關的基因,為大豆抗蟲育種提供了新思路。在棉花抵抗黃萎病菌研究中,Gao等[62]基于蛋白組學分析,發現參與刺激代謝的一些基因,活性氧產生和植物激素信號通路在生理和分子方面的分析中得到確認,相關基因的作用通過病毒誘導基因沉默(VIGS)進一步被表征。研究發現,棉酚、油菜素內酯和茉莉酸的產生足以影響對黃萎病菌的抗性,在棉花接種黃萎病菌油菜素內酯信號被激活,并且外源油菜素內酯的使用增強了棉花對黃萎病菌的抗性,以上數據得出了在分子基礎上棉花抵抗黃萎病菌的新見解,為棉花抗病育種提供了重大參考價值。采用相同的方法,Ning等[63]比較兩個品種以及F10重組自交系(RIL)群體在冷害脅迫下蛋白累計差異,研究發現,PAP6-like蛋白在小麥耐冷方面可能起重要作用。
3 展望
近幾十年來,隨著新技術的不斷涌現,加快了多組學研究向定量化,高通量的發展,特別是在單細胞層次研究基因組學、轉錄組學、蛋白質組學和代謝組學,已成為人們發現生命化學物質基礎和深入了解其分子機制的新方向。伴隨著生物信息學分析的個性化和多樣性,基因組學、轉錄組學、蛋白質組學和代謝組學,在生命科學的多個領域已經取得了重大成果。從基因水平到蛋白水平以及代謝終產物的研究,構建出植物響應逆境的基因-mRNA-蛋白質-代謝物網絡,更為詳實的明確植物在逆境條件下的分子機理,這些組學的聯合運用極大地促進科學界對生命現象的理解。多組學數據雖能夠得到較為完整的結果,但是在分析數據的研究過程中會忽略相關的結論,反而愈加關注差異表達的基因、mRNA、蛋白和代謝物。因此,值得強調的一點就是使用多組學分析技術會增加復雜的風險。就像樹被森林所隱藏,外界環境之間的分子相互作用會被大量的多組學數據淹沒。還有得到的分子代謝網絡應進行遺傳、細胞等水平上的驗證。
在植物響應逆境及輔助育種的研究中,這四大組學的基礎理論研究已經取得了一些進展,并取得了一些突破性的成果。當然,目前組學技術在植物育種的應用研究還處在較為初級的階段。一方面,基因組學、轉錄組學、蛋白質組學和的代謝組學,在基礎理論研究中取得了豐碩的成果;另一方面,基因組學、轉錄組學、蛋白質組學和的代謝組學應用于植物生產上培育良種的實踐較少。未來應該將組學多應用于實踐,培育和改良新品種,特別是對于培育突破性品種。基因編輯作為一項最有效、最便捷地“編輯”基因的技術,在作物遺傳改良上的取得了豐碩的成果[64-66],這項史詩級的技術能對植物基因組進行精準的定點敲除、插入和替換。隨著人們對植物的抗性、品質育種的不斷重視,組學技術和基因編輯技術聯合起來運用對植物基因功能研究、作物遺傳改良和新品種培育未來將具有巨大的潛力。運用組學的優勢和科研成果可深入到醫學、農業以及資源保存等研究領域,推動基因科技成果轉化,實現基因科技造福人類。
4 結語
隨著各組學分析平臺的不斷革新,數據挖掘、分析工具和方法的不斷改進,基因、蛋白和代謝物共享數據庫的建立和不斷完善,將來自不同組學的數據源進行歸一化處理、比較分析,建立不同組間數據的關系,綜合多組學數據對生物過程從基因、轉錄、蛋白和代謝水平進行全面的深入的闡釋,多層組學未來在植物研究中會得到更加廣泛的應用。多層組學聯合分析將在揭示水稻響應脅迫機制、基因功能解析及輔助育種等方面發揮越來越重要的作用。

