脯氨酸氨肽酶枯草芽孢桿菌分泌表達及特性表征
汪克紅, 王開道, 田亞平
(江南大學 工業生物技術教育部重點實驗室,江蘇 無錫214122)
脯 氨 酸 氨 肽 酶 (prolyl aminopeptidase,PAP,EC3.4.11.5)是一類能特異地水解多肽或蛋白N-端脯氨酸殘基的氨肽酶,具有嚴格的底物特異性,在蛋白類食品水解加工產物苦味的去除[1],膠原蛋白水解等方面都有著較好的應用前景[2]。脯氨酸氨肽酶的來源廣泛,在動物[3]、植物和微生物中都有存在,但目前大多數報道的脯氨酸氨肽酶都來源于微生物[4-6]。
目前有關脯氨酸氨肽酶的研究主要集中在基因克隆、分離純化和性質描述方面,而對脯氨酸氨肽酶的異源表達研究較少,表達量較低,無法進行大規模生產[7]。Bacillus subtilis作為食品安全菌種[8],由于其遺傳背景清晰,無致病性,蛋白分泌能力強,無密碼子偏好性以及發酵周期短等優點已被廣泛用于外源基因的表達宿主[9-10]。本研究將前期從日式醬油成品曲中篩選到的米曲霉胞內脯氨酸氨肽酶的cDNA基因克隆到枯草芽孢桿菌中進行表達,并通過優化培養基組成提高胞外分泌量,從而為工業化生產脯氨酸氨肽酶奠定基礎。
1 材料與方法
1.1 菌株與質粒
E.coli JM109、枯草芽孢桿菌WB600、穿梭質粒pMA5、含目的基因的載體pMD19-pap。
1.2 培養基
LB培養基:蛋白胨10 g/L,酵母粉 5 g/L,NaCl 10 g/L,pH 7.0。
TB培養基:蛋白胨12 g/L,酵母粉24 g/L,甘油4 g/L,17 mmol/L KH2PO4,72 mmol/L K2HPO4。
分泌培養基:蛋白胨12 g/L,酵母粉24 g/L,甘油 4 g/L,D-山梨醇 50 g/L,2 mmol/L CaCl2,17 mmol/L KH2PO4,72 mmol/L K2HPO4。
1.3 主要試劑
質粒DNA抽提試劑盒、DNA膠回收試劑盒購自上海生工生物工程股份有限公司;所有的底物均購自瑞士Bachem公司;PrimeSTAR?DNA Polymerase、限制性內切酶、T4連接酶、DNA Marker購自寶生物工程(大連)有限公司;蛋白胨、酵母粉購自Oxoid公司;其他試劑均為國產分析純。
1.4 酶活測定
以L-脯氨酸-對硝基苯胺為底物 (底物儲藏液用Tris-HCl 7.5配制,濃度為4.25 mmol/L),反應體系包括2 mL Tris-HCl 7.5緩沖液,1 mL底物儲藏液和 1 mL稀釋后的酶液,50℃水浴 10 min,在405 nm處測定吸光值。50℃下每分鐘分解PropNA產生1 μmol/L對硝基苯胺所需的酶量為一個酶活單位(U)。
1.5 重組菌株的構建
根據脯氨酸氨肽酶基因序列設計一對引物:上游引物 5'CGGGATCCATGGCTGCCAAAC 3'(BamHⅠ);下游引物 5'CGCGACGCGTCTAATCAATAG AGTC 3'(MluⅠ),從載體 pMD19-pap 上擴增含酶切位點的目的基因。將目的基因與質粒pMA5分別用BamHⅠ和MluⅠ進行雙酶切,膠回收純化后按一定比例混合在16℃金屬浴下連接12~16 h并轉化E.coli JM109感受態,涂布氨芐抗性的LB固體培養基,待長出轉化子后先經菌落PCR初步驗證,將驗證正確的重組子提取質粒雙酶切驗證后進行測序。將構建成功的重組質粒電轉化進Bacillus subtilis WB600中得重組菌。
1.6 重組菌的發酵表達
將重組 Bacillus subtilis WB600(pMA5-pap)接種于50 mL含卡那抗性的TB培養基,37℃,220 r/min振蕩培養24 h。發酵結束后在4℃條件下8 000 r/min冷凍離心10 min,上清液進行胞外酶活的測定。菌體沉淀用Tris-HCl 7.5的緩沖液洗滌兩遍后用相同體積的緩沖液重懸,菌懸液按照一定倍數稀釋超聲破碎后進行胞內酶活的測定。重組菌脯氨酸氨肽酶的表達情況用SDS-PAGE進行檢測。
1.7 重組菌胞外分泌策略
通過對TB培養基成分的調整,增加胞外重組脯氨酸氨肽酶的分泌量。
1.8 重組脯氨酸氨肽酶分離純化
重組菌在分泌培養基中發酵結束后離心得到上清液,上清液經硫酸銨鹽析后用50 mmol/L Tris-HCl 6.5緩沖液溶解,然后在此緩沖液中4℃透析過夜,透析后過膜(0.22 μm)作為離子交換層析上樣樣品。
Hitrap Q HP離子交換層析柱經50 mmol/L Tris-HCl 6.5緩沖液平衡后,上樣1 mL,流速1 mL/min,控制NaCl的濃度為0.2、0.3和1 mol/L分三步階段洗脫各洗10個柱體積,每管收集0.5 mL洗脫液。
將酶活最高的幾管合并后用超濾管濃縮,濃縮液用于跑SuperdexTM 75 10/300 GL凝膠柱,上樣0.5 mL,流速 0.5 mL/min,50 mmol/L Tris-HCl 6.5 緩沖液進行洗脫,每管收集0.5 mL。上述各部收集液進行SDS-PAGE驗證其純度。
1.9 重組脯氨酸氨肽酶酶學性質
將分離純化所得脯氨酸氨肽酶于不同pH值下測定其活性,以酶活最高者定義為100%,分別考察其最適pH和pH穩定性。在不同的溫度下對重組脯氨酸氨肽酶的酶活進行測定以確定其最適反應溫度,將其在系列溫度下保溫1 h后用1.4節所述方法測定剩余酶活力,以4℃保溫的為100%以確定其溫度穩定性。
將純酶液與相應濃度的金屬離子MnCl2、MgCl2、ZnSO4、CuSO4、CoCl2、NiSO4及 蛋 白 酶 抑 制 劑PMSF、DTT、β-巰基 乙醇 和 EDTA 在 50 mmol/L Tris-HCl 7.5緩沖液中30℃溫浴30 min后用標準方法測定剩余活性以考察金屬離子及蛋白酶抑制劑對重組脯氨酸氨肽酶的影響。
將純酶液分別與 0.5 mol/L 的 NaCl,KCl,Na2SO4和K2SO4(溶于50 mmol/L Tris-HCl 7.5緩沖液中)30℃溫浴30 min后用標準方法測定酶活以考察鹽的種類對重組脯氨酸氨肽酶的影響,在0~4.36 mol/L NaCl下考察其耐鹽性。
分 別 配 置 Lys-pNA,Leu-pNA,Ala-pNA,Met-pNA,Ile-pNA,Val-pNA,Arg-pNA 和 Pro-pNA以考察其底物特異性,以酶活最高者為100%。以不同濃度的L-脯氨酸-對硝基苯胺為底物 (0.2~1.4 mmol/L),用標準方法測定酶活,利用雙倒數作圖法計算重組脯氨酸氨肽酶的米氏常數Km及其最大反應速率Vmax。
2 結果與討論
2.1 重組菌株的構建
根據脯氨酸氨肽酶cDNA序列設計引物,將脯氨酸氨肽酶基因從載體pMD19-pap上擴增了下來,兩端分別帶上了BamHⅠ和MluⅠ酶切位點。按1.5節所述方法構建重組質粒,其雙酶切驗證結果如圖1所示,重組質粒切出了大、小兩條帶,其大小分別與空質粒和脯氨酸氨肽酶PCR產物相對應,表明重組質粒構建成功。將重組質粒送上海生工測序,測序結果與脯氨酸氨肽酶cDNA序列一致,表明序列沒有發生突變。將重組質粒用電轉儀在12.5 kV/cm,25 μF,200 Ω,4.5~5.0 ms 條件下電轉化進Bacillus subtilis WB600,并在卡那抗性的LB固體培養基上挑選重組子,重組子經PCR快速驗證和雙酶切驗證后表明已構建成功,該重組菌用于脯氨酸氨肽酶發酵表達。

圖1 重組質粒雙酶切驗證Fig.1 Identification of the recombinant plasmid by BamH I and Mlu I
2.2 重組菌發酵表達
重組 Bacillus subtilis WB600(pMA5-pap)按 1.6節所述方法進行發酵表達后,測得其胞外酶活的值為7.5 U/mL,胞內酶活為40.0 U/mL,SDS-PAGE驗證結果見圖2,由圖可以看出在50 kDa處出現了明顯的蛋白條帶,表明脯氨酸氨肽酶在枯草芽孢桿菌中成功實現了表達。由表達結果看出,雖然有一部分脯氨酸氨肽酶分泌到了胞外,但分泌量較少,大多數還集中在胞內,不利于工業化生產和制備,因此后續將采用一定的手段提高胞外表達量從而簡化純化步驟。
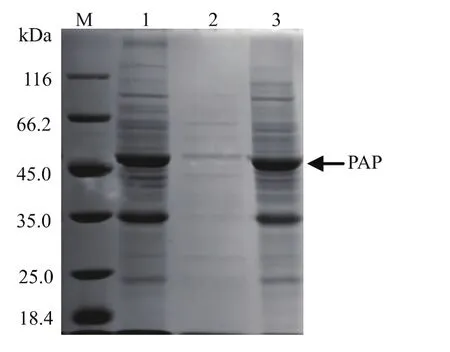
圖2 重組脯氨酸氨肽酶表達SDS-PAGE驗證Fig.2 SDS-PAGE analysisofrecombinantprolyl aminopeptidase expression
2.3 重組脯氨酸氨肽酶胞外分泌
由于該脯氨酸氨肽酶自身為胞內酶,前期也嘗試過加信號肽,但信號肽的添加導致其不能正常表達,因此本研究采用在培養基中添加滲透劑的方法改變細胞膜的通透性以提高胞外分泌量。前期通過實驗探索發現D-山梨醇和CaCl2對胞外分泌有促進作用,因此進一步對該兩種物質的添加量做了研究,其結果如表1所示,綜合考慮對細胞生長的影響確定5%為D-山梨醇的最適添加量,當CaCl2的最終濃度為2 mmol/L時脯氨酸氨肽酶的胞外分泌量達到最大為36.0 U/mL,相比于TB培養基時(7.5 U/mL)提高了4.8倍。

表1 培養基組成對胞外酶活的影響Table 1 Effect of medium composition on extracellular enzyme activity
2.4 胞外脯氨酸氨肽酶的純化
采用分泌培養基對重組菌進行發酵培養后離心得上清發酵液,發酵液按1.8節所述方法進行純化,所用硫酸銨鹽析的飽和度為40%~50%,純化結果如表2所示,由表可知,最終純化所得脯氨酸氨肽酶的比酶活為247.3 U/mg,純化倍數為8.8倍,收率為1.7%。各步純化的SDS-PAGE驗證結果如圖3所示,由圖可以看出經superdex純化后重組脯氨酸氨肽酶達到了電泳純。
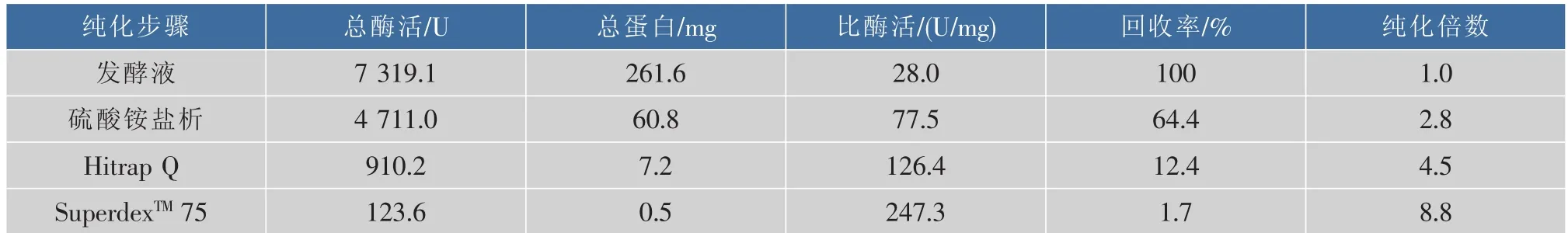
表2 重組脯氨酸氨肽酶純化結果Table 2 Purification of recombinant prolyl aminopeptidase
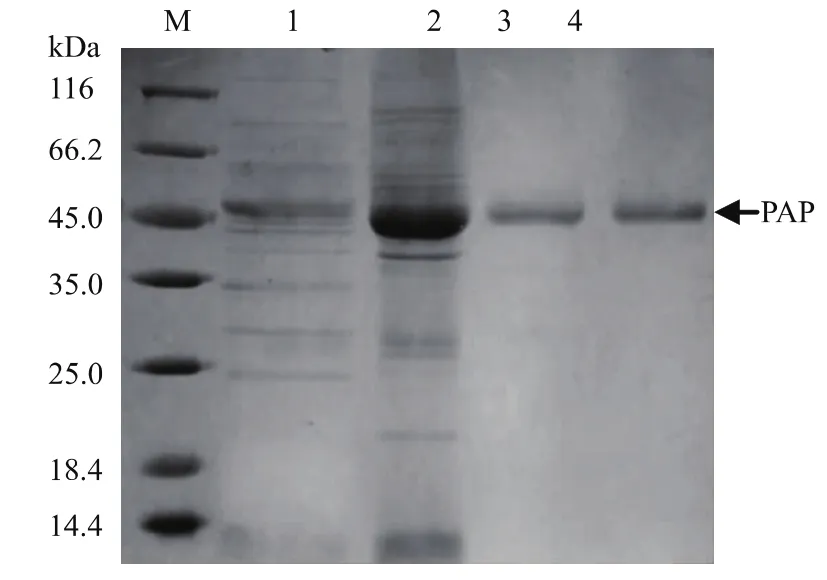
圖3 重組脯氨酸氨肽酶各步純化SDS-PAGE驗證Fig.3 SDS-PAGE analysis of purified prolyl aminopeptidase
2.5 重組脯氨酸氨肽酶的酶學性質
該脯氨酸氨肽酶在枯草芽孢桿菌中重組表達后其基本酶學性質變化不大,在50℃時表現出最大的催化活性,在50℃及以下保溫后剩余酶活仍有75%以上,當60℃保溫1 h后活性基本喪失,說明該酶對高溫的耐受性還有待提高[11]。該酶的最適pH值為7.5,與來源于Debaryomyces hansenii(pH 7.5),Penicillium camemberti(pH 7.0)和 Arthrobacter nicotianae 9458(pH 8.0)的脯氨酸氨肽酶的最適pH相近[5,12-13],在 pH 6~11 之間穩定,在酸性環境中酶活喪失嚴重。在金屬離子當中,只有ZnSO4和CuSO4對該酶有較強的抑制作用,在1 mmol/L的濃度下30℃保溫30 min后相對酶活僅為2%和5%。該酶為非金屬依賴型酶,也不含二硫鍵,因此EDTA和β-巰基乙醇對酶活性均沒有影響。
研究發現該酶具有一定的耐鹽性,首先考察了幾種鹽類對酶活性的影響,結果如圖4所示,由圖可以看出一定濃度的鹽不但對該酶沒有抑制作用,反而還有一定的激活作用,且這種激活作用與鹽的種類關系不大。進一步用NaCl考察了該酶的耐鹽性,發現當NaCl的濃度達到4.36 mol/L時仍有109.5%的相對酶活,說明該酶能耐受較高的鹽濃度。脯氨酸氨肽酶的這種耐鹽性在別的菌株里也有過報道,Uraji等人[14]發現來源于 Streptomyces aureofaciens TH-3的脯氨酸氨肽酶能耐受4 mol/L的NaCl,且推測脯氨酸氨肽酶的這種耐鹽機制可能與其N端氨基酸殘基的疏水作用有關,Matsushita-Morita等人[15]報道的米曲霉脯氨酸氨肽酶也具有一定的耐鹽性,其鹽濃度也能達到4 mol/L,Fukuuchi等人[16]對嗜鹽菌里蛋白的氨基酸組成進行了研究,指出蛋白表面的酸性殘基可能有助于其適應高鹽環境,且過多的具有較小pKa值的天冬氨酸的存在會導致其在高鹽濃度下帶電形式的酸性殘基增加。利用該特性在一些酶解過程中可適量提高鹽濃度以更好地發揮酶活性[17]。另外由于米曲霉自身產的脯氨酸氨肽酶只存在于胞內且含量甚微,如果額外添加適量氨肽酶與醬油曲復合使用可提高醬油中氨基酸含量并獲得更好的風味。
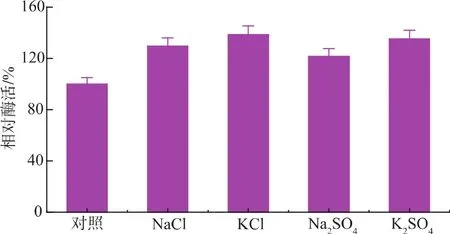
圖4 鹽種類對重組脯氨酸氨肽酶的影響Fig.4 Effects of several salts on recombinant prolyl aminopeptidase activity
通過對8種AA-pNA進行水解,其結果如圖5所示,說明該酶只對Pro-pNA有水解作用,而對其他幾種底物均無水解作用,說明該酶對脯氨酸具有嚴格的底物特異性。用L-脯氨酸-對硝基苯胺為底物,重組脯氨酸氨肽酶的動力學方程如圖6所示,根據圖中方程計算得米氏常數Km和最大反應速率Vmax分別為 0.171 mmol/L 和 55.99 μmol/(L·min),與大腸桿菌表達的重組脯氨酸氨肽酶(Km和Vmax分別為 0.06 mmol/L 和 28.70 μmol/(L·min)) 相比[18],雖然其對底物親和力有所降低,卻表現出更高的催化效率。
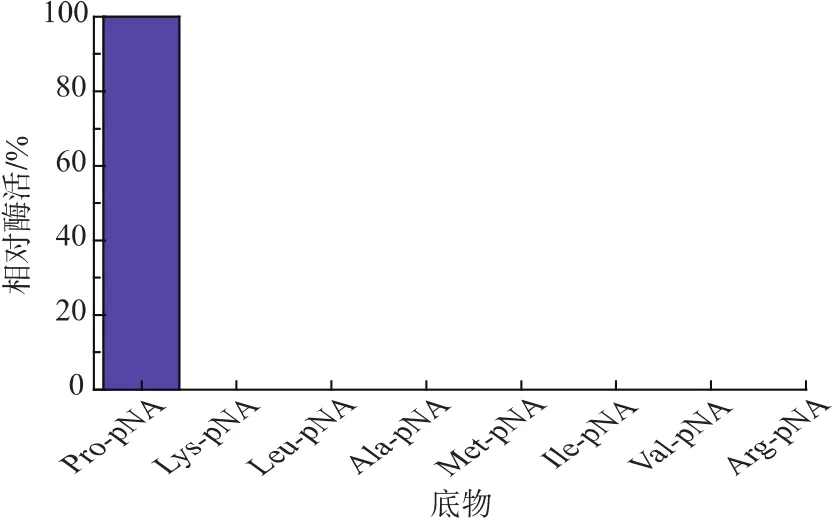
圖5 重組脯氨酸氨肽酶的底物特異性Fig.5 Substrate specificity of recombinant prolyl aminopeptidase
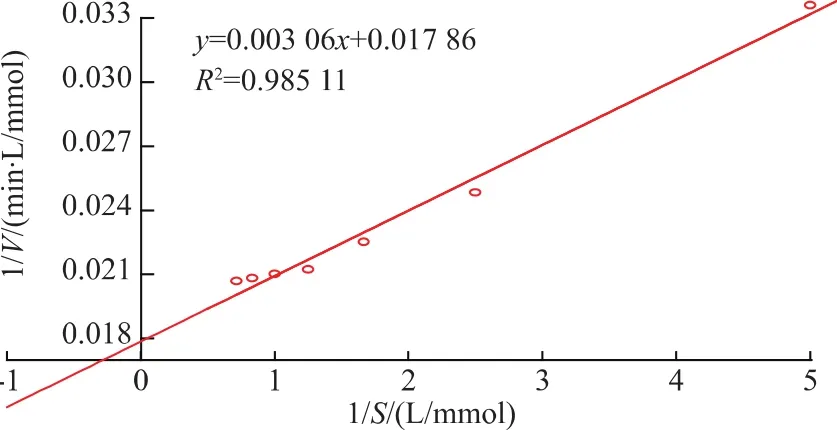
圖6 重組脯氨酸氨肽酶Lineweaver-Burk雙倒數圖Fig.6 Lineweaver-Burk plot of recombinant prolyl aminopeptidase
3 結 語
本研究成功實現了脯氨酸氨肽酶基因在枯草芽孢桿菌中的表達,并通過分泌培養基大大提高了胞外表達量,相比于大腸桿菌其安全性、胞外分泌能力、以及表達量均有所提高。隨著生物技術的發展,各種不同類型的氨肽酶的應用和需求也越來越廣泛,除了用于蛋白水解和改善風味之外,在醫療診斷與檢測、蛋白測序等領域也發揮著日益重要的作用。后續通過帶標簽表達簡化純化過程,優化放大發酵條件可實現脯氨酸氨肽酶的生產。

