益母草堿對小鼠腦缺血再灌注損傷的影響及機制
何磊,張清秀,魏秀娥,高紅,宋加興,榮良群
(徐州醫科大學第二附屬醫院,江蘇徐州221006)
缺血性腦卒中是腦血管病最常見的類型,炎癥反應是其損傷的主要機制之一[1,2]。腦缺血后的再灌注損傷可使血腦屏障中緊密連接蛋白(ZO-1)等多種連接蛋白減少,屏障通透性增加及完整性破壞,而產生腦水腫[3]。研究表明,腦缺血再灌注損傷后炎癥反應的增加與血腦屏障通透性的改變密切相關[4]。p38絲裂原活化蛋白激酶(p38 MAPK)信號通路可介導缺血再灌注損傷后的炎癥反應、細胞凋亡及分化[5]。p38的激活可使炎性細胞因子表達增高[6]。研究表明,干擾p38 MAPK信號通路可降低缺血組織的損傷程度。益母草堿(LEO)是一種活性生物堿,具有多種生物學功能,對心腦血管疾病有保護性作用[7]。2017年10月~2018年3月,本研究通過建立小鼠大腦中動脈栓塞模型模擬腦缺血再灌注損傷,探討LEO對小鼠腦缺血再灌注損傷的影響,探討其是否通過抑制p38 MAPK激活、減少炎癥反應而發揮保護作用。
1 材料與方法
1.1 動物與材料 普通級健康雄性昆明小鼠120只,體質量20~24 g,由徐州醫科大學實驗動物中心提供。佳靈線栓購于廣州佳靈生物技術有限公司;無水乙醇及甲醇購于國藥集團化學試劑有限公司;LEO、2,3,5-氯化三苯基四氮唑(TTC)、伊文思藍和N,N-二甲基甲酰胺均購于美國Sigma公司;蘇木素-伊紅染料購于南京凱基生物技術發展有限公司;p38、p-p38單克隆抗體均購于CST公司;ZO-1多克隆抗體購于美國Thermo Fisher Scientific公司;IL-1β、IL-6、TNF-α引物由上海生工生物工程股份有限公司合成;TIANScript cDNA第一鏈合成試劑盒(KR104)購于天根生化科技(北京)有限公司。
1.2 小鼠分組與大腦中動脈栓塞模型建立 將小鼠隨機分為假手術組、模型組、LEO組3組,每組40只。模型組、LEO組按參考文獻[8]制備小鼠大腦中動脈栓塞模型。用4%水合氯醛對小鼠進行麻醉,固定并消毒頸部皮膚,做正中切口,暴露頸部組織,鈍性分離小鼠右側頸總動脈、頸外動脈及頸內動脈,在頸總動脈和頸外處打活結,在頸外動脈上距分叉不遠處剪一小口插入線栓送入頸內動脈,至有阻力時停止,活結固定,線栓阻塞90 min后拔出,形成缺血再灌注損傷。假手術組除不插入線栓外,其余操作同模型組。
1.3 LEO給藥方法 預實驗結果提示,高劑量LEO的腦保護作用更明顯,故選擇高劑量LEO[15 mg/(kg·d)]進行后續實驗。造模后30 min,LEO組腹腔注射LEO溶液15 mg/(kg·d),假手術組和模型組腹腔注射等體積生理鹽水。
1.4 腦梗死體積測量 采用TTC染色法。小鼠造模后24 h,每組隨機取5只,斷頭取腦,切掉嗅球和小腦,隨后將腦組織冠狀切成5等份[9],每片厚度為2~3 mm,放入2%的TTC溶液中,37 ℃恒溫箱避光孵育15 min,將腦切片放于4%多聚甲醛過夜固定。用Image-Pro Plus6.0軟件測定腦梗死體積。圖片紅色區域為正常腦組織,白色區域為缺血梗死部位。計算腦梗死體積:梗死體積比=梗死體積/全腦體積×100%,梗死體積=各切面梗死面積之和×厚度,全腦體積=各切面總面積×厚度。
1.5 腦水腫程度測定 參照文獻[10]方法操作。造模24 h后,每組取5只小鼠斷頭取腦,切除嗅球和小腦,將腦組織放入105 ℃烘箱24 h,后取出稱量干重,測腦含水量以評價腦水腫程度,腦含水量=(濕重-干重)/濕重×100%。
1.6 血腦屏障通透性測定 采用伊文思藍(EB)法[11]。造模21 h后,尾靜脈注射2%EB(4 mL/kg,生理鹽水配制),體內循環3 h后麻醉,用生理鹽水進行心臟灌注至流出清亮液體,之后斷頭取腦,拍照。切除梗死側半球稱量濕重后,放入3 mL甲酰胺中萃取,60 ℃水浴鍋孵育24 h,取出后離心取上清液,加入96孔板中,用酶標儀測標準曲線及各樣本吸光度,計算腦組織EB含量。
1.7 腦組織形態觀察 采用HE染色法。小鼠造模24 h后,用10%水合氯醛腹腔注射進行麻醉,后用生理鹽水灌注,再用4%多聚甲醛灌注以固定腦組織,剝離鼠腦放入4%多聚甲醛中過夜以再次固定,取出后再用各濃度乙醇脫水,二甲苯透明,石蠟包埋及切片。用HE染料進行染色,在顯微鏡下觀察腦組織神經元病理變化。
1.8 腦組織p-p38及ZO-1蛋白表達檢測 采用Western blotting法。造模24 h后,斷頭取腦切取缺血側大腦皮層,提取腦組織中總蛋白,分別檢測p-p38和ZO-1。BCA法進行蛋白定量,用酶標儀測出標準曲線及各樣本濃度,計算并調整濃度使一致。上樣,待電泳后轉膜 (PVDF膜),室溫放于脫色搖床封閉4~6 h。隨后加入相應的抗體稀釋液,4 ℃搖床過夜后取出,室溫靜置30 min,洗膜并用對應的二抗孵育1.5 h,洗膜并曝光拍照。用Image J軟件進行圖片分析。
1.9 腦組織炎性因子表達檢測 采用RT-PCR法檢測腦組織炎性因子包括IL-1β、IL-6、TNF-α mRNA表達。TRIzol法提取腦缺血側總RNA,按照天根公司的TIANScript cDNA第一鏈合成試劑盒(KR104)進行逆轉錄。GAPDH正義鏈5′-CAACTTTGGCATTGTGGAAGG-3′,反義鏈5′-ACACATTGGGGGTAGGAACAC-3′;IL-1β正義鏈5′-CCAGGGCATGTTAAGGAGCT-3′,反義鏈5′-CCATCAGAGGCAAGGAGG AA-3′;IL-6正義鏈5′-GCTGGTGACAACCACGGCCT-3′,反義鏈5′-AGCCTCCGACTTGTGAAGTGGT-3′;TNF-α正義鏈5′-TCCTGGCCAACGGCATGGAT-3′,反義鏈5′-AATCGGCTGACGGTGTGGGT-3′。
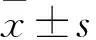
2 結果
2.1 各組腦梗死體積比、腦含水量、血腦屏障通透性比較 模型組腦梗死體積比、腦含水量、EB含量均高于假手術組,LEO組腦梗死體積比、腦含水量、EB含量均低于模型組(P均<0.05)。見表1。
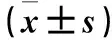
表1 各組腦梗死體積比、腦含水量及EB含量比較
2.2 各組大腦皮層及海馬神經元損傷情況比較 與假手術組相比,模型組皮層及海馬大片神經元間疏松水腫,細胞核固縮未見有清晰核仁、炎癥細胞浸潤等缺血缺氧壞死的病理改變。與模型組相比,LEO組損傷神經元細胞顯著減少,胞核較為清晰,形態正常的神經元增多。
2.3 各組p-p38和ZO-1蛋白表達比較 模型組p-p38蛋白表達高于假手術組、ZO-1蛋白表達低于假手術組,LEO組p-p38蛋白表達低于模型組、ZO-1蛋白表達高于模型組(P均<0.05)。見圖1、表2。

注:A為p-p38蛋白表達,B為ZO-1蛋白表達。
2.4 各組皮層炎癥介質表達比較 模型組IL-1β、IL-6、TNF-α mRNA表達均高于假手術組,LEO組IL-1β、IL-6、TNF-α mRNA表達均低于模型組(P均<0.05)。見表2。
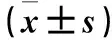
表2 各組p-p38、ZO-1蛋白及IL-1β、IL-6、TNF-α mRNA表達比較
3 討論
小鼠腦缺血再灌注損傷的發病機制為多因素,包括炎癥反應、血腦屏障破壞等[1]。在腦受到應激后,炎癥反應迅速發生促使炎細胞浸潤和炎癥介質的釋放,再灌注后中性粒細胞、小膠質細胞和星形膠質細胞等被激活,產生大量IL-1β、IL-6和TNF-α等炎癥介質,加重炎癥反應[12,13]。此外,血腦屏障的破壞與腦缺血再灌注損傷的發病機制也有著密切的關系。血腦屏障由血管內皮細胞、基底膜、周細胞和星形膠質細胞組成。內皮細胞間存在大量緊密連接,ZO-1是維持大腦微血管內皮完整性的主要結構和功能分子[14]。腦卒中后,炎癥反應使內皮細胞發生毒性反應導致血管完整性的改變,使屏障發生滲漏[15]。本研究發現,模型組腦梗死體積比、腦含水量及EB含量均高于假手術組,提示腦缺血再灌注后小鼠腦梗死體積及腦水腫程度加重、血腦屏障通透性增加、大腦皮層及海馬神經元嚴重損傷,可見,缺血對腦組織產生的損害極為嚴重。
p38 MAPK在正常組織中幾乎不表達,但在細胞應激如凋亡刺激和炎性損傷時則被激活。研究表明,p38 MAPK已經被確認為抑炎藥物的目標蛋白,在炎性因子mRNA的翻譯和穩定性方面都起著重要的作用[16]。在小鼠腦缺血再灌注后,腦內固有的細胞及外周免疫細胞都被大量激活,使炎癥因子表達升高,同時p38信號通路也在此過程中活化,p-p38在神經元細胞中表達增多,進一步促進了炎癥介質的釋放,使滲入血腦屏障中的毒性物質增多而參與血腦屏障的破壞[17]。本研究發現,模型組的p-p38蛋白表達高于假手術組,而ZO-1蛋白的表達則低于假手術組,表明p38 MAPK信號通路可能參與了腦缺血再灌注損傷所致的炎癥級聯反應,缺血再灌注后,機體通過上調p-p38和炎癥因子的表達,使腦水腫程度增大,細胞壞死凋亡進而導致血腦屏障發生滲漏,完整性破壞。
益母草為益母草屬植物,其主要成分為LEO,許多研究證明LEO具有溶栓、改善微循環、抗氧自由基、減少細胞內鈣超載等諸多作用,已被廣泛用于缺血性心腦血管病的治療[18]。研究顯示,LEO可顯著抑制BV-2細胞中炎性蛋白的表達,可減輕炎癥反應,減少血腦屏障的損傷,主要是通過抑制c-Jun N末端激酶(JNK)信號通路[19]。在急性腎損傷中,LEO能改善腎功能,顯著抑制 TNF-α、IL-1、IL-6 等炎癥因子表達,使腎臟損傷減輕[20];此外,它也能減輕大鼠急性內毒素性葡萄膜炎模型的炎癥反應,可見,LEO可通過減輕機體損傷后的炎癥反應,而發揮其保護作用[21]。本研究發現,LEO組梗死體積比、腦含水量、EB含量均低于模型組,提示予LEO治療后,與模型組相比,小鼠腦梗死體積減少,腦水腫程度下降;LEO組與模型組相比,損傷神經元減少,胞核較為清晰,形態正常的神經元數增多,且LEO組腦組織ZO-1蛋白表達也增加,提示LEO可顯著改善血腦屏障的完整性,使神經元細胞損傷有所恢復;LEO組腦組織IL-1β、IL-6、TNF-α mRNA表達均低于模型組,提示LEO可抑制腦組織炎癥反應,可能與其改善腦組織缺血再灌注損傷有關。

