1 株產桔青霉素擴展青霉的鑒定及其產毒條件優化
李慧芳,趙利娜,鄭香峰,王 蕓,刁軍委,張曉云,張紅印,*
(1.江蘇大學食品與生物工程學院,江蘇 鎮江 212013;2.江蘇大學生命科學研究院,江蘇 鎮江 212013)
桔青霉素(citrinin,CIT)是一種由青霉、曲霉、紅曲霉屬的某些菌株產生的對革蘭氏陽性菌具有強烈抑菌效果的真菌次級代謝產物[1-2]。CIT是繼黃曲霉毒素后又一個引起世界范圍廣泛關注的霉菌毒素,是食品和飼料的天然污染物,主要發生在儲藏的谷物、玉米、小麥、大米、大麥和堅果中[3-4],且會與其他毒素共同存在。體內體外的大量研究已經證明CIT對人體和動物具有腎毒性[5]、胚胎毒性[6]、致畸性[7]、致癌性[8],還會破壞小鼠的生殖系統[9],導致動物機體消化系統紊亂,發生腹瀉[10],是另一個除赭曲霉毒素A之外引起巴爾干地區腎病的潛在病原體[11]。此外,CIT可與其他真菌毒素如赭曲霉毒素、展青霉素等發生協同作用,增強對人畜的危害[12-13]。鑒于CIT污染廣、毒性大的特點,人們對于CIT的關注度越來越高。
2000年日本率先規定了紅曲色素中CIT的含量不能超過0.2 μg/g[14],歐盟要求CIT在紅曲霉發酵大米中的限量標準為2 μg/g[15]。我國直到2008年才規定液態和固態紅曲類產品中CIT限量標準分別為50 μg/L和1 μg/g,而對食品中CIT無限定指標。GB 5009. 222—2016《食品中桔青霉素的測定》中增加了大米、玉米、辣椒粉樣品中CIT限量標準為25 μg/kg,大麥、燕麥、小麥中CIT不得超過10 μg/kg,紅曲及其制品中CIT限量標準修改為80 μg/kg。然而對于水果及其制品中CIT的限量值仍未提及。
早在1931年,已有報道指出從桔青霉(Penicillium citrinum)的液體培養基中分離得到CIT[16]。后來發現曲霉屬和紅曲霉中也有大量的菌株能夠積累CIT[17]。此外,CIT也是青霉屬某些菌株的代謝產物,如黃綠青霉(Penicillium citreoviride)、點青霉(Penicillium notatum)等。青霉是導致水果腐爛的主要真菌,因此產生的次級代謝產物CIT對各種水果及其制品都有不同程度的污染[18-19]。Andersen等[20]從水果、果汁和谷物中分離得到260 株青霉,研究發現近85%的青霉能夠產生CIT。Aziz等[21]檢測了腐爛葡萄、蘋果、梨等水果傷口處的CIT,發現CIT含量為280~920 μg/kg。Dietrich等[22]對超市中的幾種果汁進行了CIT檢測,結果表明果汁中也含有CIT,最高質量濃度達到20 μg/mL。尤其是柑橘果實,常常受到CIT的污染。CIT的污染基本上發生在柑橘采后貯藏期,受環境、收獲年份及地理位置等的影響,CIT對柑橘的污染程度有所不同。對于水果中真菌毒素的研究,目前主要集中在葡萄及其制品中赭曲霉毒素,蘋果及其制品中展青霉素等的研究,對于柑橘果實中的真菌毒素尤其是CIT的研究鮮有報道[23]。
鑒于CIT的毒性及在水果及其產品中的污染情況,本課題組在鎮江江心洲果園的腐爛柑橘上篩選出1株產CIT的菌株H1,經鑒定為擴展青霉(Penicillium expansum),并進一步研究培養基、溫度、pH值、溶氧量、培養時間等對菌株H1生長及產CIT能力的影響。該研究不僅為生產條件下規避柑橘CIT產毒條件、減少毒素產生的風險提供一定的依據,同時為控制CIT產毒方法的研究提供實驗支撐,具有重要的現實意義。
1 材料與方法
1.1 材料與試劑
本實驗所用菌株H1采用平板劃線法分離自江蘇省鎮江江心洲果園的腐爛柑橘果實。
CIT標準品 北京普華仕科技發展有限公司;甲醇、乙腈(均為色譜純) 美國Sigma公司;甲苯、乙酸乙酯、甲酸、酵母浸膏、瓊脂、蔗糖、葡萄糖、ZnSO4·7H2O、MnSO4·H2O、MgSO4·7H2O、FeSO4·7H2O、CaCl2、KH2PO4、K2HPO4、L-谷氨酸單鈉國藥集團化學試劑有限公司;核酸染色液、瓊脂糖、TAE電泳緩沖液、聚合酶鏈式反應(polymerase chain reaction,PCR)Supermix(包含PCR緩沖液、dNTP、Taq酶等)、DNA提取試劑盒 生工生物工程(上海)股份有限公司;實驗所用引物由生工生物工程(上海)股份有限公司合成。
1.2 儀器與設備
1260高效液相色譜儀(配熒光檢測器) 安捷倫科技有限公司;7300型基因擴增儀 美國ABI公司;ChemiDoc XRS型凝膠成像系統 美國Bio-Rad公司;DYY-12型電腦三恒多用電泳儀 北京六一公司;血球計數板 丹陽市健陵醫療器械公司;全自動高壓滅菌鍋上海三申醫療器械有限公司;LRH-250生化培養箱上海一恒科技有限公司;數碼成像光學顯微鏡 江南光學儀器廠。
1.3 方法
1.3.1 培養基和試劑的配制
馬鈴薯葡萄糖液體(potato dextrose broth,PDB)培養基:馬鈴薯200 g,加水煮沸20 min,過濾后往濾液中加入20 g葡萄糖,蒸餾水定容至1 L,121 ℃高壓滅菌30 min。
馬鈴薯葡萄糖瓊脂(potato dextrose agar,PDA)培養基:在PDB培養基的基礎上加入20 g瓊脂,其余處理完全相同。
味精(MSG)培養基:ZnSO4·7H2O 0.01 g,MnSO4·H2O 0.03 g,MgSO4·7H2O 0.5 g,FeSO4·7H2O 0.01 g,CaCl20.1 g,KH2PO45 g,K2HPO45 g,L-谷氨酸單鈉 5 g,葡萄糖20 g,加蒸餾水定容至1 000 mL,121 ℃高壓滅菌20 min。
酵母浸膏蔗糖(YSM)培養基:酵母浸膏40 g,蔗糖160 g,加蒸餾水定容至1 000 mL,121 ℃高壓滅菌20 min。
復合萃取劑:甲苯-乙酸乙酯-甲酸(7∶3∶1,V/V)。
CIT標準儲備溶液:將1 mg CIT標準品溶于1 mL色譜級甲醇中,制成1 000 μg/mL的CIT標準儲備溶液,保存在-20 ℃冰箱中。
1.3.2 分子生物學鑒定
首先使用DNA提取試劑盒提取菌株的DNA,然后用PCR儀擴增得到該菌的內轉錄間隔區(internal transcribed spacer,ITS)、BenA、CaM、PRB2序列,引物分別為ITS:ITS1(F):TCCGTAGGTGAACCTGCG和ITS4(R):TCCTCCGCTTATTGATATGC;BenA:Bt2a(F):GGTAACCAAATCGGTGCTGCTTTC和Bt2b(R):ACCCTCAGTGTAGTGACCCTTGGC;CaM:CMD5(F):CCGAGTACAAGGARGCCTTC和CMD6(R):CCGATRGAGGTCATRACGTGG;PRB2:5Feur(F):GAYGAYCGKGAYCAYTTCGG和7CReur(R):CCCATRGCYTGYTTRCCCAT。PCR擴增體系采用25 μL體系:超純水6.5 μL、正反引物各2.5 μL、PCR Supermix 12.5 μL、待測菌DNA提取液1 μL。擴增程序:95 ℃預變性10 min,95 ℃變性1 min,54 ℃(根據引物選擇合適的退火溫度)退火1 min(或1 min 30 s),72 ℃延伸1 min,35 個循環,72 ℃延伸10 min,12 ℃保溫。
PCR完成后,以1%的瓊脂糖凝膠進行電泳分析,電泳程序:100 V,100 mA,30 min,PCR產物送生工生物工程(上海)有限公司進行測序。將菌株H1的ITS、BenA、PRB2、CaM序列與NCBI資料庫中已有的序列作比對,測序結果使用Clustal W方法對齊,并用MEGA6.0進行聚類分析,以Neighbor-Joining分析方法構建系統發育進化樹,從而確定菌株的親緣關系及分類地位。
1.3.3 菌懸液的制備
將菌株H1接種于PDA培養基上活化,25 ℃培養7 d,用接種環挑取孢子至無菌生理鹽水中,振蕩混勻,用無菌槍頭吸取菌懸液從蓋玻片側邊滴于血球計數板上,吸掉蓋玻片外多余液體,在10×40 倍顯微鏡下觀察計算菌懸液的濃度,調整菌懸液孢子的濃度至1×106個/mL備用。研究環境條件對菌株生長和產毒的影響時吸取1 mL 1×106個/mL的孢子懸浮液至目標液體培養基中,每個實驗做3 個平行3 組重復。
1.3.4 不同培養條件的確定及其菌絲干質量的測定
不同培養基:分別吸取1 mL 1×106個/mL的H1孢子懸浮液至裝有50 mL目標培養基(PDB、YSM和MSG培養基)的250 mL三角瓶中,于25 ℃、130 r/min的恒溫恒濕搖床中培養14 d,其他條件保持一致。結束培養后用紗布過濾,將菌絲球置于60 ℃烘箱中烘干至恒質量,稱量菌絲干質量[24],每個實驗做3 個平行3 組重復,用以檢測培養基對H1生長的影響。
培養溫度:分別選擇4、15、20、25、30、35、40 ℃于130 r/min的恒溫恒濕搖床中培養14 d,其他條件保持一致;pH值:通過添加HCl或NaOH將YSM培養基的pH值分別調節為3.0、5.0、7.0、9.0和11.0,25 ℃、130 r/min的恒溫恒濕搖床中培養14 d,其他條件保持一致;溶氧量也會影響菌株的生長和產毒,將接種后的培養基分別放置于25 ℃培養箱靜置和25 ℃、130 r/min搖床培養14 d,其他條件保持一致;培養時間選擇1~5 周,每周測定1 次。
1.3.5 菌株CIT含量的測定
CIT提取參照Wang Shichao等[25]的方法,略作修改。
菌株H1使用上述不同的培養條件培養2 周后加入2 倍體積的提取液復合萃取劑,于60 ℃、130 r/min水浴搖床中振蕩提取60 min,靜置5 min,將上清液轉入圓底燒瓶中40 ℃旋轉蒸發至干,之后加入1 mL的色譜甲醇復溶,移液槍吸出至1.5 mL的EP管中,1 000 r/min離心10 min。上清液經0.22 μm有機濾膜過濾后,用注射器移入1.5 mL的進樣瓶中,用配備熒光檢測器的高效液相色譜儀檢測。檢測條件:熒光檢測器檢測波長:激發波長331 nm,發射波長500 nm;色譜柱:反相C18柱(250 mm×4.6 mm,5 μm);流動相:乙腈-水(用色譜純磷酸調至pH 2.5)1∶1(V/V);流速:1.0 mL/min;柱溫:28 ℃;進樣量:20 μL。
1.4 數據統計與分析
實驗進行3 次生物學重復,數據以 ±s表示。數據統計學分析采用SPSS 16.0軟件的Student’s t檢驗或One-Way ANOVA的Tukey’s檢驗,P<0.05,差異顯著。
2 結果與分析
2.1 產CIT能力的確認
經高效液相色譜測定可知,菌株H1代謝產物色譜圖(圖1b)中保留時間為8.849 min,和CIT標準品(圖1a)的保留時間8.842 min接近,可能是由于菌株H1代謝產物中雜質較多,影響了保留時間。向H1產物樣品中添加適宜濃度CIT標準品重新進行液相檢測,該峰與CIT標準品峰完全重合,得出8.849 min處的物質為CIT。
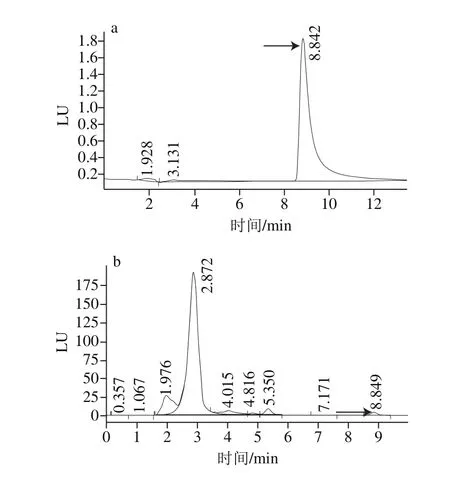
圖1 CIT標準品(a)、菌株H1產物(b)高效液相色譜圖Fig. 1 HPLC chromatograms of CIT standard and sample from strain H1
2.2 產毒菌株形態學鑒定結果
將菌株H1單點分別接種到PDA培養基和柑橘傷口處,25 ℃培養,其生長形態和菌落形態如圖2所示,H1在PDA培養基上生長迅速,培養3 d和7 d菌落直徑分別為20 mm和58 mm左右。菌絲起初為白色,約3 d后顏色逐漸轉暗綠色,7 d左右轉灰綠色,中心部位較突出,有放射狀皺紋,無滲出液,質地絨狀,外緣呈白色,近外緣處有淡黃色滲出物,背面呈肉桂色。H1接種在柑橘上腐爛直徑較大,生長2 d后腐爛直徑約為8.8 mm(傷口直徑3 mm),說明該菌株會引起柑橘腐爛。在10×40 倍顯微鏡下可見分生梗無色,末端處有2 個左右的分枝,分枝上有許多呈放射狀的小梗,分生孢子橢圓形,無色,呈鏈狀。
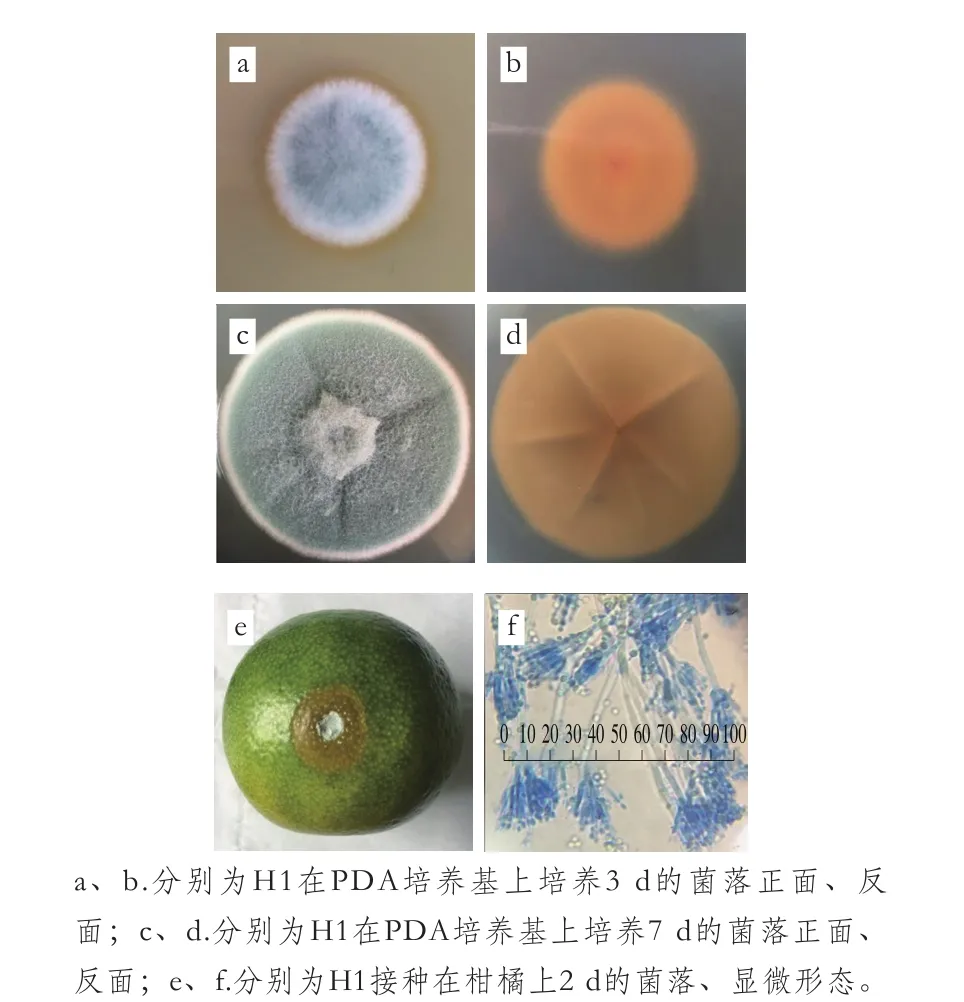
圖2 菌株H1的菌落形態及顯微形態Fig. 2 Colony and microscopic morphology of strain H1
2.3 分子生物學鑒定
菌株H1的ITS、BenA、CaM、PRB2的PCR擴增產物經測序后的長度分別為540、451、519 bp和1 142 bp(圖3),圖4是以Neighbor-Joining分析方法基于ITS、BenA、CaM、PRB2序列構建的系統發育進化樹,結合形態學結果,將菌株H1鑒定為擴展青霉(P. expansum)。

圖3 菌株H1的PCR擴增產物的電泳結果Fig. 3 Electrophoresis of PCR amplification products of genomic DNA from strain H1 on 1% agarose gel
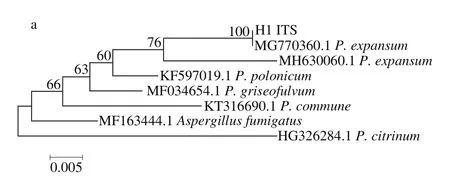
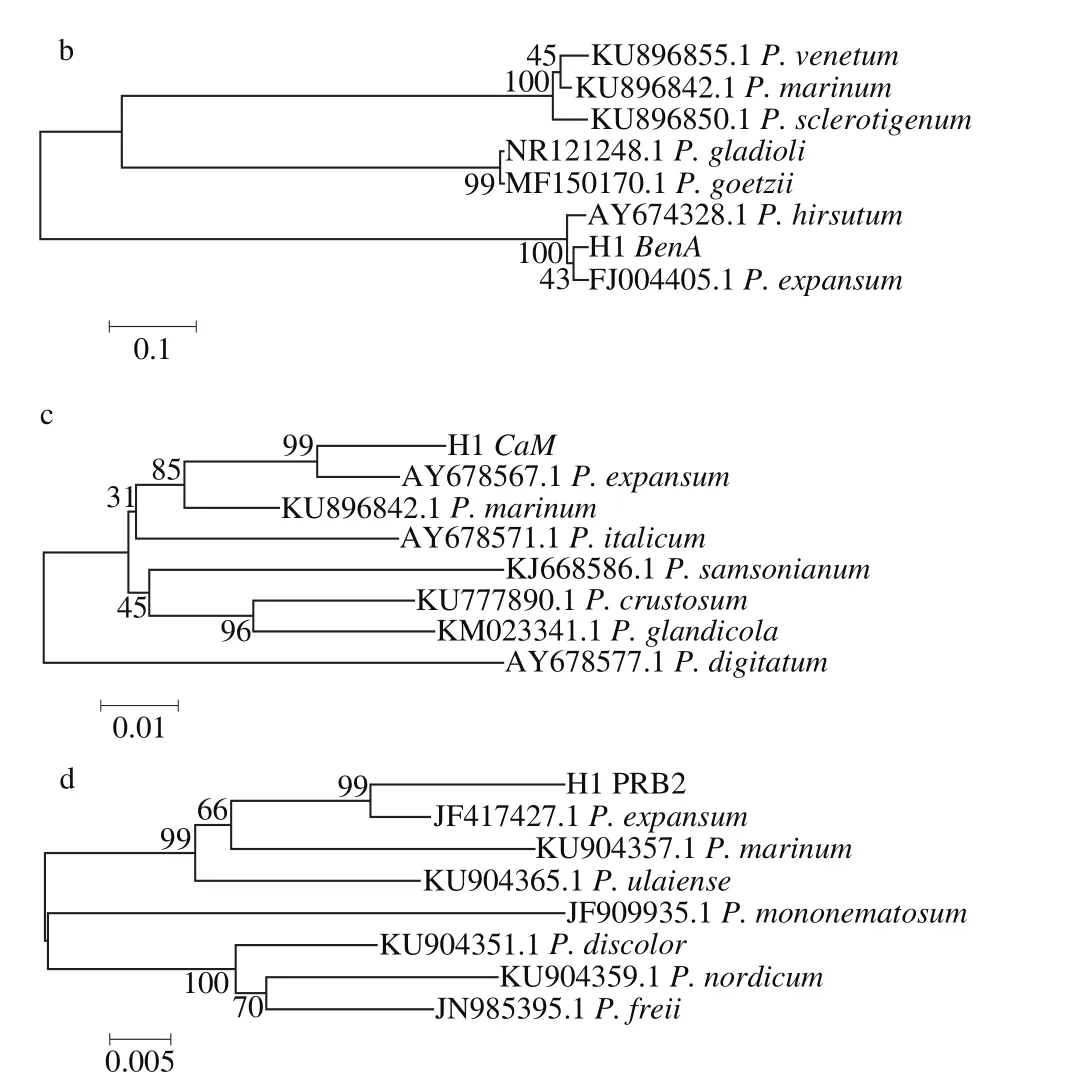
圖4 菌株H1基于ITS(a)、BenA(b)、CaM(c)、PRB2(d)序列的系統發育樹Fig. 4 Phylogenetic tree obtained from Neighbor-Joining analysis of ITS (a),BenA (b), CaM (c), and RPB2 (d) sequences of strain H1
2.4 培養基種類對菌株生長和產毒的影響

圖5 培養基種類對菌株H1生長及產CIT的影響Fig. 5 Effects of different media on mycelial growth and CIT production of strain H1
由圖5可知,菌株H1在3 種培養基上均能生長和產毒,在YSM培養基上生長最旺盛,PDB培養基上生長狀況與MSG培養基上接近。同時,從圖5可以看出,菌株H1在YSM培養基上CIT產量也最高,達到1.2 μg/g以上,而PDB培養基上CIT產量最低,僅為0.3 μg/g。因此后續實驗均選擇YSM培養基用于菌株H1的產毒研究。已有研究發現,產CIT的紅曲霉在有機氮含量豐富的培養基上生長和產毒能力都較高,尤其是在酵母浸膏中[26]。本研究培養菌株H1所用的YSM培養基中酵母浸膏的比例為4%,有機氮含量較為豐富,CIT產量最高,與上述研究結果一致。由于柑橘中氨基酸含量較為豐富,可以為P. expansum侵染柑橘提供較為豐富的氮源,更有利于P. expansum的生長和CIT的產生,所以在柑橘運輸貯藏過程中應盡量減少其機械損傷,從源頭阻止P. expansum侵染果實。
2.5 溫度對菌株生長和產毒的影響
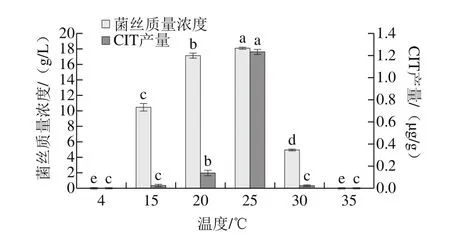
圖6 溫度對菌株H1生長及產CIT的影響Fig. 6 Effects of culture temperature on mycelial growth and CIT production of strain H1
如圖6所示,菌株H1在4 ℃和35 ℃時不生長,也檢測不到CIT。15~25 ℃時,隨著培養溫度的升高,其菌絲質量濃度和產毒量均增加,至25 ℃時達到最大值。以上實驗結果表明溫度對菌株H1生長和產毒影響均較大,4 ℃的低溫和35 ℃的高溫均會抑制該菌株生長和產毒,因此在實驗中可通過低溫或偏高溫度貯藏抑制H1的生長和產毒。
2.6 pH值對菌株生長和產毒的影響
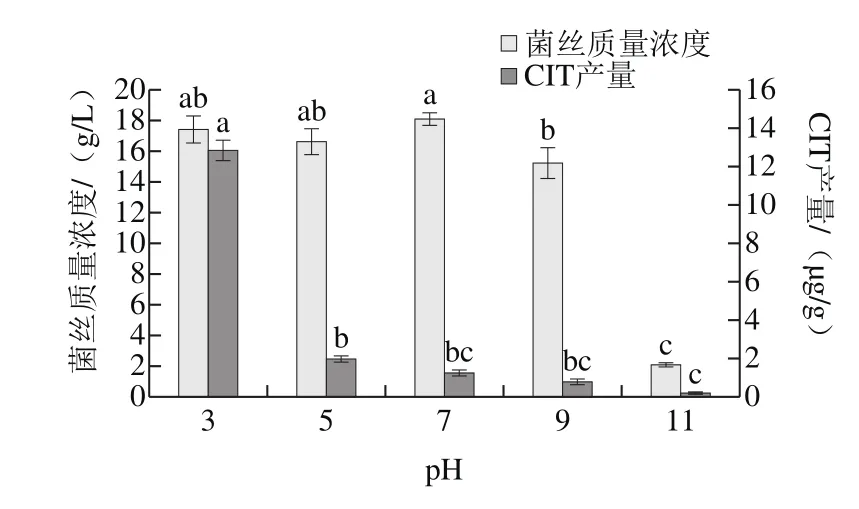
圖7 pH值對菌株H1生長及產CIT的影響Fig. 7 Effects of initial medium pH on mycelial growth and CIT production of strain H1
從圖7可以看出,菌株H1在pH 3.0、5.0、7.0、9.0、11.0的培養基上均可生長,其中菌絲質量濃度最小的為堿性(pH 11)培養條件,為2 g/L左右,pH 3.0~9.0時菌絲質量濃度相當。說明其生長范圍較為廣泛,生存能力較強。同時,培養基的pH值對菌株產CIT的影響呈逐漸遞減的變化趨勢,在培養基pH 3.0時CIT產量最高,達到12.8 μg/g,之后產毒量依次降低,在培養基pH 11.0時,產物中幾乎檢測不到CIT,說明堿性環境能抑制毒素合成,與Sandra等[27]的研究結果一致,這為探究控制毒素方法提供了思路,有必要對其進行深入的研究。而Xiong Xu等[28]的研究發現,降低紅曲發酵液的pH值至3.0以下時可以抑制CIT的產生。這可能是由于菌株H1系從柑橘腐爛傷口處篩選出來的,柑橘果肉偏酸性,宿主環境一定程度上影響了侵染菌株的特性。
2.7 溶氧量對菌株生長和產毒的影響
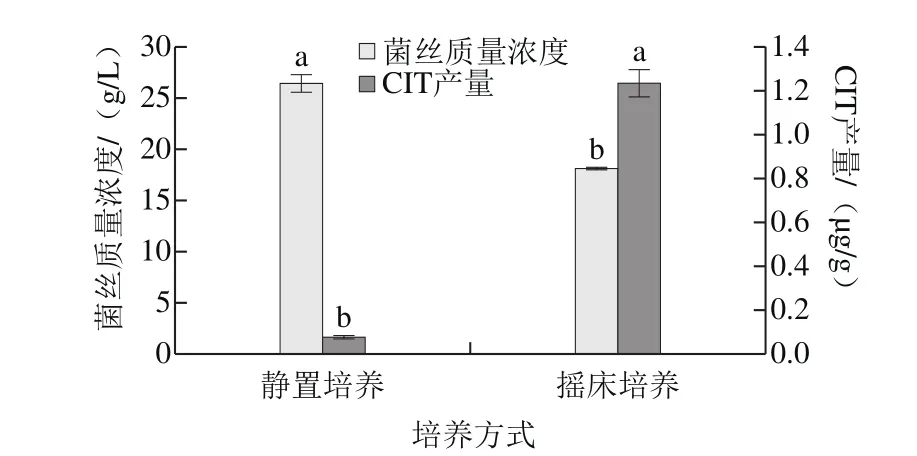
圖8 溶氧量對菌株H1生長及產CIT的影響Fig. 8 Effects of dissolved oxygen on mycelial growth and CIT production of strain H1
由圖8可知,靜置和搖床培養下菌株H1均可生長和產毒,H1在靜置條件下菌絲生物量最高,與王靜[29]的研究結果一致,可能是由于搖床培養下菌株會形成球狀,占據的空間變大,生長受到抑制。但在溶氧量較高的搖床培養下CIT產量達到最大值,是靜置條件下的12.13 倍,Hajjaj等[30]和Pereira[31]的研究也得到相同的結果,說明氧氣對于桔霉素的合成具有促進作用。
2.8 培養時間對菌株生長和產毒的影響
由于柑橘及其制品的儲運期往往比較長,在這期間菌絲生長和毒素產量是動態變化的,通過測定不同時期的培養基中菌絲生物量以及毒素積累量,了解菌株H1的生長狀態和CIT在產毒菌中的代謝變化,有利于深入研究CIT在菌體中的合成與代謝。如圖9所示,菌株H1培養1 周時已經開始產生CIT,第2~5周,隨著時間的延長,CIT產量逐漸減少,第2周時CIT的積累量達到最高,CIT逐漸降低的原因可能是由于后期營養物質消耗殆盡,CIT被分解,參與其他代謝途徑或保護菌體自身安全。不同菌株產生CIT的時間也有所不同,盧錦強等[32]發現紅曲霉培養10 d后,其CIT積累量達到最高。

圖9 培養時間對菌株H1生長及產CIT的影響Fig. 9 Effects of culture time on mycelial growth and CIT production of strain H1
3 結 論
本實驗從柑橘傷口處篩選的菌株H1經形態學和多基因序列分析鑒定為擴展青霉,利用高效液相色譜對其是否產CIT進行驗證,并在體外研究培養基、溫度、pH值、溶氧量和培養時間對H1生長和產CIT能力的影響可知,菌株H1在所選取的幾種培養基上都可以生長和產毒,而YSM培養基最適合菌株生長和產毒;菌株H1的最適生長和產毒溫度為25 ℃,在15~30 ℃之間均能生長和產毒,4 ℃的低溫和35 ℃的高溫均會抑制該菌株生長和產毒;菌株H1適宜生長的培養基pH值范圍較寬,pH值對菌株生長的影響很小,H1的最適生長pH值為7.0,本研究中的菌株H1在培養基pH 3.0時產毒量達到峰值,在堿性環境中隨著pH值升高,產毒量減小,但都處于較低水平;溶氧量對于菌株H1生長無顯著影響,溶氧量較高的搖床培養下H1產毒能力較強,氧氣對CIT的合成具有促進作用;菌株H1在培養的第1周開始產生毒素,第2周時達到最高,之后毒素產量降低。綜上所述,菌株H1在pH 3的YSM培養基中25 ℃搖床培養生長較好,且生長2 周時毒素含量最高。通過實驗表明,H1在低溫下不生長,在非生長適宜溫度環境或堿性環境、溶氧量低等條件下產毒受到抑制。因此在食品加工儲存過程中應當應用這些特點以減少毒素產生,可以從根本上降低食品中CIT的污染。

