美國(guó)藥品專(zhuān)利鏈接制度實(shí)踐情況及其啟示
邱福恩
內(nèi)容提要:美國(guó)于1984年通過(guò)Hatch-Waxman法案在全球首次建立了藥品專(zhuān)利鏈接制度,其中第IV段專(zhuān)利挑戰(zhàn)和30個(gè)月“停擺期”構(gòu)成了這一制度的核心基礎(chǔ)。通過(guò)第IV段挑戰(zhàn),仿制藥企業(yè)可以尋求在專(zhuān)利到期前上市仿制藥。但是,30個(gè)月“停擺期”也會(huì)被專(zhuān)利權(quán)人用于推遲仿制藥競(jìng)爭(zhēng),從而延長(zhǎng)其市場(chǎng)獨(dú)占期。本文對(duì)美國(guó)第IV段專(zhuān)利挑戰(zhàn)及其訴訟相關(guān)實(shí)踐情況進(jìn)行分析,并在此基礎(chǔ)上對(duì)我國(guó)藥品專(zhuān)利鏈接制度的設(shè)計(jì)提出了具體建議。
美國(guó)于1984年通過(guò)Hatch-Waxman法案在全球首次建立了藥品上市審批與專(zhuān)利的鏈接程序,即藥品專(zhuān)利鏈接制度。這一制度的主要內(nèi)容是,當(dāng)申請(qǐng)上市的仿制藥可能侵犯原研藥專(zhuān)利從而存在專(zhuān)利侵權(quán)糾紛,且專(zhuān)利權(quán)人訴至法院的情況下,F(xiàn)DA將中止審批程序一段時(shí)間,直到專(zhuān)利糾紛得以解決或中止期屆滿(mǎn)。美國(guó)專(zhuān)利鏈接制度包括桔皮書(shū)制度、專(zhuān)利聲明和挑戰(zhàn)、審批停擺期以及首仿藥市場(chǎng)獨(dú)占期制度。仿制藥企業(yè)如果想要在專(zhuān)利藥桔皮書(shū)所列專(zhuān)利保護(hù)期限屆滿(mǎn)前上市銷(xiāo)售其產(chǎn)品,必須作出第IV段專(zhuān)利聲明①針對(duì)桔皮書(shū)所列專(zhuān)利,仿制藥申請(qǐng)人需要作出以下四類(lèi)聲明之一。第I段聲明:桔皮書(shū)中沒(méi)有相關(guān)專(zhuān)利;第II段聲明:桔皮書(shū)所列專(zhuān)利保護(hù)期已屆滿(mǎn);第III段聲明:在桔皮書(shū)所列專(zhuān)利保護(hù)期屆滿(mǎn)前仿制藥不會(huì)上市;第IV段聲明:桔皮書(shū)所列的專(zhuān)利無(wú)效、不可實(shí)施或者生產(chǎn)上市仿制藥不會(huì)侵犯專(zhuān)利權(quán)。其中第IV段聲明也稱(chēng)為“專(zhuān)利挑戰(zhàn)”。,對(duì)相關(guān)專(zhuān)利提出挑戰(zhàn)。在仿制藥申請(qǐng)人提出第IV段專(zhuān)利挑戰(zhàn)的情況下,專(zhuān)利權(quán)人可以提起侵權(quán)訴訟,從而獲得最長(zhǎng)可達(dá)30個(gè)月的仿制藥審批“停擺期”。專(zhuān)利挑戰(zhàn)和“停擺期”制度構(gòu)成了美國(guó)藥品專(zhuān)利鏈接制度的核心基礎(chǔ)。
2017年10月,中共中央辦公廳、國(guó)務(wù)院辦公廳印發(fā)《關(guān)于深化審評(píng)審批制度改革鼓勵(lì)藥品醫(yī)療器械創(chuàng)新的意見(jiàn)》(以下簡(jiǎn)稱(chēng)《意見(jiàn)》),其中第十六項(xiàng)明確提出要“探索建立藥品專(zhuān)利鏈接制度”。根據(jù)《意見(jiàn)》,我國(guó)將探索建立的藥品專(zhuān)利鏈接制度在制度框架上與美國(guó)類(lèi)似,深入分析美國(guó)相關(guān)制度實(shí)施情況對(duì)于我國(guó)制度的建設(shè)具有重要意義。
一、桔皮書(shū)中的專(zhuān)利情況
桔皮書(shū)是實(shí)施專(zhuān)利鏈接制度的基礎(chǔ),只有列入桔皮書(shū)中的專(zhuān)利才能適用這一制度。列入桔皮書(shū)的專(zhuān)利情況能夠反映原研藥企業(yè)對(duì)這一制度的利用情況,桔皮書(shū)中登記的專(zhuān)利的量和類(lèi)型變化也反映了藥品專(zhuān)利的發(fā)展情況和趨勢(shì)。
從專(zhuān)利數(shù)量上來(lái)說(shuō),美國(guó)專(zhuān)利鏈接制度實(shí)施幾十年來(lái),每一新藥列入桔皮書(shū)的平均專(zhuān)利數(shù)量逐年增長(zhǎng)。對(duì)美國(guó)FDA于1985-2002年的18年間批準(zhǔn)上市的692個(gè)新藥的專(zhuān)利情況進(jìn)行統(tǒng)計(jì)發(fā)現(xiàn),在專(zhuān)利鏈接制度剛開(kāi)始實(shí)施的1985-1987年間,每一藥物列入桔皮書(shū)中的專(zhuān)利平均為1.9個(gè);而在2000-2002年則達(dá)到3.9個(gè),超過(guò)了1985-1987年間數(shù)量的兩倍。②C. Scott Hemphill and Bhaven N. Sampat,When Do Generics Challenge Drug Patents? Journal of Empirical Legal Studies, Volume 8, Issue 4,613–649, December 2011.
列入桔皮書(shū)中的專(zhuān)利可分為活性成分專(zhuān)利和非活性成分專(zhuān)利兩大類(lèi),非活性成分專(zhuān)利包括藥品使用方法專(zhuān)利和藥物產(chǎn)品專(zhuān)利(包括組合物專(zhuān)利或劑型專(zhuān)利)。統(tǒng)計(jì)發(fā)現(xiàn),桔皮書(shū)中非活性成分專(zhuān)利的比例呈現(xiàn)逐年增長(zhǎng)趨勢(shì)。在美國(guó)FDA1994-1998年間批準(zhǔn)上市的新分子實(shí)體藥物中,每一藥物平均擁有1.81個(gè)非活性成分專(zhuān)利;而在1999-2006年間批準(zhǔn)上市的新分子實(shí)體藥物中,每一藥物擁有的非活性成分專(zhuān)利增長(zhǎng)至2.53個(gè)。③Henry Grabowski, Carlos Brain, Anna Taub, Rahul Guha, Pharmaceutical Patent Challenges, American Journal of Health Economics 3(1):33–59.
從專(zhuān)利數(shù)量對(duì)比情況來(lái)看,美國(guó)桔皮書(shū)所列專(zhuān)利中,非活性成分專(zhuān)利數(shù)量遠(yuǎn)超過(guò)活性成分專(zhuān)利,即使新分子實(shí)體藥物也是如此。對(duì)1994-2006年新批準(zhǔn)上市的214個(gè)新分子實(shí)體藥物進(jìn)行分析發(fā)現(xiàn),在這些藥物中,共有716個(gè)專(zhuān)利列入桔皮書(shū)中,平均每個(gè)新分子實(shí)體藥物擁有3.34個(gè)專(zhuān)利,其中活性成分專(zhuān)利1.13個(gè),非活性成分專(zhuān)利2.21個(gè)。將非活性成分進(jìn)一步分類(lèi)為使用方法專(zhuān)利和藥物產(chǎn)品專(zhuān)利,發(fā)現(xiàn)每個(gè)新分子實(shí)體藥物平均擁有1.34個(gè)使用方法專(zhuān)利和0.87個(gè)藥物產(chǎn)品專(zhuān)利,使用方法專(zhuān)利數(shù)量明顯高于藥物產(chǎn)品專(zhuān)利。④同注釋③。
二、美國(guó)第IV段專(zhuān)利挑戰(zhàn)情況
(一)總體情況及變化趨勢(shì)
美國(guó)自藥品專(zhuān)利鏈接制度實(shí)施以來(lái),專(zhuān)利挑戰(zhàn)數(shù)量總體上呈現(xiàn)上升趨勢(shì)。對(duì)1985-2002年共18年間所批準(zhǔn)的692個(gè)新藥,截至2009年所受到的專(zhuān)利挑戰(zhàn)情況進(jìn)行統(tǒng)計(jì)分析發(fā)現(xiàn),在這些新藥中,有299個(gè)(43.2%)藥物受到了至少一次專(zhuān)利挑戰(zhàn);其中,2000-2002年間批準(zhǔn)上市的新藥中,有55%受到專(zhuān)利挑戰(zhàn);而在1985-1987年間批準(zhǔn)的藥物中,僅有22%受到專(zhuān)利挑戰(zhàn)。針對(duì)非新化學(xué)實(shí)體藥物的專(zhuān)利挑戰(zhàn)比例增長(zhǎng)趨勢(shì)尤為明顯,1985-1987年間批準(zhǔn)的非新化學(xué)實(shí)體藥物中僅有15%受到專(zhuān)利挑戰(zhàn),而在2000-2002年間批準(zhǔn)上市的非新化學(xué)實(shí)體藥物中,這一比例達(dá)到58%。⑤同注釋②。對(duì)美國(guó)1995-2014年間存在首仿藥上市競(jìng)爭(zhēng)的新分子實(shí)體藥物進(jìn)行分析,也得出類(lèi)似結(jié)論。在1995年入市的首仿藥中,僅有9%經(jīng)歷了專(zhuān)利挑戰(zhàn);而到了2014年,這一比例上升至76%。在年銷(xiāo)售額超過(guò)2.5億美元的藥物中,于1995年入市的首仿藥中有25%經(jīng)歷專(zhuān)利挑戰(zhàn),而2014年這一比例上升至94%(見(jiàn)圖1)。⑥Henry Grabowski, Genia Long, Richard Mortimer & Ani Boyo, Updated Trends in US Brand-name and Generic Drug Competition, Journal of Medical Economics, 2016.
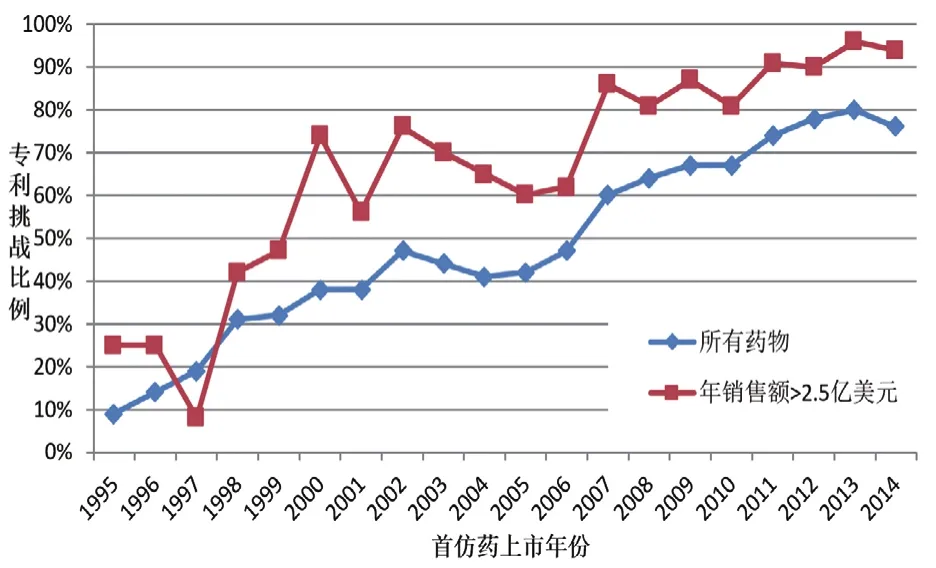
圖11995-2014年間上市的新分子實(shí)體首仿藥專(zhuān)利挑戰(zhàn)的比例
同時(shí),從原研藥上市到發(fā)生首次專(zhuān)利挑戰(zhàn)之間的時(shí)間也逐漸縮短。首仿藥于1995年入市的藥物中,從原研藥上市到出現(xiàn)首個(gè)第IV段專(zhuān)利挑戰(zhàn)的平均時(shí)間為18.7年,而在首仿藥于2014年上市的藥物中,這一時(shí)間降至5.9年。而且,年銷(xiāo)售額越高的藥物,出現(xiàn)首次專(zhuān)利挑戰(zhàn)的時(shí)間越早。首仿藥于1995年入市的年銷(xiāo)售額超過(guò)2.5億美元的藥物中,從原研藥上市到出現(xiàn)首個(gè)第IV段專(zhuān)利挑戰(zhàn)的平均時(shí)間為14.3年,而2014年則降至5.2年(見(jiàn)圖2)。⑦同注釋⑥。
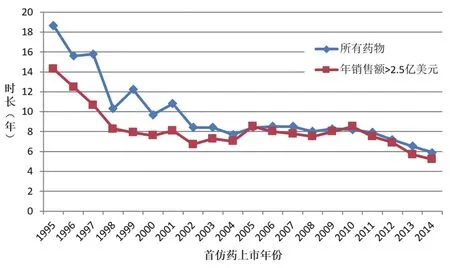
圖2 從原研藥上市到出現(xiàn)專(zhuān)利挑戰(zhàn)的時(shí)間
(二)影響專(zhuān)利挑戰(zhàn)情況的主要因素
分析發(fā)現(xiàn),原研藥受到專(zhuān)利挑戰(zhàn)的比例與年銷(xiāo)售額、專(zhuān)利保護(hù)期時(shí)長(zhǎng)及其桔皮書(shū)所列專(zhuān)利類(lèi)型等因素相關(guān)。
首先,原研藥受到專(zhuān)利挑戰(zhàn)的比例與其市場(chǎng)銷(xiāo)售額呈正相關(guān)。統(tǒng)計(jì)發(fā)現(xiàn),在首仿藥于1995-2014年入市的新分子實(shí)體藥物中,年銷(xiāo)售額超過(guò)2.5億美元的藥物受到專(zhuān)利挑戰(zhàn)的比例均明顯高于其他藥物,從原研藥上市到受到專(zhuān)利挑戰(zhàn)之間的時(shí)間間隔也比其他藥物更短。⑧同注釋⑥。C. Scott Hemphill等⑨C. Scott Hemphill, Bhaven N. Sampat,Evergreening, patent challenges, and effective market life in pharmaceuticals,Journal of Health Economics 31 (2012) 327– 339.對(duì)2001-2010年首次面臨仿制藥競(jìng)爭(zhēng)的119個(gè)新分子實(shí)體藥物年銷(xiāo)售額進(jìn)行分組分析,發(fā)現(xiàn)年銷(xiāo)售額為前20%的藥物有96%受到了專(zhuān)利挑戰(zhàn),而年銷(xiāo)售額為后20%的藥物僅有29%受到專(zhuān)利挑戰(zhàn)。此外,C. Scott Hemphill等⑩同注釋②。還發(fā)現(xiàn),原研藥年銷(xiāo)售額每升高10億美元,面臨專(zhuān)利挑戰(zhàn)的風(fēng)險(xiǎn)將增加10%。
其次,原研藥受到專(zhuān)利挑戰(zhàn)的比例與其上市后專(zhuān)利有效保護(hù)期(桔皮書(shū)中所列全部專(zhuān)利所提供的最長(zhǎng)保護(hù)期)呈正相關(guān)關(guān)系,有效保護(hù)期越長(zhǎng),受到專(zhuān)利挑戰(zhàn)的可能性越大。
從專(zhuān)利類(lèi)型來(lái)看,非活性成分專(zhuān)利受到專(zhuān)利挑戰(zhàn)的比例明顯高于活性成分專(zhuān)利。對(duì)2001-2010年面臨首仿藥競(jìng)爭(zhēng)的新分子實(shí)體藥物進(jìn)行分析發(fā)現(xiàn),約75%的非活性成分專(zhuān)利受到挑戰(zhàn),但僅有29%的活性成分專(zhuān)利受到挑戰(zhàn)(見(jiàn)表1)。?同注釋⑨。尤其是當(dāng)活性成分專(zhuān)利到期后,非活性成分專(zhuān)利提供“額外”保護(hù)的時(shí)間越長(zhǎng),受到專(zhuān)利挑戰(zhàn)的比例也越高。實(shí)際上,這也是專(zhuān)利挑戰(zhàn)比例與藥品上市后專(zhuān)利有效保護(hù)期呈正相關(guān)的主要原因之一。
對(duì)桔皮書(shū)所列專(zhuān)利類(lèi)型進(jìn)行統(tǒng)計(jì)發(fā)現(xiàn),美國(guó)專(zhuān)利鏈接制度實(shí)施幾十年來(lái),越來(lái)越多的原研藥企業(yè)將非活性成分專(zhuān)利列入桔皮書(shū)中,試圖通過(guò)這一方式延長(zhǎng)原研藥的專(zhuān)利保護(hù)期限。而對(duì)專(zhuān)利挑戰(zhàn)的統(tǒng)計(jì)結(jié)果也表明,大多數(shù)專(zhuān)利挑戰(zhàn)針對(duì)的是非活性成分專(zhuān)利,這也是仿制藥企業(yè)對(duì)原研藥企業(yè)利用非活性成分專(zhuān)利延長(zhǎng)藥品市場(chǎng)獨(dú)占期的應(yīng)對(duì)措施。這說(shuō)明,專(zhuān)利鏈接制度實(shí)踐過(guò)程中,原研藥企業(yè)和仿制藥企業(yè)的“攻防”重點(diǎn)逐漸轉(zhuǎn)向了藥品使用方法、劑型和組合物等“改進(jìn)型”專(zhuān)利,而非活性成分專(zhuān)利。
三、針對(duì)專(zhuān)利挑戰(zhàn)的訴訟情況
(一)總體情況及變化趨勢(shì)
在美國(guó)專(zhuān)利鏈接制度中,仿制藥申請(qǐng)人提出第IV段專(zhuān)利挑戰(zhàn)聲明后,專(zhuān)利權(quán)人可以在一定期間內(nèi)提起專(zhuān)利侵權(quán)訴訟。當(dāng)然,專(zhuān)利權(quán)人也可以選擇不提起訴訟,此時(shí)仿制藥申請(qǐng)可以在滿(mǎn)足其他條件的情況下直接獲得批準(zhǔn)上市。在美國(guó)FTC統(tǒng)計(jì)的1992-2001年10年間104個(gè)面臨第IV段專(zhuān)利挑戰(zhàn)的新藥中,有29個(gè)未提起訴訟,超過(guò)專(zhuān)利挑戰(zhàn)的四分之一。?Federal Trade Commission, 2002. Generic Drug Entry prior to Patent Expiration: An FTC Study. US Government Printing Office, Washington,DC, July.
美國(guó)專(zhuān)利鏈接制度實(shí)施幾十年以來(lái),隨著第IV段專(zhuān)利挑戰(zhàn)數(shù)量的增加,因此而引發(fā)的訴訟數(shù)量也隨之增加。據(jù)統(tǒng)計(jì),1992-2001年10年間,美國(guó)共有75件針對(duì)首個(gè)第IV段專(zhuān)利聲明提起的專(zhuān)利訴訟,每年平均僅有7.5件;?同注釋?。而在2003年至2009年7年間就有238件此類(lèi)訴訟,每年平均達(dá)34件,且每年的訴訟量逐年上升。?RBC Capital Markets Corp. Analyzing Litigation Success Rates,January 15, 2010.
(二)第IV段挑戰(zhàn)成功率
對(duì)于需要在專(zhuān)利挑戰(zhàn)中付出較高成本的仿制藥企業(yè)來(lái)說(shuō),第IV段專(zhuān)利挑戰(zhàn)成功率是影響其是否提起專(zhuān)利挑戰(zhàn)的重要因素。盡管美國(guó)專(zhuān)利鏈接制度實(shí)施幾十年來(lái),無(wú)論是專(zhuān)利制度本身還是專(zhuān)利鏈接制度,均經(jīng)歷了多次變革,但第IV段專(zhuān)利挑戰(zhàn)的成功率一直保持著較高的水平。在FTC分析的1992-2001年10年間的50件有確定訴訟結(jié)論的第IV段專(zhuān)利挑戰(zhàn)訴訟中,20件訴訟通過(guò)和解結(jié)案,在剩下的30件通過(guò)法院判決結(jié)案的案件中,仿制藥企業(yè)勝訴22件,勝訴率高達(dá)73%。?同注釋?。如果算上和解結(jié)案的案件,在這50件訴訟中,仿制藥申請(qǐng)人在42件中成功地挑戰(zhàn)了原研藥專(zhuān)利,成功率高達(dá)84%。而且,在FTC所統(tǒng)計(jì)的包含第IV段專(zhuān)利挑戰(zhàn)的仿制藥申請(qǐng)中,還有超過(guò)四分之一的專(zhuān)利權(quán)人未提起專(zhuān)利訴訟。因此,仿制藥申請(qǐng)人第IV段專(zhuān)利挑戰(zhàn)總成功率實(shí)際上超過(guò)84%。
RBC Capital Markets Corp.對(duì)2000-2009年370件專(zhuān)利挑戰(zhàn)案件結(jié)果進(jìn)行分析,計(jì)算第IV段專(zhuān)利挑戰(zhàn)成功率。在這370件案件中,共有171件通過(guò)司法判決結(jié)案,占案件總量的46%; 175件(47%)當(dāng)事人達(dá)成和解;剩下的25件(7%)專(zhuān)利權(quán)人放棄訴訟。通過(guò)美國(guó)法院判決結(jié)案的171件案件中,專(zhuān)利權(quán)人勝訴89件,仿制藥申請(qǐng)人勝訴82件,雙方勝訴比例基本相當(dāng)。?同注釋?。在專(zhuān)利鏈接制度中,無(wú)論是法院經(jīng)審理后判決仿制藥申請(qǐng)人勝訴,還是專(zhuān)利權(quán)人放棄訴訟或同意和解,都可認(rèn)為是仿制藥申請(qǐng)人挑戰(zhàn)專(zhuān)利成功。以此標(biāo)準(zhǔn)計(jì)算,2000年至2009年,仿制藥申請(qǐng)人第IV段專(zhuān)利挑戰(zhàn)的成功率高達(dá)76%。
(三)針對(duì)不同類(lèi)型專(zhuān)利的第IV段挑戰(zhàn)成功率情況
列入原研藥桔皮書(shū)中的專(zhuān)利包括化合物、藥品使用方法和藥物產(chǎn)品(包括組合物和劑型)專(zhuān)利。從理論上來(lái)說(shuō),活性成分化合物專(zhuān)利最難以挑戰(zhàn)成功。這是因?yàn)椋暾?qǐng)上市仿制藥應(yīng)當(dāng)與原研藥具有相同的活性成分,否則不符合生物等效性要求。這就決定了生產(chǎn)和銷(xiāo)售仿制藥在絕大多數(shù)情況下會(huì)侵犯涵蓋原研藥活性成分的專(zhuān)利權(quán)。為對(duì)活性成分專(zhuān)利提起第IV段專(zhuān)利挑戰(zhàn),大多數(shù)情況下只能挑戰(zhàn)相關(guān)專(zhuān)利的有效性,而不是挑戰(zhàn)專(zhuān)利權(quán)的保護(hù)范圍。相對(duì)而言,藥物劑型和組合物等產(chǎn)品專(zhuān)利則更容易被挑戰(zhàn)。因?yàn)閷?duì)于這些專(zhuān)利,不僅可以挑戰(zhàn)其有效性,還可以通過(guò)適當(dāng)?shù)姆绞健袄@開(kāi)”專(zhuān)利保護(hù)范圍。例如,如果桔皮書(shū)中所列專(zhuān)利是特定的藥物緩釋劑型,仿制藥申請(qǐng)人可以采取不同于原研藥的其他緩釋機(jī)制來(lái)達(dá)到與原研藥相同的緩釋效果,從而提出不侵犯專(zhuān)利權(quán)的第IV段聲明,而且往往能夠獲得成功。?同注釋②。同樣地,化合物晶型、化合物特定的鹽和藥物使用方法等專(zhuān)利相對(duì)于活性成分專(zhuān)利而言也更易于被挑戰(zhàn)。
這一結(jié)論也在有關(guān)統(tǒng)計(jì)分析中得到了印證。Henry Grabowski等統(tǒng)計(jì)了1994-2006年新批準(zhǔn)上市的214個(gè)新分子實(shí)體藥物中,銷(xiāo)量排在前20%的43個(gè)藥物的專(zhuān)利挑戰(zhàn)相關(guān)訴訟情況(結(jié)果如圖3所示)。?同注釋③。在挑戰(zhàn)活性成分專(zhuān)利的訴訟中,原研藥企業(yè)在55%的案件勝訴,42%以和解結(jié)案,另有3%為仿制藥申請(qǐng)人勝訴。在挑戰(zhàn)使用方法專(zhuān)利的訴訟中,原研藥企業(yè)僅在19%的案件中勝訴,34%的案件為仿制藥申請(qǐng)人勝訴,此外還有47%的案件和解結(jié)案。而對(duì)于劑型和組合物藥物產(chǎn)品專(zhuān)利,原研藥企業(yè)僅在3%的案件中勝訴,仿制藥企業(yè)贏得71%的案件,還有26%和解結(jié)案。如果將和解結(jié)案也統(tǒng)計(jì)為專(zhuān)利挑戰(zhàn)成功的案件,則活性成分專(zhuān)利、使用方法專(zhuān)利和藥物產(chǎn)品專(zhuān)利第IV段專(zhuān)利挑戰(zhàn)訴訟中,仿制藥申請(qǐng)人的挑戰(zhàn)成功率分別為45%、81%和97%。
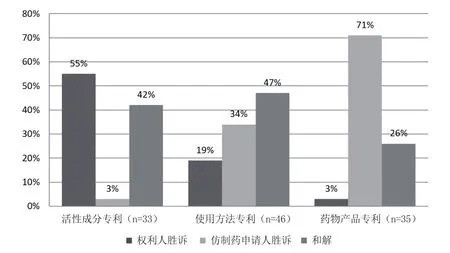
圖3 不同專(zhuān)利類(lèi)型的訴訟結(jié)果
四、美國(guó)專(zhuān)利鏈接制度實(shí)踐中存在的主要問(wèn)題
(一)圍繞非活性成分專(zhuān)利的訴訟不當(dāng)?shù)匮娱L(zhǎng)了原研藥市場(chǎng)獨(dú)占期
仿制藥企業(yè)所提的專(zhuān)利挑戰(zhàn)中,大多數(shù)針對(duì)的是非活性成分專(zhuān)利。極高的專(zhuān)利挑戰(zhàn)成功率激勵(lì)更多的仿制藥企業(yè)對(duì)非活性成分專(zhuān)利提出專(zhuān)利挑戰(zhàn)。而從原研藥企業(yè)角度而言,非活性成分專(zhuān)利極高的挑戰(zhàn)成功率又“迫使”其在桔皮書(shū)登記更多的專(zhuān)利,從而通過(guò)數(shù)量的優(yōu)勢(shì)來(lái)彌補(bǔ)非活性成分專(zhuān)利在保護(hù)效果上的不足。桔皮書(shū)中更多的非活性成分專(zhuān)利又必然會(huì)導(dǎo)致更多的針對(duì)非活性成分專(zhuān)利的挑戰(zhàn)。這樣就形成了一個(gè)“怪圈”,使得雙方都需要付出更多的精力和資源來(lái)維護(hù)或挑戰(zhàn)改進(jìn)型的非活性成分專(zhuān)利。
形成這一“怪圈”的根源主要在于美國(guó)專(zhuān)利鏈接制度中的“停擺期”制度設(shè)計(jì)。根據(jù)這一制度設(shè)計(jì),對(duì)于列入桔皮書(shū)中的專(zhuān)利,如果仿制藥申請(qǐng)人提出了第IV段專(zhuān)利聲明,則只要專(zhuān)利權(quán)人在法定期限內(nèi)提起專(zhuān)利侵權(quán)訴訟,即可以自動(dòng)獲得最長(zhǎng)達(dá)30個(gè)月的仿制藥審批“停擺期”。根據(jù)FTC2002年統(tǒng)計(jì),第IV段專(zhuān)利挑戰(zhàn)相關(guān)專(zhuān)利訴訟的審理時(shí)間平均約為25個(gè)月。也就是說(shuō),即使專(zhuān)利權(quán)人在侵權(quán)訴訟中敗訴,在這一期間其仍然能保持其市場(chǎng)獨(dú)占地位,從而獲得遠(yuǎn)高于其訴訟成本的高額利潤(rùn)。這也就使得,即便針對(duì)藥物使用方法專(zhuān)利和藥物產(chǎn)品專(zhuān)利的挑戰(zhàn)成功率高達(dá)81%和97%,原研藥企業(yè)仍然有足夠的動(dòng)機(jī)將這些專(zhuān)利列入桔皮書(shū)中,并提起專(zhuān)利鏈接制度下的侵權(quán)訴訟。
(二)不能完全解決藥品專(zhuān)利侵權(quán)糾紛
藥品專(zhuān)利鏈接制度的一個(gè)重要目的是在藥品上市審批過(guò)程中解決可能存在的相關(guān)專(zhuān)利侵權(quán)糾紛,但至少?gòu)囊韵聝蓚€(gè)方面的專(zhuān)利挑戰(zhàn)相關(guān)訴訟情況來(lái)看,這一立法目標(biāo)并沒(méi)有完全實(shí)現(xiàn)。
首先,從當(dāng)事人上訴后美國(guó)二審法院判決情況看,一審作出的不侵權(quán)判決中有較大概率被美國(guó)二審法院推翻。2003年修改制度后,美國(guó)藥品專(zhuān)利鏈接制度明確,在地區(qū)法院作出不侵犯專(zhuān)利權(quán)的判決后,F(xiàn)DA即可以批準(zhǔn)仿制藥上市。但專(zhuān)利權(quán)人對(duì)此判決不服的,可以提出上訴。這樣面臨的問(wèn)題是,如果二審?fù)品艘粚徟袥Q,則仿制藥申請(qǐng)人已經(jīng)上市銷(xiāo)售的藥品將面臨侵犯原研藥專(zhuān)利權(quán)的尷尬處境。也就是說(shuō),即便是通過(guò)專(zhuān)利鏈接程序獲批上市的仿制藥,也仍然面臨一定的侵權(quán)風(fēng)險(xiǎn)。Laura E.Panattoni在1984-2007年間地區(qū)法院作出的第IV段專(zhuān)利挑戰(zhàn)侵權(quán)判決中選擇了37件作為樣本,分析這些案件的上訴情況。?Laura E. Panattoni, The Effect of Paragraph IV Decisions and Generic Entry Before Patent Expiration on Brand Pharmaceutical Firms, Journal of Health Economics 30 (2011) 126–145.在這37件案件中,有20件(54.1%)一審判決仿制藥申請(qǐng)人勝訴。一審判決作出后,共有31件案件當(dāng)事人選擇上訴,而其中僅有12件案件的一審判決在上訴法院中得以維持,剩余19件判決被上訴法院推翻或發(fā)回重審。尤其值得關(guān)注的是,在20件一審判決仿制藥申請(qǐng)人勝訴的案件中,共有16件提起了上訴,而其中僅有6件得到了二審法院的支持(見(jiàn)表2)。也就是說(shuō),在20件一審判決仿制藥申請(qǐng)人勝訴的案件中,有一半(10件)被二審判決推翻或發(fā)回重審。在未得到二審法院維持的10個(gè)訴訟案件中,至少有5個(gè)案件中的仿制藥申請(qǐng)人在二審判決作出前即已開(kāi)始上市銷(xiāo)售仿制藥。對(duì)于這些仿制藥申請(qǐng)人而言,雖然其根據(jù)專(zhuān)利鏈接制度的要求提出了專(zhuān)利挑戰(zhàn),并經(jīng)歷了較長(zhǎng)時(shí)間的“停擺期”后才得以上市,但其上市后仍然需要承擔(dān)侵權(quán)責(zé)任。
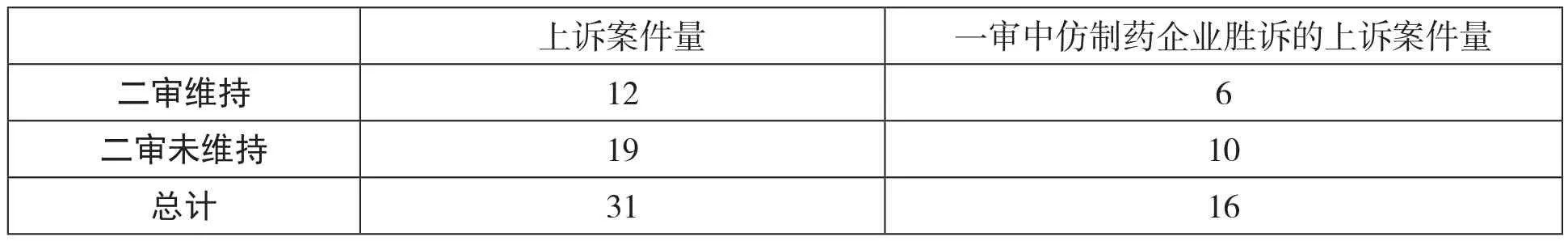
表2 第IV段專(zhuān)利挑戰(zhàn)相關(guān)專(zhuān)利侵權(quán)訴訟上訴情況
其次,如果30個(gè)月停擺期屆滿(mǎn),法院仍未作出有利于仿制藥申請(qǐng)人的判決,F(xiàn)DA也會(huì)批準(zhǔn)仿制藥上市。但如果最后法院判決仿制藥侵權(quán)成立,則仿制藥企業(yè)在獲得FDA批準(zhǔn)后生產(chǎn)銷(xiāo)售仿制藥的行為仍然構(gòu)成侵權(quán),需要承擔(dān)相應(yīng)的侵權(quán)責(zé)任,甚至承擔(dān)最高達(dá)3倍的懲罰性賠償責(zé)任。統(tǒng)計(jì)發(fā)現(xiàn),在2003-2009年間,共有28例仿制藥在法院作出判決之前上市,占同期首次第IV段專(zhuān)利挑戰(zhàn)訴訟(238件)的11.7%。?同注釋?。
(三)“反向支付和解”協(xié)議可能損害患者利益
從統(tǒng)計(jì)數(shù)據(jù)來(lái)看,專(zhuān)利鏈接制度中侵權(quán)訴訟的另一特點(diǎn)是,有很大一部分訴訟通過(guò)和解結(jié)案。美國(guó)FTC在對(duì)這些和解協(xié)議進(jìn)行分析后,認(rèn)為大多數(shù)協(xié)議可以歸類(lèi)為以下三類(lèi):一是原研藥企業(yè)支付給仿制藥申請(qǐng)人一定費(fèi)用,換取仿制藥申請(qǐng)人推遲仿制藥上市時(shí)間;二是原研藥企業(yè)許可仿制藥申請(qǐng)人實(shí)施其專(zhuān)利,從而在該專(zhuān)利到期前上市其仿制藥;三是允許仿制藥申請(qǐng)人上市銷(xiāo)售原研藥,而非仿制藥企業(yè)自己生產(chǎn)的仿制藥。?同注釋?。然而,無(wú)論雙方當(dāng)事人達(dá)成何種類(lèi)型的協(xié)議,其基礎(chǔ)均是原研藥企業(yè)認(rèn)為其存在一定敗訴風(fēng)險(xiǎn),而且這種敗訴風(fēng)險(xiǎn)將使其承擔(dān)極大的商業(yè)風(fēng)險(xiǎn)。因?yàn)橹挥性谶@種情況下,占據(jù)市場(chǎng)絕對(duì)優(yōu)勢(shì)地位的原研藥企業(yè)才有可能同意和解,允許仿制藥企業(yè)與其分享市場(chǎng)收益。實(shí)際上,這也是第IV段專(zhuān)利挑戰(zhàn)相關(guān)訴訟和解與其他專(zhuān)利訴訟和解之間的最大區(qū)別所在。在其他專(zhuān)利訴訟和解中,往往是侵權(quán)訴訟被告面臨敗訴風(fēng)險(xiǎn)的情況,才會(huì)同意支付和解金或使用費(fèi)。正是由于這一原因,第IV段挑戰(zhàn)訴訟相關(guān)的和解也被稱(chēng)為“反向支付和解”。
反向支付和解協(xié)議雖然能使原研藥企業(yè)和首仿藥申請(qǐng)人實(shí)現(xiàn)利益的最大化,但卻損害了消費(fèi)者利益。首仿藥上市時(shí)間的推遲將對(duì)仿制藥市場(chǎng)競(jìng)爭(zhēng)造成損害,也給藥物可及性帶來(lái)不利影響。為對(duì)反向支付和解行為進(jìn)行規(guī)制,美國(guó)不僅對(duì)專(zhuān)利鏈接制度本身進(jìn)行了修改,而且還通過(guò)反壟斷審查機(jī)制對(duì)有關(guān)和解協(xié)議進(jìn)行審查。
五、對(duì)我國(guó)藥品專(zhuān)利制度的啟示和建議
(一)合理設(shè)置“停擺期”條件
美國(guó)藥品專(zhuān)利鏈接制度實(shí)踐中,仿制藥企業(yè)和專(zhuān)利權(quán)人圍繞非活性成分專(zhuān)利所展開(kāi)的專(zhuān)利挑戰(zhàn)和訴訟,其背后實(shí)質(zhì)上存在專(zhuān)利權(quán)人對(duì)“停擺期”制度的濫用:原研藥企業(yè)通過(guò)針對(duì)非活性成分專(zhuān)利提起訴訟,利用停擺期制度不當(dāng)?shù)孬@得額外的市場(chǎng)獨(dú)占期,從而攫取高額的額外利潤(rùn)。推遲仿制藥上市,意味著這些原研藥企業(yè)可多獲得更多的利潤(rùn)。而即使原研藥企業(yè)在侵權(quán)訴訟中最終敗訴,也無(wú)需承擔(dān)任何賠償責(zé)任。因此,原研藥企業(yè)通過(guò)提起侵權(quán)訴訟從而推遲仿制藥上市,僅需要付出一定的訴訟成本即可,而無(wú)需承擔(dān)額外的敗訴風(fēng)險(xiǎn)。只要這一訴訟成本低于其因提起訴訟可能獲得的額外利潤(rùn),無(wú)論能否最終勝訴,原研藥企業(yè)都會(huì)有足夠的動(dòng)機(jī)提起訴訟從而獲得停擺期。這也是原研藥企業(yè)將大量非活性成分專(zhuān)利列入桔皮書(shū)中,并在仿制藥企業(yè)提出專(zhuān)利挑戰(zhàn)后提起訴訟的根本原因。
為在我國(guó)將來(lái)的專(zhuān)利鏈接制度實(shí)踐中避免這一情形的出現(xiàn),更好地平衡原研藥企業(yè)、仿制藥企業(yè)與患者之間的利益,需要更加合理地設(shè)置專(zhuān)利挑戰(zhàn)之后的“停擺期”條件。原研藥企業(yè)濫用“停擺期”的根本原因在于風(fēng)險(xiǎn)與收益的不對(duì)等性,避免制度濫用的根本在于更好地平衡原研藥企業(yè)的風(fēng)險(xiǎn)和收益。為此,例如可以仿照臨時(shí)禁令制度,對(duì)“停擺期”制度設(shè)置更高的適用門(mén)檻,并在專(zhuān)利權(quán)人敗訴后對(duì)仿制藥企業(yè)可能遭受的損失承擔(dān)賠償責(zé)任。通過(guò)這種方式,既能使原研藥企業(yè)及時(shí)阻止涉嫌侵權(quán)的仿制藥進(jìn)入市場(chǎng),又能有效避免制度的濫用。
(二)合理設(shè)置“停擺期”時(shí)長(zhǎng)
藥品專(zhuān)利鏈接制度的目的是在仿制藥上市前解決潛在的專(zhuān)利侵權(quán)糾紛,而“停擺期”的意義在于為糾紛的解決提供必要的時(shí)間。其中,“停擺期”時(shí)長(zhǎng)設(shè)置是制度的關(guān)鍵,時(shí)間過(guò)短難以解決存在的專(zhuān)利糾紛;而時(shí)間過(guò)長(zhǎng),則又可能不當(dāng)?shù)匮舆t仿制藥上市時(shí)間。從實(shí)踐情況來(lái)看,美國(guó)長(zhǎng)達(dá)30個(gè)月的“停擺期”,也不能完全解決專(zhuān)利侵權(quán)糾紛。而事實(shí)上,即便設(shè)置更長(zhǎng)時(shí)間的“停擺期”,也不可能徹底地解決所有糾紛。因此,在設(shè)計(jì)“停擺期”時(shí),不應(yīng)當(dāng)不切實(shí)際地追求在此期間使所有糾紛獲得終局結(jié)論,而是需要在公平與效率之間取得合理的平衡。
具體而言,設(shè)置“停擺期”時(shí),需要綜合考慮勝訴率、二審改判率和專(zhuān)利權(quán)人責(zé)任承擔(dān)情況等因素,甚至可以針對(duì)不同情形設(shè)置不同的時(shí)長(zhǎng)。例如,對(duì)于專(zhuān)利權(quán)人勝訴率較高的活性成分專(zhuān)利,可以設(shè)置更長(zhǎng)的“停擺期”;同樣地,在原研藥企業(yè)提供足夠擔(dān)保的情況下,也可以由法院裁定更長(zhǎng)的“停擺期”。
(三)對(duì)“反向支付和解”等進(jìn)行預(yù)先規(guī)制
“反向支付和解”是原研藥企業(yè)濫用專(zhuān)利鏈接制度的一種形式,其本質(zhì)是原研藥企業(yè)和仿制藥企業(yè)以協(xié)議的形式共同分享推遲仿制藥上市時(shí)間所帶來(lái)的壟斷利益,將對(duì)仿制藥市場(chǎng)競(jìng)爭(zhēng)造成損害,也給藥物可及性帶來(lái)不利影響。為對(duì)反向支付和解行為進(jìn)行規(guī)制,美國(guó)規(guī)定了有關(guān)和解協(xié)議需要提交反壟斷審查機(jī)構(gòu)進(jìn)行審查。
在我國(guó)將來(lái)的藥品專(zhuān)利鏈接制度實(shí)踐中,可以預(yù)見(jiàn)也同樣會(huì)出現(xiàn)“反向支付和解”的可能,對(duì)此需要提前在制度設(shè)計(jì)中加以規(guī)制。一方面,可以通過(guò)專(zhuān)利挑戰(zhàn)和仿制藥市場(chǎng)獨(dú)占期等具體規(guī)制的設(shè)計(jì),降低當(dāng)事人通過(guò)達(dá)成“反向支付和解”協(xié)議的獲利空間;另一方面,可以借鑒美國(guó)經(jīng)驗(yàn),通過(guò)反壟斷制度來(lái)對(duì)相關(guān)協(xié)議審查并對(duì)涉嫌壟斷的行為予以規(guī)制。

