葒草花有效組分在人腸道菌群中體外代謝特征分析
陳 浩,王昌權,夏 濤,李月婷,王永林,黃 勇,李勇軍,鄭 林*
1貴州醫科大學貴州省藥物制劑重點實驗室/ 藥用植物功效與利用國家重點實驗室; 2貴州醫科大學民族藥與中藥開發應用教育部工程研究中心;3 貴州醫科大學藥學院,貴陽 550004
葒草花為蓼科葒草PolygonumorientaleL.的花序,又名水葒花、狗尾巴花等,在貴州分布廣泛。具有行氣活血、消積、止痛的功效,用于胸痛、胸悶、氣短、中風偏癱、風濕疼痛等疾病的治療[1]。課題組前期研究對葒草各部位藥理篩選實驗中發現,葒草花比其“全草”有更為明顯的抗心肌缺血作用,為葒草的主要藥用有效部位,并從有效組分中分離并鑒定了13個代表成分(沒食子酸、原兒茶酸、兒茶素、表兒茶素、槲皮素-3-O-( 2″-O-α-L-鼠李糖基)-β-D-葡萄糖醛酸苷、山柰酚-3-O-( 2″-O-α-L-鼠李糖基)-β-D-葡萄糖醛酸苷、山柰素-3-O-β-D-葡萄糖苷、槲皮苷、山柰素-3-O-α-L-鼠李糖苷、N-p-香豆酰酪胺、N-trans-對羥基苯乙基阿魏酰胺、槲皮素、山柰酚)[2,3]。研究表明,其吸收進入體內后,絕對生物利用度較低[4],但其抗心肌缺血療效確切,原因可能為葒草花在體內發揮藥效的形式除了原型成分外,其在體內的代謝產物也可能為活性成分,而腸道菌群的代謝作用不容忽視,但有關葒草花有效組分在腸道菌群中的代謝研究尚未見報道。人腸道菌群種類繁多,不同種類的菌群產生不同的代謝酶,從而能對有效組分中的不同成分進行特定轉化,且腸道菌群影響著許多中藥有效成分的代謝轉化與機體的吸收利用。而中藥的有效成分經腸道菌群特定的轉化酶作用下,才能轉化成具有藥理或毒理的有效成分[5-7]。本實驗采用離體人腸道菌群,揭示離體人腸道菌群對葒草花有效成分的影響,以期為探索葒草花有效組分在體內的作用機制提供參考。
1 儀器與材料
1.1 儀器
1290 Infinity型超高壓效液相色譜(美國Agilent公司),micrOTOF-QⅡ型電噴霧-四級桿-飛行時間質譜儀(德國布魯克公司),CDH6000BⅡ型電熱恒溫培養箱(天津市泰斯特儀器有限公司),SW-CJ-2FD型超凈工作臺(蘇州蘇潔凈化設備有限公司),YXQ-LS-18SI型手提式壓力蒸汽滅菌器(上海博迅實業有限公司),Allegra 64R型低溫高速離心機(美國Beckman Coulter 公司),MTN-2800 D型氮吹濃縮裝置(天津奧特塞恩斯儀器有限公司)。
1.2 實驗材料
葒草花藥材購自貴州貴陽鹿沖關貴州省藥用植物園種植基地,經貴州醫科大學藥學院生藥學教研室龍慶德副教授鑒定為蓼科植物葒草PolygonumorientaleL.的花序;葒草花有效組分(自制),山柰酚、槲皮素、原兒茶酸、槲皮苷對照品(四川維克奇生物科技有限公司),沒食子酸對照品(中藥固體制劑制造技術國家工程研究中心) ,山柰素-3-O-β-D-葡萄糖苷對照品、山柰素-3-O-α-L-鼠李糖苷對照品、兒茶素對照品實驗室自制(采用1NMR、13MR、MS、UV、IR波普進行結構鑒定,用UPLC-PDA在多個檢測波長下測定,其峰面積歸一化均大于98),厭氧產氣袋,厭氧培養罐(日本三菱瓦斯化學株式會社),蛋白胨(上海博微生物科技有限公司),營養瓊脂培養基、小牛浸膏(杭州微生物試劑有限公司),L-半胱氨酸(上海藍季科技發展有限公司),L-抗壞血酸(北京索萊寶科技有限公司),乙腈為色譜純(德國Merck公司),甲酸為色譜純,水為純凈水,其他試劑均為分析純。
2 實驗方法
2.1 葒草花有效組分的制備
稱取葒草花藥材6 kg,加10倍量水煎煮3次,濾液合并濃縮,加入乙醇使含醇量達65%,靜置過夜,回收乙醇,殘留物用0.5倍量水飽和正丁醇萃取4次,回收正丁醇,殘留物用乙醇溶解,上聚酰胺柱,用80%乙醇洗脫,收集流出液和洗脫液,回收乙醇,殘留物水浴揮干。
2.2 色譜條件
Agilent Eclipse Plus C18RRHD色譜柱(2.1 mm×100 mm,1.8 μm),柱溫45 ℃,進樣體積為1 μL,流動相0.1%甲酸水(A)-0.1%甲酸乙腈(B)進行梯度洗脫(0~4.0 min,5%~45% A;4.0~10.0 min,45%~95% A;10.0~15.0 min,95%~100% A;20.0~21.0 min,95%~0%A ;21.0~22.0 min,0%~5% A)。
2.3 質譜條件
電噴霧離子源,掃描方式為負離子掃描(ESI-:m/z50~1 000),毛細管電壓3.5 kV(ESI-),離子源溫度 200 ℃,霧化氣N2,壓力1.2 bar,N2溫度180 ℃,干燥氣溫度 200 ℃,氣體體積流量 6 L/min,準確質量測定采用甲酸鈉校正標準液,校正模式選用 Enhanced Quadratic.數據分析采用 Data Analysis軟件, Metabolite Predict(micrOTOF 2.3)軟件,Metabolite Detect(micrOTOF 2.3)軟件、質量虧損過濾(MDF)。
2.4 實驗方法
2.4.1 厭氧培養液的配制[8]
37.5 mL A液(0.78% K2HPO4),37.5 mL B液(0.47% KH2PO4,1.18% NaCl,1.2% (NH4)2SO4,0.12% CaCl2,0.25% MgSO4·H2O),C 液50 mL 8%Na2CO3。0.5 gL-半胱氨酸,2 mL 25%L-抗壞血酸,1 g牛肉膏,1 g蛋白胨,1 g營養瓊脂,加蒸餾水至1 L,鹽酸調pH7.5~8.0。
2.4.2 供試品制備
取葒草花提取物0.12 g,加入50%甲醇水6 mL,充分溶解,備用。
2.4.3 人離體培養腸道菌群對葒草花有效組分的代謝[9]
取健康成人新鮮糞便,按1 g糞便 4 mL 0.9%生理鹽水混合均勻超聲10 min,6 000 rpm離心5 min,取上清液即為人腸菌培養液。將0.5 mL人腸菌培養液加入6 mL厭氧培養液中(已滅菌),混勻,迅速置于厭氧培養罐中,加入1個厭氧產氣袋后蓋上培養罐蓋,置于37 ℃恒溫培養箱中培養24 h,使腸菌培養液中的腸道菌充分成長。實驗分為3組,實驗組、空白對照A組、空白對照B組。實驗組:將離體腸道菌液與葒草花提取物溶液60 μL,混合均勻,立即置于于厭氧培養罐中,加入1個厭氧產氣袋后迅速蓋上培養罐蓋,置于37 ℃恒溫培養箱,分別培養4、12、36、72 h (n=3)后,放入-20 ℃保存,備用。空白對照A組,空白離體腸道菌液(不加紅草花提取物);空白對照B組, 將厭氧培養液和葒草花提取物混合,將上述樣品按照實驗組方法進行厭氧培養。所用器具均經高壓蒸汽121 ℃滅菌20 min。
2.4.4 樣品處理方案
將“2.4.3”項下的生物樣品,分別轉入50 mL離心管中,分別向其中加入1倍體積乙酸乙酯進行萃取,渦懸震搖3 min,提取3次,合并3次萃取液,于37 ℃下N2吹干。殘渣加200 μL 50%甲醇水進行溶解,15 000 rpm離心5 min,上清液UPLC-Q-TOF/MS進樣分析。
3 實驗結果
3.1 UPLC-Q-TOF/MS分析結果
在“2.4.4”項下,獲得準分子離子峰高分辨質量數和準分子離子峰MS2質譜碎片信息,結合Metabolite Predict(micrOTOF 2.3),Metabolite Detect(micrOTOF 2.3)軟件對葒草花有效組分的代謝產物進行預測分析,得到葒草花有效組分在人腸道菌群中代謝產物圖譜,包括在含藥培養基,空白腸菌液,含藥腸菌液的圖譜以及由質譜軟件計算形成的差異圖譜(見圖1)。
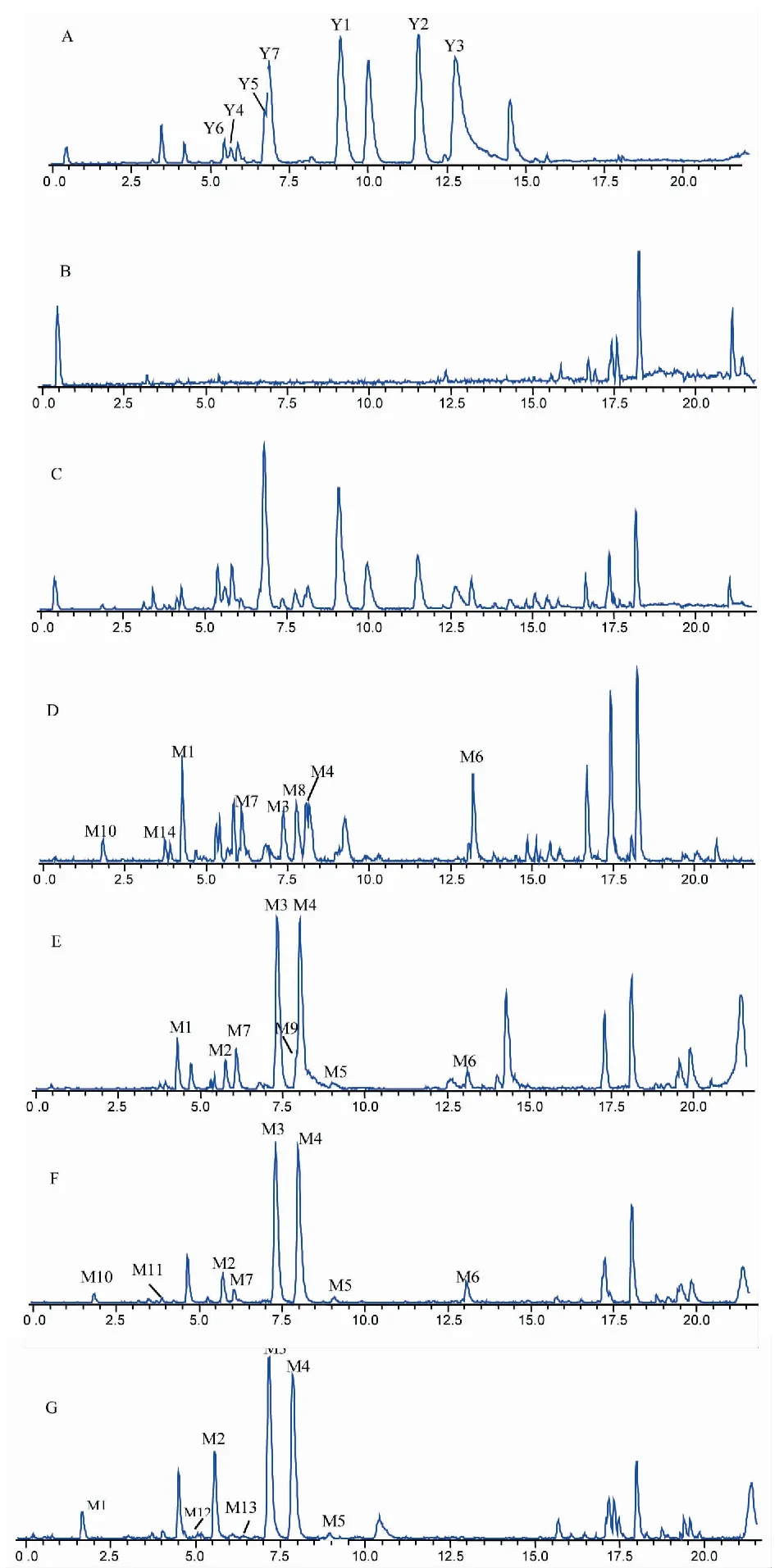
圖1 葒草花有效組分在人腸道菌群中的代謝產物ESI-總離子流圖及4、12、36、72 h含藥腸菌液與空白腸菌液、含藥培養基差異Fig.1 Base peak chromatograms of Polygonum orientale L. flower extract metabolites in man intestinal flora sample in negative mode and different chromatograms are 4, 12, 36 h, and 72h respectively注:A.含藥培養基;B.空白腸菌液;C.含藥腸菌液; D、E、F、G分別是4、12、36、72 h含藥腸菌液。Note:A.Drug-containing medium;B.Blank intestinal fluid;C.Medicinal enteric liquid;D、E、F、G are 4 h,12 h,36 h,72 h drug-containing intestinal bacteria respectively.
3.2 葒草花有效組分在培養基中的原型產物鑒定分析
化合物Y1tR為9.3 min時,負模式下出現準分子離子峰[M-H]-m/z431.099 C21H19O10(err-1.4 ppm),與山柰素-3-O-α-L-鼠李糖苷對照品一致,故推測tR為9.3 min的化合物Y1為山柰素-3-O-α-L-鼠李糖苷。
化合物Y2tR為11.8 min時,負模式下出現準分子離子峰[M-H]-m/z312.122 8 C18H18NO4(err 4.1 ppm),參照相關文獻[2]并結合質譜數據,推測tR為11.8 min時的化合物Y2為N-tans-對羥基苯乙基阿魏酰胺。
化合物Y3tR為12.9min時,負模式下出現準分子離子峰[M-H]-m/z301.036 7 C15H9O7(err-4.3 ppm),與槲皮素標準品相同,故推測tR為12.9min的化合物Y3為槲皮素。
化合物Y4tR為5.7 min時,MS質譜出現準分子離子峰為[M-H]-m/z607.132 5 C27H27O16(err-3.4 ppm)。據參考文獻[10],故推測tR為5.7 min的化合物Y4為山柰酚-3-O-( 2″-O-α-L-鼠李糖基)-β-D-葡萄糖醛酸苷。
化合物Y5tR為6.8 min時,負模式下出現準分子離子峰[M-H]-m/z447.092 7 C21H19O11(err 1.3 ppm),與山柰素-3-O-β-D-葡萄糖苷標準品相同,故推測tR為5.6 min的化合物5為山柰素-3-O-β-D-葡萄糖苷。
化合物Y6tR為5.2 min時,MS質譜出現準分子離子峰[M-H]-m/z623.127 C27H27O17(err-2.6 ppm)。進一步作MS2質譜分析,從中可見[M-H]-m/z623.126 6 C27H27O17(err-1.9 ppm),碎片離子峰[M-H-C6H10O4-C6H8O6]-m/z301.036 6 C15H9O7。根據以上離子碎片信息和參照相關文獻[10],推測tR為5.2 min的化合物Y6為槲皮素-3-O-( 2″-O-α-L-鼠李糖基)-β-D-葡萄糖醛酸苷。
化合物Y7tR為6.9 min時,負模式下,出現準分子離子峰[M-H]-m/z447.093 5 C21H19O11(err-0.4 ppm),與標準品槲皮苷一致,推測tR為6.9 min的化合物Y7為槲皮苷。
3.3 有效組分在人腸道菌群中代謝產物鑒定分析
3.3.1 氫化代謝產物的鑒定
在tR為4.4 min時,負模式下出現準分子離子峰[M-H]-m/z291.087 5 C15H15O6,顯示碎片離子峰[M-H]-m/z136.038 5C7H7O3,故推測tR為4.4 min的化合物M1為兒茶素的氫化代謝產物。在tR為7.6 min時,負模式下出現準分子離子峰[M-H]-m/z284.129 1 C17H18NO3,進一步作MS2質譜分析,出現準分子離子峰[M-H]-m/z284.128 1 C17H18NO3,碎片離子峰[M-H-C7H6O]-m/z178.087 4 C10H12NO2。由離子碎片信息可見,準分子離子峰[M-H]-m/z284丟失106 Da形成離子碎片峰[M-H-C7H6O]-m/z178,為化合物N-p-香豆酰酪胺丟失122 Da(-C7H6O)、氫化碎片離子。參照相關文獻[3]并結合質譜數據推測tR為7.6 min的化合物M3為N-p-香豆酰酪胺的氫化代謝產物。在tR為8.3 min時,負模式下出現準分子離子峰[M- H]-m/z314.140 4 C18H20NO4,進一步作MS2質譜分析,出現準分子離子峰[M-H]-m/z314.139 2 C18H20NO4,碎片離子峰[M-H-C7H6O]-m/z180.066 3 C9H10NO3。由離子碎片信息可見,準分子離子峰[M-H]-m/z314丟失134 Da形成離子碎片峰[M-H-C9H10O]-m/z180,為N-tans-對羥基苯乙基阿魏酰胺丟失134 Da (-C8H8O-CH2) 、氫化碎片離子。故推測tR為8.3 min的化合物M4為化合物M7(N-tans-對羥基苯乙基阿魏酰胺)的氫化代謝產物。
3.3.2 氫化、羥基化代謝產物鑒定
在tR為6.0 min時,負模式下出現準分子離子峰[M-H]-m/z300.123 8 C17H18NO4,進一步作MS2質譜分析,出現準分子離子峰[M-H]-m/z300.1 25 3 C17H18NO4,碎片離子峰[M-H]-m/z178.086 6 C10H12NO2。由離子碎片信息可見,準分子離子峰[M-H]-m/z300丟失122 Da(-C7H6O2)形成離子碎片峰[M-H-C7H6O2]-m/z178,與化合物M3離子碎片峰一致。準分子離子峰[M-H]-m/z300較化合物M3增加16 Da(+OH), 故推測tR為6.0 min的化合物M2為N-p-香豆酰酪胺的氫化、羥基化代謝產物。在tR為6.3 min時,負模式下, 出現準分子離子峰[M-H]-m/z330.133 7 C18H20NO5,較化合物M4增加16 Da (+OH), 且其親水性增加,保留時間變短,推測tR為6.3 min的化合物M13為N-tans-對羥基苯乙基阿魏酰胺的氫化、羥基化代謝產物。在tR為3.9 min時,負模式下,分別出現準分子離子峰[M-H]-m/z303.050 2 C15H11O7(err 2.6 ppm),較山柰酚增加18 Da (+OH+2H) ,且其親水性增加,保留時間變短,故推測tR為3.9 min的化合物M14為山柰酚羥的基化、氫化代謝產物。
3.3.3 甲基化代謝產物鑒定
在tR為3.6 min時,負模式下,出現準分子離子峰[M-H]-m/z183.029 8 C8H7O5,較沒食子酸增加14 Da (+CH2), 且親脂性較為增大,故推測tR為3.6 min的化合物M11為沒食子酸甲基化代謝產物。
3.3.4 甲基化、羥基化代謝產物鑒定
在tR為9.3 min時,負模式下,出現準分子離子峰[M-H]-m/z344.150 8 C19H22NO5,較化合物M4增加30 Da (+CH2+OH)。故推測tR為9.3 min的化合物M5為N-tans-對羥基苯乙基阿魏酰胺的甲基化、羥基化代謝產物。
3.3.5 C2-C2雙鍵還原、O-C2鍵開環裂解代謝產物鑒定
在tR為6.2 min時,負模式下,出現準分子離子峰[M-H]-m/z305.066 8 C15H13O7,較槲皮素增加4 Da (+4H),故推測tR為6.2 min的化合物M7為槲皮素C2-C2雙鍵還原、O-C2鍵開環裂解代謝產物。
3.3.6 C2-C2雙鍵還原代謝產物鑒定
在tR為7.8 min時,負模式下,出現準分子離子峰[M-H]-m/z287.056 C15H11O6,較山柰酚增加2 Da (+2H), 故推測tR為7.8 min的化合物M8為山柰酚C2-C2雙鍵還原代謝產物。
3.3.7 羥基化代謝產物鑒定
在tR為8.0 min時,負模式下,出現準分子離子峰[M-H]-m/z317.029 7 C15H9O8,較槲皮素增加16 Da (+OH),親水性增加,故推測tR為8.0 min的化合物M9為槲皮素羥基化代謝產物。
3.3.8 脫羧基代謝產物鑒定
在tR為1.9 min時,負模式下,出現準分子離子峰[M-H]-m/z125.025 C6H5O3,較沒食子酸減少44 Da (-COOH), 且親水性較為增大,故推測tR為1.9 min的化合物M10為沒食子酸脫羧基代謝產物。
3.3.9 氫化、二羥基化代謝產物鑒定
在tR為5.0 min時,負模式下, 出現準分子離子峰[M-H]-m/z316.118 8 C17H18NO5(err-0.2 ppm),較化合物M3增加32 Da(+2OH),親水性較為增加,保留時間變短,故推測tR為5.0 min的化合物M12為N-p-香豆酰酪胺的氫化、二羥基化代謝產物。
3.3.10 羰基化代謝產物鑒定
在tR在13.3 min時,負模式下,出現準分子離子峰[M-H]-m/z329.031 1 C16H9O8,較槲皮素增加28 Da(+CO),親水性較為增大,故推測tR為13.3 min的化合物M6為槲皮素羰基代謝產物。
3.4 葒草花有效組分在人腸道菌群孵育液中的代謝物生物轉化途徑
根據以上代謝產物的鑒定結果,葒草花有效組分在人腸道菌群孵育液中的代謝物生物轉化途徑(見表1,圖2)。
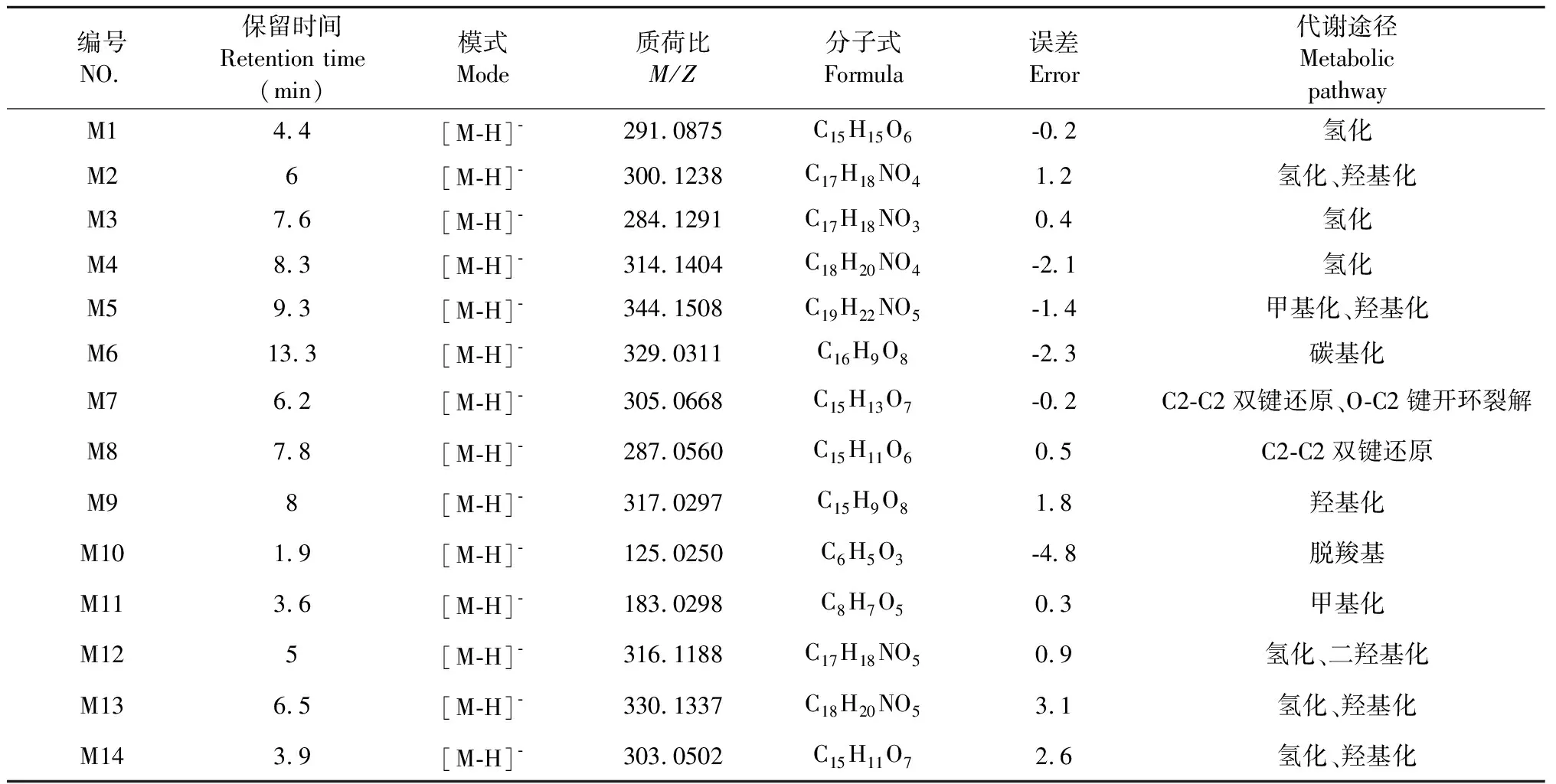
表1 葒草花有效組分在人腸道菌群孵育液中的代謝物分析Table 1 Analysis of metabolites of effective components of Polygonum orientale L. flower in human intestinal flora
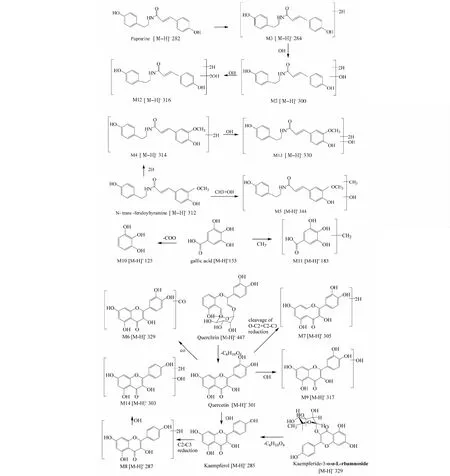
圖2 葒草花有效組分在人腸道菌群中可能的代謝途徑Fig.2 Possible metabolic pathway of Polygonum orientale L. Flower extract in human intestinal flora
4 討論
傳統中藥主要是經口服給藥,而腸道是口服藥物在體內代謝的重要場所,雖然某些中藥在血漿中的原形成分和生物利用度不高,但卻有很好的療效,這與腸道內寄居的大量細菌對藥物的生物轉化作用密不可分。目前,國內對中藥單一有效組分在腸道菌群中的代謝研究較多,而患者服用的藥物往往是多成分的,發揮藥效作用的也不僅僅是單一成分代謝物藥理活性簡單的疊加[5,11]。因此,研究多成分中藥在腸道菌群中的代謝產物,闡明腸道菌群與中藥有效成分的作用機理,將有助于開發新型中藥制劑和提高中藥制劑的有效利用[12]。
針對中藥在腸道菌群的代謝研究,合適的檢測分析方法將有效的闡明有效成分在體內的代謝轉化過程,本實驗采用的UPLC-Q-TOF/MS分析方法,與傳統分析方法相比具有高效、高靈敏度、檢測模式多樣、專屬性強、分析速度快、并提供豐富的數據信息和數據處理等優點[13]。
在本實驗中,葒草花有效組分經離體人腸道菌群的代謝后,共檢測到14個代謝產物,主要包括N-p-香豆酰酪胺、N-tans-對羥基苯乙基阿魏酰胺的氫化、氫化羥基化、甲基化羥基化代謝產物,山柰酚的雙脫氧、C2-C3雙鍵還原、脫氧氫化代謝產物,槲皮素的羥基化、O-C2鍵開環裂解脫氧化、C2-C3雙鍵還原O-C2鍵開環裂解代謝產物,兒茶素的氫化代謝產物和沒食子酸的脫羧、甲基化代謝產物。在腸菌液孵育4 h后葒草花有效組分發生了脫羥基、氫化羥基化、氫化、C2-C2雙鍵還原、O-C2鍵開環裂解、甲基化代謝反應,而對比12、36、72 h除了其共有的代謝反應外,發現36 h發生了脫羧基代謝反應,72 h發生了氫化二羥基化反應。從圖1中可以看出,大多數代謝產物隨著時間的推移,檢測到該代謝產物的量越來越少,推測其代謝產物,又進行了二次代謝。而其少部分的代謝產物如M3、M4其發生氫化代謝反應后,隨著時間的推移,其代謝產物的量沒有明顯的變化,這可能由于M3、M4發生氫化代謝反應后其代謝產物的穩定性得到了改善,使其在腸菌液能夠穩定存在。綜合腸道菌群的實驗結果,表明葒草花有效組分在體內吸收的過程中,可能會被腸道里的菌群代謝成小分子物質或水溶性增強的物質,從而影響葒草花有效組分的生物利用度,而其有效成分的各個成分具體是被腸道中的何種細菌作用,還需進一步研究。
葒草花因具有抗心肌缺血的作用而被關注,其有效組分中主要有槲皮素、山柰酚、沒食子酸等活性物質。研究表明,槲皮素、山柰酚、沒食子酸具有保護心肌的作用[14-16]。但葒草花有效組分經口服吸收后,絕對生物利用度較低,抗心肌缺血作用卻顯著,很可能是其有效組分經代謝轉化后的代謝產物產生作用,但具體的作用物質和機制還有待研究。實驗結果初步判斷了其有效成分在人離體腸道菌群的代謝情況,但對全面反映葒草花有效組分在體內代謝過程具有一定的局限性,還需從血液、膽汁、尿液、糞便等角度全面反映其有效組分在體內的代謝過程。本實驗結果表明,葒草花有效組分經離體人腸道菌群的作用后,發生了羥基化、雙羥基化、脫氧、氫化還原等Ⅰ相代謝反應和甲基化Ⅱ相代謝反應,這為進一步研究其在體內具體作用的物質和機制提供實驗基礎。

