棕櫚酸通過上調Wnt5a基因表達抑制胰島β細胞瘤INS-1細胞增殖
吳杏兒,孫世珺,鄭 磊
(1.廣東省中山市人民醫院分子診斷中心 528403;2.南方醫科大學南方醫院檢驗科,廣州 510515)
胰島β細胞受損是2型糖尿病(T2DM)的特征之一[1]。血循環中游離脂肪酸(FFAs)升高可引起胰島β細胞數量明顯減少[2]。體外實驗發現,FFAs對嚙齒類動物及人的胰島β細胞同時產生誘導凋亡及抑制增殖的效應[2-3]。迄今已有大量研究闡釋FFAs如何誘導胰島β細胞凋亡,如FFAs激活神經酰胺通路、引起線粒體膜損傷等機制已被證實與β細胞凋亡關系緊密[3-4]。然而,FFAs抑制胰島β細胞增殖的機制尚不明確。進一步研究FFAs抑制胰島β細胞增殖的可能機制,有助于了解脂毒性參與糖尿病發生、發展的過程,以及為可能的藥物開發甚至治療策略改進提供依據。Wnt信號通路是一類參與調節器官發育、細胞有絲分裂等過程的重要信號通路,其不同層面的信號分子在胰腺組織中均有不同程度的表達[5]。目前鼠及人類Wnt配體家族成員已知的有19個,不同的Wnt蛋白亞型可起不同的生物學效應。筆者前期研究發現,Wnt5a亞型在β細胞系INS-1細胞及小鼠胰島中基礎表達豐度高,可通過激活鈣調蛋白依賴蛋白激酶Ⅱ(CaMKⅡ)通路下調細胞周期蛋白D1(Cyclin D1)表達;此外,首次報道了Wnt5a是抑制β細胞增殖的重要調控基因[6]。有研究表明,Wnt5a與脂代謝紊亂密切相關[7]。然而Wnt5a是否參與介導脂毒性抑制β細胞增殖尚未明確。本實驗利用飽和脂肪酸棕櫚酸(PA)刺激大鼠胰島β細胞系INS-1細胞,觀察其對Wnt5a基因表達的調控作用,探討PA抑制胰島β細胞增殖的可能機制,為進一步理解脂毒性損傷β細胞及治療糖尿病提供理論依據。
1 材料與方法
1.1 主要材料 大鼠胰島β細胞瘤INS-1細胞[美國典型培養物保藏中心(ATCC)細胞庫]。小牛血清和RPMI-1640培養基(美國Gibco公司);PA、牛血清蛋白(BSA)、2-巰基乙醇、4-羥乙基哌嗪乙磺酸(HEPES)、二甲基亞砜(美國Sigma公司);小干擾RNA(siRNA,廣州吉捷生物科技有限公司);EdU試劑盒(銳博生物技術公司);轉染試劑LipofectamineTM2000、PCR引物(美國Invitrogen公司);兔抗鼠Wnt5a抗體、兔抗鼠甘油醛-3-磷酸脫氫酶(GAPDH,14C10)抗體(美國Cell Signal Technology公司);辣根過氧化物酶標記IgG(弗德生物技術有限公司);Eastep通用型總RNA提取試劑盒、GoScriptTM反轉錄試劑盒、GoTaq?qPCR Master Mix(美國Promaga公司)。熒光定量PCR儀7500(美國ABI公司);倒置熒光顯微鏡(日本Olympus公司)。
1.2 方法
1.2.1 細胞培養及分組 大鼠胰島β細胞瘤細胞INS-1培養在37 ℃、含5% CO2的培養箱,每100毫升細胞培養液含有10%小牛血清、1%青/鏈霉素雙抗、2-巰基乙醇0.35 μL、碳酸氫鈉0.2 g、10 μmol/L HEPES 0.1 mL。以含0.25%胰酶消化細胞傳代,每隔24 h更換1次培養液。細胞分組:(1)EdU標記實驗中細胞分為溶劑對照組(BSA組),200 μmol/L PA刺激24、48 h組,500 μmol/L PA刺激24、48 h組,1 000 μmol/L PA刺激24、48 h組;(2)實時熒光定量PCR(qRT-PCR)實驗中細胞分為:溶劑對照組,200 μmol/L PA刺激1、6、12、24 h組,以及200、500、1 000 μmol/L PA刺激6 h組;(3)Western blot實驗中細胞分為:溶劑對照組,200 μmol/L PA刺激1、3、6、12、24、36 h組,以及200、500、1 000 μmol/L PA刺激6 h組;(4)siRNA轉染實驗中細胞分為:轉染無意義siRNA組(NC組)、轉染siRNA-Wnt5a-1組、轉染siRNA-Wnt5a-2組、轉染無意義siRNA+500 μmol/L PA組、轉染siRNA-Wnt5a-1+500 μmol/L PA組、轉染siRNA-Wnt5a-2+500 μmol/L PA組(轉染培養36 h后予 PA繼續共培養24 h)。
1.2.2 EdU標記染色法檢測細胞增殖率 細胞染色:細胞以4×104個/孔密度種植至鋪有蓋玻片的24孔板,細胞貼壁后更換培養基,進行轉染或共培養,離觀察終點2 h前往培養基中加入EdU溶液(終濃度為50 μmol/L),按試劑盒說明固定細胞、染色及鋪片。細胞增殖率計數:使用倒置熒光顯微鏡,觀察Appolo567染色使用550 nm激發光,觀察Hoechst3342染色使用350 nm激發光,放大倍數為400倍。每復孔等分4象限,每個象限隨機拍攝3張不同視野照片均計數,分別計算細胞核(Hoechst)及增殖細胞(Appolo)染色細胞數,Appolo/Hoechst比值為細胞增殖率,每復孔Hoechst染色陽性細胞計數大于1 000個。同組設3個復孔,取增殖率平均數及標準差。
1.2.3 脂質體法轉染siRNA 按LipofectamineTM2000轉染試劑盒操作說明,分別將含有1 μg無意義siRNA,Wnt5a-siRNA-1(5′-CAA GGA AUU CGU GGA CGC ACG AGA AdT d-3′,5′-UUC UCG UGC GUC CAC GAA UUC CUU GdT d-3′)及Wnt5a-siRNA-2(5′-GCA UCC UCA UGA ACU UGC ACA ACA AdT d-3′,5′-UUG UUG UGC AAG UUC AUG AGG AUG CdT d-3′)稀釋液加入含無血清培養基的EP管中混勻,緩慢加至含1 μL LipofectamineTM2000的50 μL無血清培養基中,混勻后室溫靜置20 min形成轉染復合物。使用轉染復合物培養細胞6~8 h后吸出轉染復合物,換含有血清的培養基繼續培養,總培養時間為36 h。到達實驗終點收集細胞用于Western blot檢測或EdU標記染色進行細胞增殖率計數。
1.2.4 qRT-PCR檢測Wnt5a表達水平 RNA轉錄為cDNA:按試劑盒說明柱提法冰面操作提對數生長期細胞總RNA,行反轉錄。按試劑盒說明進行反轉錄,反應條件:25 ℃退火5 min,延伸1 h,70 ℃滅活15 min。cDNA樣本-20 ℃保存備用。RT-PCR反應體系:反應總體系為20 μL,包括反轉錄產物樣品5 μL,無酶核酸水4 μL,正、反向引物各0.8 μL,Master Mix 2×10 μL。CXR100×0.2 μL。反應條件:95 ℃ 10 min,95 ℃ 15 s后60 ℃ 1 min(40個循環)。mRNA相對表達水平采用2-△△Ct方法計算,內標基因為β-actin。
1.2.5 蛋白質印跡法(Western blot)檢測細胞Wnt5a的表達 按分組處理細胞,提取蛋白后用12%十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)分離蛋白質,轉膜,4% BSA封閉2 h,PBS洗膜3次后加一抗(1∶1 000),4 ℃孵育過夜,洗膜3次加二抗(1∶5 000)室溫孵育1 h,洗膜后于暗室中加入發光劑,顯影后定影。以GAPDH為內參,Image J軟件灰度掃描圖像檢測Wnt5a蛋白表達差異。
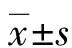
2 結 果
2.1 PA對INS-1細胞增殖的影響 EdU標記法檢測不同濃度PA處理INS-1細胞24、48 h后細胞增殖率的變化,結果顯示,與溶劑對照組相比,PA各濃度處理組或同一濃度不同時間組的細胞增殖率明顯下降,差異有統計學意義(P<0.05), PA抑制INS-1細胞增殖具有濃度及時間依賴性,見圖1。

A:EdU標記細胞增增率分析圖;B:不同濃度PA處理細胞24 h后EdU標記染色圖(×400);*:P<0.05,與溶劑對照組(0 h)比較
圖1 PA對INS-1細胞增殖的影響
A:200 μmol/L PA處理細胞不同時間后Wnt5a mRNA表達水平;B:不同濃度PA處理細胞6 h后Wnt5a mRNA表達水平;*:P<0.05,與溶劑對照組比較
圖2 PA對INS-1細胞Wnt5a mRNA轉錄水平的影響
2.2 PA對INS-1細胞Wnt5a mRNA轉錄水平的影響 qRT-PCR檢測200 μmol/L PA處理細胞后Wnt5a mRNA隨時間表達變化,結果顯示,自6 h起細胞Wnt5a mRNA表達水平明顯升高(P<0.05),見圖2A。使用不同濃度PA刺激細胞6 h,結果顯示,細胞Wnt5a mRNA表達水平隨 PA濃度升高逐漸增加(P<0.05),見圖2B。
2.3 PA對INS-1細胞Wnt5a蛋白表達水平的影響 Western blot檢測200 μmol/L PA處理細胞后Wnt5a蛋白隨時間表達變化,結果顯示,自6 h起細胞Wnt5a的蛋白表達水平明顯升高(P<0.05),見圖3A。使用不同濃度PA刺激細胞6 h,結果顯示,細胞Wnt5a的蛋白表達水平隨PA濃度升高逐漸增加(P<0.05),見圖3B。
2.4 沉默Wnt5a表達對PA抑制INS-1細胞增殖的影響 使用兩組不同的siRNA瞬時轉染沉默Wnt5a,轉染36 h后Western blot驗證siRNA序列的有效性,見圖4。使用siRNA-Wnt5a轉染細胞24 h后予500 μmol/L PA繼續刺激細胞24 h,EdU標記法檢測細胞增殖率,結果顯示,轉染無意義siRNA情況下,PA降低細胞增殖率;沉默Wnt5a后PA抑制細胞增殖的效應明顯減弱,差異有統計學意義(P<0.05),見圖5。

A:200 μmol/L PA處理細胞不同時間后Wnt5a的蛋白表達水平;B:不同濃度PA處理細胞6 h后Wnt5a的蛋白表達水平;*:P<0.05,與溶劑對照組比較
圖3 PA對INS-1細胞Wnt5a蛋白表達的影響

A:Western blot檢測轉染無意義siRNA或siRNA-Wnt5a各組中Wnt5a蛋白表達;B:轉染無意義siRNA或siRNA-Wnt5a各組中Wnt5a蛋白表達分析圖;*:P<0.05,與轉染無意義siRNA(NC組)比較
圖4轉染無意義siRNA或siRNA-Wnt5a各組中Wnt5a蛋白表達

A:轉染各組細胞EdU標記染色圖(×400);B:轉染各組細胞增殖率分析圖;*:P<0.05,與NC+PA組比較
圖5 EdU標記轉染siRNA-Wnt5a對PA抑制INS-1細胞增殖的影響
3 討 論
脂毒性與β細胞數量減少密切相關,FFAs對β細胞同時產生誘導凋亡及抑制增殖的效應,大量研究已經對FFAs如何誘導β細胞凋亡進行了詳盡的機制闡釋:如在多種不同來源的胰島β細胞中神經酰胺通路已被證實與β細胞凋亡關系緊密[3],FFAs介導線粒體膜損傷導致一系列細胞因子(如細胞色素C)釋放,可誘導β細胞凋亡[4]。然而,FFAs抑制胰島β細胞增殖的機制尚不清楚。在T2DM疾病發展過程中,脂、糖代謝紊亂常相伴出現,FFAs可明顯抑制葡萄糖誘導的β細胞增殖,具有分泌功能的β細胞數量減少,機體最終失代償發展成為T2DM[8]。因此,探索FFAs抑制β細胞增殖的機制對理解T2DM發病機制及研究治療策略十分重要。
大量報道顯示,Wnt5a與脂代謝紊亂關系密切:T2DM大鼠肝臟Wnt5a表達水平明顯升高[7];動物實驗中Wnt5a基因敲除可減輕脂肪組織的炎性反應,并同時改善胰島素抵抗[9]。Wnt5a及其受體廣泛表達于多種組織,HELLER等[10]通過RT-PCR檢測發現,在人胰島中Wnt5a是Wnt配體家族中表達豐度最高的亞型之一。過去發現Wnt5a在調控β細胞遷移及胰島發育的過程中起重要作用,但鮮有研究探索Wnt5a在調控β細胞增殖中的作用。筆者前期研究證明,Wnt5a是抑制β細胞增殖的重要調控因子[6]。因此,本研究著重于探索Wnt5a是否參與介導FFAs抑制β細胞增殖。本研究使用了飽和脂肪酸PA刺激大鼠胰島β細胞INS-1,通過EdU標記染色觀察到細胞增殖明顯被抑制。同時,研究發現PA促進Wnt5a mRNA及蛋白的表達呈濃度及時間依賴性。為了進一步闡明Wnt5a在PA抑制INS-1細胞增殖中的作用,本研究使用脂質體法瞬時轉染有效的siRNA序列沉默Wnt5a基因表達,再給予PA刺激細胞。通過EdU標記檢測發現,與轉染無意義siRNA+PA組相比,轉染siRNA-Wnt5a+PA組細胞增殖率明顯回升,表明Wnt5a參與介導PA抑制INS-1細胞增殖過程,PA通過上調Wnt5a基因表達抑制INS-1細胞增殖。
本研究觀察到PA可調控INS-1細胞Wnt5a基因表達,但相關調控機制尚未闡明。有報道指出,在人類Wnt5a基因序列啟動子區域存在核因子-κB(NF-κB)(-111/-101)、Forkhead-box(FOX,-780/-770)、Smad(-1965/-1953)等轉錄因子的結合位點[11]。而在脂肪細胞及內皮細胞中PA可激活NF-κB轉錄活性[12-13];游離脂肪酸被證實可經FOXO1介導胰島素-IGF-1信號通路促進β細胞系MIN6細胞凋亡[14]。至于轉錄因子Smad2和Smad3,則有報道指出它們與部分胰腺切除術后胰島細胞增殖抑制密切相關[15]。雖無胰島β細胞或細胞系實驗提供直接證據揭示PA對Wnt5a基因表達的調控機制,但本課題組已正在進一步開展實驗探索其具體機制。至于PA通過Wnt5a抑制β細胞增殖的下游通路機制,也有待進一步實驗探索。本課題組在前期已通過體外實驗證實,基礎狀態下Wnt5a通過磷酸化CaMKⅡ,下調全細胞β-catenin水平,抑制β-catenin與核內TCF/LEF形成活性轉錄復合物,最終下調細胞周期因子CycinD 1的表達,達到抑制細胞增殖的作用[6]。但PA是否也通過Wnt5a/CaMKⅡ信號通路抑制INS-1細胞增殖尚不清楚,有待進一步研究。
綜上所述,PA抑制胰島β細胞系INS-1細胞增殖,其主要機制與調控Wnt5a基因表達有關。本實驗中PA上調Wnt5a基因表達抑制INS-1細胞增殖的具體機制并未闡明,有待進一步研究探索。

