高位食管癌調強放療中輸液港對放射劑量分布的影響
林松煥
(江西省贛州市腫瘤醫院放療三科 江西 贛州 341000)
食管癌患者由于疾病原因臨床會出現進食梗阻情況,故為維持人體營養充足,臨床需要給予營養支持,以確保患者能攝入足夠蛋白營養物,目前臨床營養支持主要通過靜脈輸液,但傳統靜脈輸液不僅使患者要經受鋼針穿刺痛苦,同時還存在感染風險[1]。近幾年隨著臨床醫療水平發展,外周靜脈穿刺中心置管(PICC)、植入式靜脈輸液港(VAP)等新型靜脈輸液技術出現,尤其是VAP,能有效避免患者反復穿刺痛苦,還能將藥物、電解質、營養支持直接供應到中心靜脈,從而有效發揮輸送液體的作用,提高治療效果[2]。一般輸液港埋置于患者右前上胸壁處皮下,而高位食管癌患者行調強放射治療時,設計放射照射野可能會穿透輸液港底座材料,由于底座材料密度與皮下組織密度不同,可能對底座周邊軟組織放射劑量造成影響,進而影響治療效果[3]。本文通過觀察高位食管癌輸液港底座不同空間位置放射劑量,旨在分析輸液港對放射劑量分布的影響,為后期臨床癌癥患者放療提供依據。
1.資料與方法
1.1 一般資料
回顧性分析2018年1月—2018年2月期間醫院收治的1例高位食管癌者,年齡61歲,性別男,患者經病理活檢、影像學等檢查確診為高位食管癌,醫院倫理委員會審核通過,符合放療指征,未合并嚴重器質性疾病,無言語或精神障礙,自愿參與簽署知情同意書。
1.2 方法
1.2.1 定位及掃描方法 患者取仰臥位,將頸肩部、頭部以熱塑體膜固定,背部、頸項部以發泡膠固定,以增強CT定位掃描,參數層距、層厚均為5mm。
1.2.2 調強放療 將患者CT定位圖像導入治療計劃系統(Philips Pinnacle 9.2飛利浦)中,制定調強放療計劃(采用多個多角度不規則分布的照射野),在照射時注意對患者正常組織結構(心臟、甲狀腺、肺等)保護。
1.2.3 放射劑量測量 設計能穿透患者輸液港底座的照射野,以皮下5mm深度處(為A1點,畫直徑2mm圓點)、輸液港底座左右側位方向1cm處(分別為L1點、R1點,畫直徑2mm圓點)、輸液港底座后方1cm處(為P1點,畫直徑2mm圓點),分別測量上述標記處放射劑量。
在橫斷面CT圖像中勾畫出輸液港底座,將底座與周邊軟組織的前后左右四處臨界點(分別為A2、P2、L2、R2),并畫直徑為2mm圓點,測量放射劑量。
在治療計劃系統(TPS)中,設置底座材料密度值與周邊軟組織相同參數值,并再次進行測量各處放射劑量,通過DVH(劑量-體積直方圖)觀察各處不同圓點處的平均劑量(mean)、最大劑量(max) 、最小劑量(min)。
1.3 觀察指標
以視野方向的觀視(BEV)為參照空間位置,對射線束入射方向的輸液港底座左右側方及后方等不同空間位置的點劑量。
1.4 統計學分析
以SPSS19.0系統行數據統計學分析,計數資料以n(%)表示,計量資料以(±s)表示,采用χ2或t檢驗,所有結果,以P<0.05為具有統計學意義。
2.結果
2.1 底座密度值調整前后不同空間位置放射劑量
調整密度值后A1、P1受量提高,L1、R1劑量不變,見表1、2。
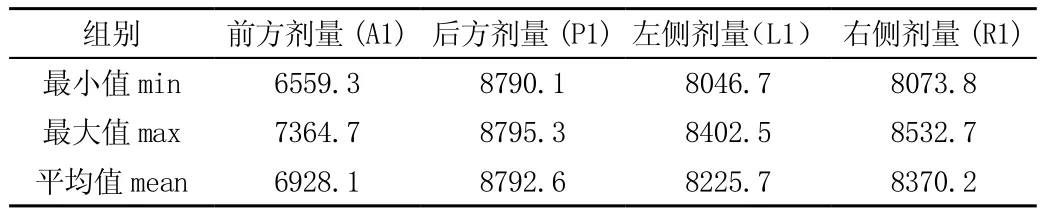
表1 底座不同空間位置放射劑量(單位:cGy)
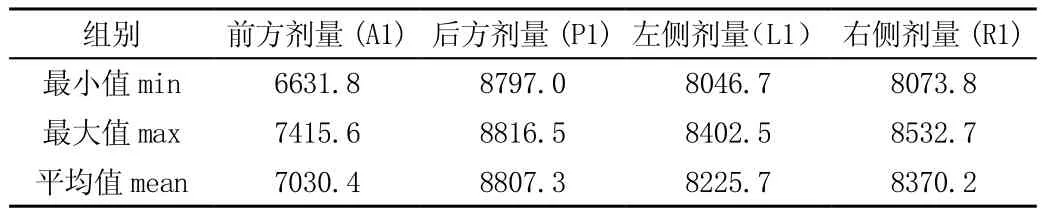
表2 調整密度值后底座不同空間位置放射劑量(單位:cGy)
2.2 底座密度值調整前后與周邊組織臨界處放射劑量
調整密度值后A2、P2受量降低,L2、R2劑量不變, 見表3、4。
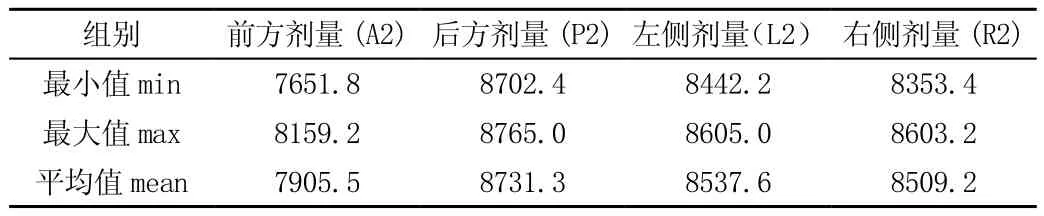
表3 底座與周邊組織臨界處放射劑量(單位:cGy)
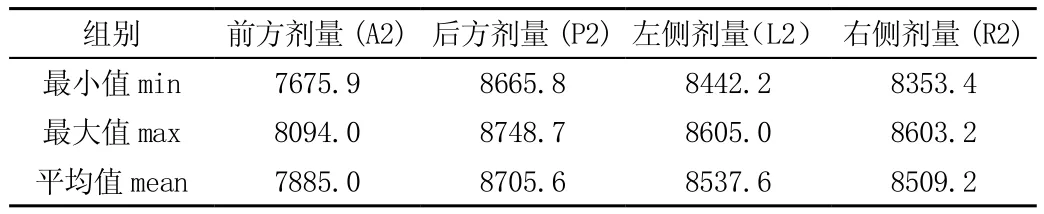
表4 調整密度值后底座與周邊組織臨界處放射劑量(單位:cGy)
3.討論
調強放療是臨床三維適形放療中的一種特殊治療形式,其意指患者照射野內放射劑量強度按治療要求進行調節,其根據患者具體解剖關系,對靶區、危及器官等有針對性將射線束強度調節,從而使得整個靶區體積內劑量分布均勻,臨床認為其較常規放療、三維適形放療,更能有效保護人體正常組織避免損害[4]。但臨床也發現在放療過程中放射劑量不僅受患者咳嗽、心臟搏動、吞咽等影響,還會因射線路徑內穿透的金屬材料影響,導致放療精確性出現偏差。而在調強放療中需要精確放射量,故為優化放射治療,臨床在對高位食管癌放療時,要考慮液港材料對周邊組織的散射效應[5]。
臨床認為人體組織對劑量分布的影響可分為兩類,一個方面與改變原射線吸收、散射線分布有關,一方面與次級電子注量分布改變有關。一般位于不均勻組織附近點,主要受散射線改變影響,組織后方的點受原射線衰減影響,在組織中及組織界面處,主要受次級電子注量改變影響[6]。本次結果顯示調整底座密度值后不同空間位置A1、P1受量提高,與周邊組織臨界處A2、P2受量降低,提示輸液港的植入會造成局部人體組織密度不均勻,從而使放射線受衰減作用、散射效應影響,造成靶區劑量分布改變,使得周圍組織照射劑量增加。故建議臨床在對有輸液港植入的高位食管癌患者行調強放療時,要對劑量進行修正,以減少植入物對照射劑量分布的影響,減少患者副反應發生,提高放療成功率。
綜上所述,植入輸液港的高位食管癌者臨床在行調強放療時會對劑量分布造成一定影響,周圍組織照射量會增加、植入物前后方劑量會減少。

