淺析藥品生產企業質量投訴管理體系的建立
尚海賓 裴慶晗
(1.白云山湯陰東泰藥業有限責任公司,河南安陽456150;2.綠谷(本溪)制藥有限公司,遼寧本溪117004)
0 引言
藥品是一種特殊商品,用于預防、治療、診斷人的疾病。為加強藥品監督管理,保證藥品質量,保障人體用藥安全,維護人民身體健康和用藥安全有效的合法權益,我國藥品生產質量管理規范(2010年版)[1]和《食品藥品投訴舉報管理辦法》[2]均對藥品生產企業的藥品質量投訴管理工作提出了明確要求。
本文依據以上法規條款,對藥品生產企業如何建立詳盡的藥品質量投訴管理體系進行了研究分析,以便藥品生產企業的藥品質量投訴得到及時、有效的處理。為持續提高藥品質量投訴管理水平,降低藥品質量風險和用藥安全風險,保障人民大眾的用藥安全有效,構建藥品質量投訴渠道,維護藥品生產企業的社會聲譽提供參考依據。
1 藥品質量投訴管理體系的建立
1.1 藥品質量投訴管理
質量受權人應擔任藥品質量投訴管理組組長,該藥品質量投訴管理小組由市場部部長、質量保證部部長、質量控制部部長、生產技術部部長、采購部部長、物料管理部部長、工程設備部部長等組員組成。
通過建立藥品質量投訴管理規程、藥品質量投訴操作規程及相關藥品質量投訴管理記錄,便于藥品質量投訴管理工作的開展。
1.2 藥品質量投訴管理小組職責
1.2.1 市場部
市場部負責質量投訴的信息收集,用戶和藥品生產企業的內外部溝通,用戶的確認反饋,質量投訴的協助調查分析及糾正和預防措施的落實。
1.2.2 質量保證部
質量保證部負責用戶投訴分類、編號、答復用戶,對質量投訴的原因進行調查處理,組織相關部門制定糾正和預防措施,追蹤并確認措施的有效性,并上報質量受權人。
1.2.3 質量控制部
質量控制部負責質量投訴的協助調查,被投訴產品的分析,復驗結果的復核以及與質量控制相關的糾正和預防措施的落實。
1.2.4 生產技術部
生產技術部負責協助質量投訴產品的生產過程控制調查、分析以及與生產管理相關的糾正和預防措施的落實。
1.2.5 采購部
采購部負責協助質量投訴產品的物料采購源頭控制調查、分析以及與物料供應商管理相關的糾正和預防措施的落實。
1.2.6 物料管理部
物料管理部負責協助質量投訴產品的物料入庫驗收、貯存、領用、退回等過程控制的調查、分析以及與物料管理相關的糾正和預防措施的落實。
1.2.7 工程設備部
工程設備部負責協助質量投訴產品的設備操作、清潔、維護等過程控制的調查、分析以及與工程設備管理相關的糾正和預防措施的落實。
1.2.8 質量受權人
質量受權人負責用戶投訴調查的審核批準、糾正和預防措施(CAPA)[3]系統的關閉、用戶投訴系統的關閉、藥品質量投訴調查報告的撰寫以及必要時上報當地藥監部門。
2 藥品質量投訴管理的定義及分類
投訴管理是指對用戶提出的對任何已放行的產品,有關安全性、有效性和質量(包括穩定性、產品性能、均一性)、服務或產品性能不滿的口頭的、書面的、電子的或通過其他任何形式反饋給藥品生產企業的所有信息進行管理。
投訴通常分為兩類。第1類:按照投訴的形式,可分為口頭投訴(包括電話投訴)、書面投訴和電子投訴(包括電子郵件、互聯網等)。第2類:按照投訴的內容,可分為包裝質量瑕疵的投訴和產品內在質量缺陷的投訴。其中,包裝質量瑕疵的投訴是指包裝的損壞、封簽的脫落、標簽的缺失、標識的錯誤以及產品數量和裝量不符(多或少)等與產品包裝有關的各種投訴。產品內在質量缺陷的投訴是指產品外觀性狀改變,產品中混有異物,一項或多項理化指標不符合質量標準,或有證據表明產品的雜質種類增多、雜質含量升高以及產品的主要成分含量有明顯的改變等與產品內在質量缺陷有關的各種投訴。
3 藥品質量投訴管理程序
依據藥品質量投訴信息,對質量投訴的根本原因進行調查、分析,評估質量投訴的影響程度[4-5],初次答復用戶;提出質量投訴的處理措施,最終答復用戶,形成藥品質量投訴調查報告。藥品質量投訴流程示意如圖1所示。
4 藥品質量投訴的實施
4.1 藥品質量投訴受理
4.1.1 藥品生產企業各部門
在收到用戶質量投訴的信件、電話或傳真(包括實樣等)后,應立即或不超過1個工作日告知并送交市場部,由市場部轉交質量保證部,其他部門或個人不得擅自處理。
4.1.2 市場部
在收到投訴信息后,對投訴事件進行描述并明確投訴內容,質量投訴登記內容至少應包括產品名稱、產品規格、產品批號、投訴數量、涉及批次、涉及數量、投訴人姓名、投訴人電話、投訴人地址及郵編、投訴人身份、投訴內容等信息,必要時還包括用戶檢測結果、檢測方法、相關圖譜、圖片證明等內容。信息不夠充分時,聯系用戶索要相關信息,一旦信息充分,立即啟動投訴程序。盡可能收集進一步的詳細資料,確保信息完整(如數量、照片或實物、較詳細的文字描述等),交由質量保證部調查處理。
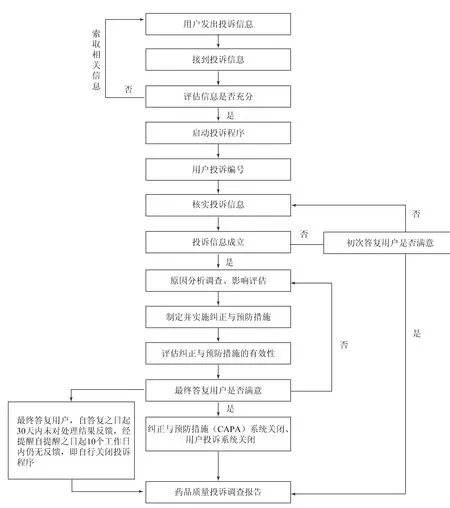
圖1 藥品質量投訴流程示意圖
4.1.3 質量保證部
質量保證部應指派專人負責質量投訴的調查和處理等藥品質量投訴管理工作。
4.2 投訴的調查處理
4.2.1 投訴信息評估
質量保證部接到市場部的質量投訴后,由質量投訴管理員根據質量投訴登記內容對投訴信息進行評估,信息不夠充分時,聯系用戶索要相關信息,一旦信息充分,立即啟動投訴程序。關于原因的調查分析、影響評估、糾正和預防措施(CAPA)的制定,自收到投訴之日起,應在30個工作日內完成。
4.2.2 投訴編號的建立
投訴編號的建立原則:TS表示投訴,2018表示年號,001表示年流水號。例如,投訴編號TS2018001,表示2018年發生的第1次投訴。
4.2.3 初次答復用戶
質量投訴管理員收到投訴后及時或不超過2個工作日初次答復用戶,對投訴進行編號,記錄的質量投訴處理內容至少包括:用戶對答復是否滿意,并承諾對待投訴問題進行調查。可根據投訴事件的性質給定再次答復時間,如包裝類問題在5個工作日內再次答復,產品內在質量問題在10個工作日內再次答復,再次答復時間也可以根據實際情況調整。
4.2.4 核實投訴信息
質量投訴管理員對用戶投訴進行處理。用戶投訴不成立,說明不成立原因,上報質量受權人關閉用戶投訴,直接答復用戶。用戶投訴成立,上報質量受權人,根據投訴的內容,對用戶投訴做進一步處理,核實質量投訴信息應在10個工作日內完成。
4.2.5 原因調查分析
質量保證部應依據質量投訴的根本原因,組織有關人員進行外部或內部的調查、分析,調查內容包括但不限于:
(1)審核投訴產品的有關技術性資料、生產批號,對批生產記錄、批檢驗記錄進行檢查;
(2)必要時查看該產品的穩定性記錄,評估產品的穩定性情況;
(3)必要時調查生產工藝情況、生產設備情況和人員情況;
(4)必要時對該批產品留樣進行檢查和復測;(5)必要時對用戶回寄樣品進行分析;
(6)走訪或電話聯系用戶,耐心聽取用戶意見,了解用戶的有關需求;
(7)會同用戶一起對不符合項的根本原因進行調查;
(8)情況特殊的,可會同當地有關部門對投訴情況進行調查,以詳細了解產品質量問題的有關細節,必要時會同用戶共同對產品進行質量檢驗。
調查工作結束后,由質量保證部部長立即填寫《用戶投訴處理單》,并給用戶出具詳細的調查報告。調查結果顯示,投訴事實不成立,說明不成立原因。如用戶對調查的結果不滿意,則重新啟動投訴程序,找出不符合項的根本原因。調查結果顯示,投訴事實成立,核實投訴信息。用戶對調查的結果滿意后,才可關閉投訴程序。
4.2.6 影響評估
質量保證部應根據質量投訴的根本原因,組織相關部門評估質量投訴的影響程度,提出質量投訴處理措施。影響程度的評估包括但不限于:
(1)對投訴批藥品內在質量和包裝的影響;
(2)對其他批次藥品的影響;
(3)對其他產品的影響;
(4)是否涉及退貨;
(5)是否涉及召回。
經對用戶投訴的原因進行調查、分析、影響評估后,產品如需召回的,藥品生產企業應積極主動地對投訴的問題產品實施召回[6-7],并及時上報當地藥監部門,實時匯報召回情況。
4.2.7 糾正和預防措施的制定
質量保證部應依據質量投訴的原因調查、分析及影響程度評估結果,質量投訴管理小組提出糾正和預防措施,制定糾正和預防措施執行計劃。糾正和預防措施包括但不限于:
(1)系產品嚴重質量缺陷的,按國家有關規定或與客戶共同協商結果進行處理,包括賠償、退貨或召回等。
(2)系包裝質量瑕疵的,耐心地向用戶做出解釋,并對有問題的產品作退貨、換貨或退款處理。
(3)當處理投訴過程中遇到對方提出不合理要求且難以通過協商解決的,可聘請法定的質量檢驗機構和管理部門進行仲裁。
4.3 最終答復
經過原因調查、影響評估及采取糾正和預防措施后,質量保證部在5個工作日內出具書面的調查結果和處理意見并通知市場部,由市場部對投訴者進行投訴信息反饋,并對投訴者的意見進一步分析。如用戶對調查的結果不滿意,則重新進行原因調查、影響評估,找出不符合項的根本原因。如果用戶對調查的結果滿意,則關閉投訴程序。
4.4 糾正和預防措施(CAPA)系統的關閉
為確保類似問題或事件不再發生,相關問題發生部門根據糾正和預防措施計劃,落實糾正和預防措施,質量保證部對糾正和預防措施的有效性進行評估,如糾正和預防措施有效,糾正和預防措施(CAPA)系統關閉。
4.5 用戶投訴系統的關閉
自答復之日起,用戶在30天內沒有對提出的投訴處理結果進行反饋的,質量保證部應通知市場部提醒用戶,如用戶在提醒之日起10個工作日內仍無反饋,即自行關閉投訴程序。
4.6 藥品質量投訴調查報告
質量受權人依據藥品質量投訴管理程序,對藥品質量投訴的受理、投訴的調查處理、最終答復、糾正和預防措施(CAPA)系統的關閉、用戶投訴系統的關閉等藥品質量投訴處理結果進行審核、評價,撰寫藥品質量投訴調查報告。藥品質量投訴藥品存在重大質量問題的或經藥品質量投訴調查涉及自主召回的,應向當地藥監部門上報藥品質量投訴調查報告。藥品質量投訴調查報告應歸檔保存至產品有效期后1年。在用戶投訴處理解決之后,必要時派專人對用戶進行回訪。藥品質量投訴應定期回顧分析投訴記錄,以便發現需要警覺、重復出現以及可能需要從市場召回的藥品問題,并采取相應措施改進產品質量。
5 結語
藥品生產企業加強生產活動的源頭控制、過程控制,是減少藥品質量投訴發生概率的根本,是降低藥品質量風險和用藥安全風險的有效措施。建立健全的藥品質量投訴管理機制,構建用戶與藥品生產企業之間的質量投訴渠道[8-10],可以使藥品生產企業及早發現質量問題,采取相應的管控措施降低問題產品的危害程度和影響范圍,保障人民大眾的用藥安全有效,進而維護藥品生產企業的社會聲譽。